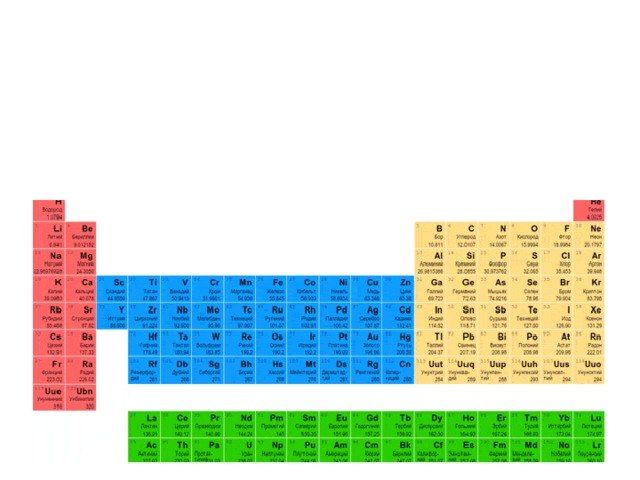
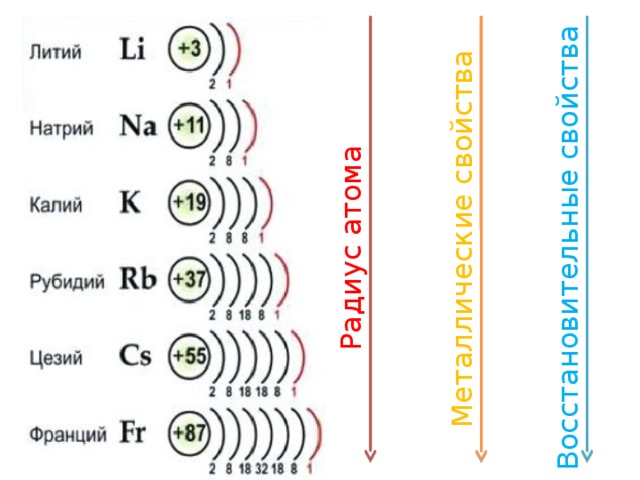
Характерной особенностью строения атомов щелочных металлов является наличие одного электрона на внешнем электронном уровне. Благодаря этому все они с легкостью отдают элетрон, переходя к законченной электронной оболочке предыдущего уровня, являясь очень сильными восстановителями. Хотя щелочные металлы чрезвычайно распространены на Земле, в природе они существуют исключительно в виде соединений из-за высокой восстановительной активности. Na, K открыты Гемфри Дэви в 1807 г., впервые начавшим широко применять электролиз. Li — Йоханн Арфведсон (Швеция, 1817), Rb — Р. Бунзен, Г. Кирхгофф (Германия, 1861), Cs — Р. Бунзен, Г. Кирхгофф (Германия, 1860), Fr — М. Пере (Франция, 1939).
Просмотр содержимого документа
«Щелочные металлы (1 часть)»