Задания школьного этапа олимпиады
по химии в 2021/2022 учебном году
7 класс
Задание № 1.
Выберите правильный ответ(5б)
Молекула - это
1) материал, из которого состоит вещество
2)химически неделимая частица
3)определенный вид атома
4)частица вещества, определяющая его свойства
2.Из перечня выберите вещество
1)уксусная кислота 3) проволока
2) воздух 4) кувшин
3. Из перечня выберите тело
1)уксусная кислота 3) мяч
2)кислород 4) железа
4.Распределите слова на две группы: чистое вещество и смеси
1)гранит 4) воздух
2)кислород 5) железа
3) почва 6)сера
5.Распределите вещества на простые и сложные
1)СиО 3)Н2
2) О2 4) Н2О
6. Из приведенного ниже списка выберите простые вещества, сложные вещества, смеси: алмаз, вода, воздух, гашеная известь, железо, кислород, песок, поваренная соль, сода, углекислый газ, фосфор.
Задание № 2.
Возвратившись домой с урока химии, ученик подумал: «Как же много вокруг химических явлений! Например: а) идет тепло от батареи отопления; б) зажглась неоновая лампа; в) горят именинные свечи; г) мама «гасит» соду уксусом при приготовлении теста; д) засахаривание варенья; е) скисает молоко; ж)плавание сливочного масла на горячей сковородке; з) после добавления сахара чай становится сладким; и) на гвоздях в гараже появляется ржавчина; к) брожение сока». Помогите ученику разобраться, какие процессы химические, а какие физические и почему. (10 б)
Задание№3.
Напишите формулы соединений, пользуясь периодической системой химических элементов, в состав которых входят: а) один атом кальция и два атома фтора; б) два атома натрия и один атом серы; в) два атома алюминия, 3 атома серы и 12 атомов кислорода; г) один атом калия, два атома водорода, один атом фосфора, 4 атома кислорода; д) два атома меди и один атомкислорода. Укажите массовые соотношения элементов в указанных соединениях. (10 б)
Задание № 4.
Вам выдана смесь следующих веществ: железо, сажа, поваренная соль, медь. Предложите план разделения этих веществ. Какое лабораторное оборудование потребуется для разделения этой смеси? (10 б)
8 класс
Задание 1. ТЕСТ Выберите один правильный ответ(1 балл за каждый ответ)
1. Сколько элементов, простые вещества которых неметаллы, представлены сегодня в периодической системе химических элементов д.И. Менделеева?
1) 12 2)22 3)44 4)89
3. Какой элемент назван в честь небесного тела — спутника Земли:
1. Со — кобальт 2. Те — теллур 3. Sе — селен 4. U — уран
3.. Какой элемент назван в честь мифического героя, укравшего огонь у богов:
1. Та — тантал 2. Тh — торий 3. Nb — ниобий 4. Pm — прометий 4.К чистым веществам относится 1) уксус 2) дистиллированная вода 3) воздух 4) молоко 5. Является веществом:1) капля росы;2) медная монета;3) кусочек мела; 4) ртуть.
6.Одинаковую относительную массу имеют вещества ,формулы которых: 1)CuSO4 и CuS 2) CuS и CuO 3) CuO и Cu 2S 4) CuSO4 и Cu 2S 7.Массовая доля серы в серной кислоте H2S04 равна: 1. 2,04%. 2. 65,31%. 3. 32,65%. 4.3,2%
Задание 2.
1.Какие химические элементы названы в честь стран? Приведите не менее четырех названий. Укажите количество протонов и нейтронов, содержащихся в ядрах атомов, названных вами элементах.(за каждое название и страну-1б,протоны и нейтроны-1б)- (8баллов)
2.Вы — пилот самолета, летящего из Сибири в Ярославль. Самолет везёт слитки самого распространённого металла в природе. Сколько лет пилоту? (1балла)
Дополнительный вопрос: какой металл вёз самолет? Почему этот металл в 1827 г. стоил 1200 рублей за 1 кг, а в 1900 г. — 1 рубль?(2 балла)
3.Вы входите в малознакомую квартиру, которая затемнена. Электричество отключено, но есть две лампы: газовая и керосиновая. Что Вы зажжете в первую очередь? (1 балл)
Дополнительный вопрос: где еще применяется газ (предположите, какой) и керосин?(2 балла)
4. Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала древесные стружки с мелкими железными гвоздями, сахар и речным песком и велела Золушке очистить сахар, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро справиться с заданием мачехи. (3б)
9 класс
1. Вам предложены задания с выбором ответа (в каждом задании только один ответ правильный).
1. Формула кислоты, соответствующей высшей степени окисления элемента, – Н2ХО4. Какая из перечисленных кислот может соответствовать этой степени окисления?
1) НХО3; 2) Н2Х2О7; 3) Н2Х2О6; 4) Н3ХО4.
2. Дана схема превращений: СO2 → Х → Ca(НСO3)2. Определите неизвестное промежуточное вещество Х
1) С; 2) Na2CO3; 3) CaCO3; 4) (CuOH)2CO3.
3. При полной диссоциации одного моль вещества образуется 6 моль ионов. Формула этого вещества – …
1) HNO3; 2) Na2SiO3; 3) Ca3(РО4)2; 4) А1(ОН)3.
4. Элемент проявляет в соединениях максимальную степень окисления +6. Какую конфигурацию валентных электронов может иметь этот элемент в основном (невозбужденном) состоянии:
1) 2s2 2p4; 2) 3s2 3p4; 3) 4s2 4d4; 4) 3d64s2
5. Химический элемент железо представлен в природе следующими изотопами:54Fe, 56Fe, 57Fe, 58Fe. Атомы всех этих изотопов содержат в ядрах ______ протонов (ответ запишите цифрами без пробелов).
6. Вещество, которое состоит из неполярной молекулы с ковалентной полярной связью:
1) оксид углерода (1V); 2) сера; 3) алмаз; 4) вода.
7. Массовая доля лития будет наименьшей в соединении:
1) Li2Tе; 2) Li2Sе; 3) Li2O; 4) Li2S
8. Сокращённое ионно-молекулярное уравнение между сульфидом железа и серной кислотой – это
1) S2– +2H+ = H2S; 2) S2– + H2SO4 = H2S + SO42–; 3) FeS + 2H+ = Fe2+ + H2S;
4) FeS + SO42– = FeSO4 + S2–
9. Укажите, как повысить выход продукта реакции D в предложенной равновесной системе:
А (г) + 3 B (г) ↔ C (г) + 2 D(г)
1) увеличить давление; 2) увеличить концентрацию CО2; 3) понизить давление;
10. Как изменится энергия системы (энтальпия реакции), если повышать температуру:
2Р(тв) + 3О2 (г) + Н2(г) = 2НРО3(ж) + 1964,8 кДж.:
1) увеличится; 2) не изменится;
3) правильного ответа дать не могу; 4) уменьшится.
2. Расположите в ряд по убыванию числа ионов, образующихся при диссоциации в водных растворах 1 моль следующих веществ: хлорид калия, нитрат свинца (II), сульфат железа (III). Напишите для предложенных веществ уравнение диссоциации.
3. Сулема, или….?(1) многими способами получается из каломели и обратно в нее переходит. Избыток хлора (например, царская водка) переводит каломель и ртуть в сулему. Плотность ее паров по отношению к водороду 135, следовательно, частица ее содержит ….?(2). Она образует бесцветные призматические кристаллы ромбической системы, кипит при 1070С, растворяется в спирте. Готовят ее обыкновенно через возгонку сульфата ртути (II) с поваренной солью….?(3). Сулема, будучи растворима в воде действуя на белковое вещество, сильно ядовита, а потому применяется для дезинфекции, особенно при хирургических операциях, для сохранения образцов животных, при бальзамировании.
1. Определите состав сулемы (?2).
2. Приведите современное название сулемы (?1)
3. Напишите реакции растворения ртути в «царской водке».
4. Что такое каломель (укажите название и состав).
5. Как из каломели действием «царской водки» можно получить сулему (запишите уравнение протекающей реакции)?
6. Напишите уравнение реакции сульфата ртути (II) с поваренной солью (?3).
4. 10,8 г металла поместили в сосуд объемом 22,4 л (н.у.), наполненный кислородом, и подожгли. В результате давление в сосуде уменьшилось на 30%. Какой металл был взят для опыта?
5. Массовая доля кислорода в одном оксиде некоторого металла составляет 22,22%, в другом оксиде того же металла – 30,00%. Что это за металл? Какова формула первого и второго оксидов соответственно?
класс
При сгорании 7,5 г органического вещества, образовалось 11,2 л (н.у.) оксида углерода (IV) и 13,5 г воды. Плотность этого вещества по метану составляет 1,875. О каком органическом веществе идет речь? Назовите это вещество.
В трех склянках находятся образцы металлов – алюминия, цинка, и серебра. Этикетки от склянок утеряны. Чтобы определить, в какой склянке находится каждый из металлов, проведена серия испытаний действием концентрированных соляной и азотной кислот и концентрированным водным раствором гидроксида калия. Результаты наблюдений представлены в таблице (знак «+» означает, что реакция идет, знак «−» -отсутствие реакции):
| Номер образца металла | РЕАГЕНТЫ |
| Азотная кислота | Соляная кислота | Гидроксид натрия |
| 1 | + | − | − |
| 2 | − | + | + |
| 3 | + | + | + |
Какие металлы обозначены в таблице под номерами 1, 2, 3? Приведите уравнения химических реакций.
Химические элементы А и В относятся к одному периоду, но к разным группам и образуют соединение АВ. Назовите эти элементы, если единственный оксид элемента А содержит 28,57% кислорода. Напишите формулы оксидов элемента В и формулы соответствующих кислот.
Смесь бутана и азота объемом 10 л сожгли и всю образовавшуюся газовую смесь пропустили через известковую воду, при этом образовалось 70 г карбоната и 40,5 г гидрокарбоната кальция. Определите объемную долю бутана в исходной смеси (считайте, что объемы газов приведены к нормальным условиям).
Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди (II), а затем через склянку с оксидом фосфора (V). Напишите уравнения описанных реакций.
11 класс
Задание № 1.
Почему в середине периодической системы появляется группа лантаноидов, у которых увеличение порядкового номера не вызывает существенного изменения их химических свойств, в то время, как для большинства элементов, изменения порядкового номера приводит к изменению химических свойств. Ответ подтвердите электронными формулами.
Задание № 2.
Определите молекулярную формулу предельного трехатомного спирта, массовая доля кислорода в котором равна 45,28%.
Задание № 3.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H2→C6H6 →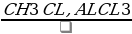 →X1→
→X1→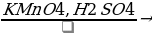 X2→
X2→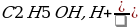 →X3→бензоат калия
→X3→бензоат калия
Задание № 4.
Используя метод электронного баланса, составьте уравнение реакции:
KMnO4+H2S+H2SO4→MnSO4+S+…+…
Определите окислитель и восстановитель.
Задание № 5. Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объем собранного газа.







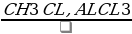 →X1→
→X1→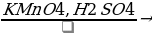 X2→
X2→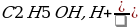 →X3→бензоат калия
→X3→бензоат калия

















