Хайрутдинова А.И., учитель химии и биологии первой кв. категории
МОУ СОШ р.п. Старотимошкино
МО «Барышский район»

К какому классу относятся вещества, дать им названия.
NO, HNO 3 , NaOH,
HNO 2 , CO 2 , Mg(OH) 2 ,
H 2 CO 3 , H 2 SO 3 , H 2 SO 4 .
Тестирование
1 вариант
1.Выберите букву с формулами веществ, в которой находятся формулы только кислотных оксидов:
а ) Na 2 O, N 2 O, CuO; б ) CO 2 , P 2 O 5 , Cl 2 O 7 ;
в ) MgO, BaO, K 2 O; г ) Li 2 O, CaO, CO.
2. Выберите из списка веществ формулы только кислот:
а) НС I , AICI 3 , CO 2 , H 2 SO 4 б) H 2 SO 4 , HCI , HNO 3 , HF
в ) NaOH, BaCI 2 , CO, Ca(OH) 2 г ) AI(OH) 3 , NaOH, KOH,
3. Выберите формулу оксида серы ( IV ):
а )H 2 S б ) CO в ) HNO 3 г ) ZnO д ) SO 2
4. Выберите формулу серной кислоты:
а) H 2 SiO 3 б) H 2 SO 4 в) H 2 SO 3 г) H 2 S
5. Выберите формулу гидроксида калия:
а) Ba ( OH ) 2 , б) NaOH в) KOH г) Ca ( OH ) 2
6. Выберите формулы растворимого в воде основания:
а) Cu ( OH ) 2 б) KOH в) LiOH г) AI ( OH ) 3
7.Выберите формулы, в которых лакмус изменяет цвет на красный:
а) НС I б) H 2 SO 4 в) NaOH г) KOH
2 вариант
1.Выберите букву с формулами веществ, в которой находятся формулы только основных оксидов:
а ) Na 2 O, N 2 O, CuO; б ) CO 2 , P 2 O 5 , Cl 2 O 7 ;
в ) MgO, BaO, K 2 O; г ) Li 2 O , CaO , CO .
2. Выберите из списка веществ формулы только оснований:
а ) НС I, AICI 3 , CO 2 , H 2 SO 4 б ) H 2 SO 4 , HCI, HNO 3 , HF
в ) NaOH, BaCI 2 , CO г ) AI(OH) 3 , NaOH, KOH, Ba(OH) 2
3. Выберите формулу оксида углерода ( II ):
а )H 2 S б ) CO в ) HNO 3 г ) ZnO д ) SO 2
4. Выберите формулу сернистой кислоты:
а) H 2 SiO 3 б) H 2 SO 4 в) H 2 SO 3 г) H 2 S
5. Выберите формулу гидроксида кальция:
а) Ba ( OH ) 2 , б) NaOH в) KOH г) Ca ( OH ) 2
6. Выберите формулы нерастворимого в воде основания:
а) Cu ( OH ) 2 б) KOH в) LiOH г) AI ( OH ) 3
7.Выберите формулы, в которых лакмус изменяет цвет на синий:
а) НС I б) H 2 SO 4 в) NaOH г) KOH

Ответы
I вариант II вариант
1. б 1. в
2. б 2. г
3. д 3. б
4. б 4. в
5. в 5. г
6. б, в 6. а, г
7. а, б 7. в, г
критерии оценки:
«5» - одна ошибка
«4» - две ошибки
«3» - три ошибки
«2» - четыре ошибки и больше.
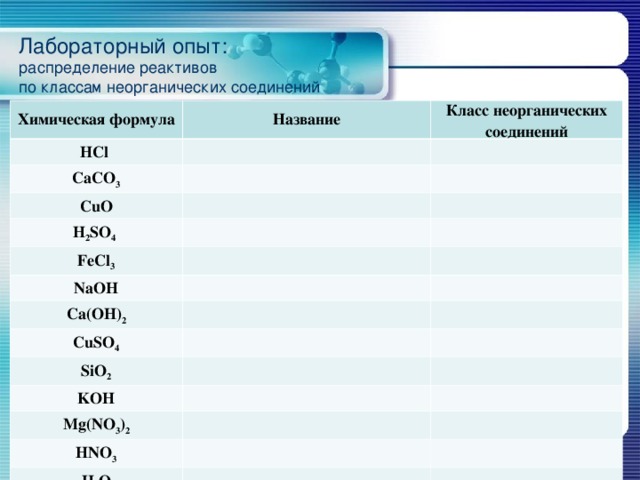
Лабораторный опыт: распределение реактивов по классам неорганических соединений
Химическая формула
Название
HCl
Класс неорганических соединений
CaCO 3
CuO
H 2 SO 4
FeCl 3
NaOH
Ca(OH) 2
CuSO 4
SiO 2
KOH
Mg(NO 3 ) 2
HNO 3
H 2 O
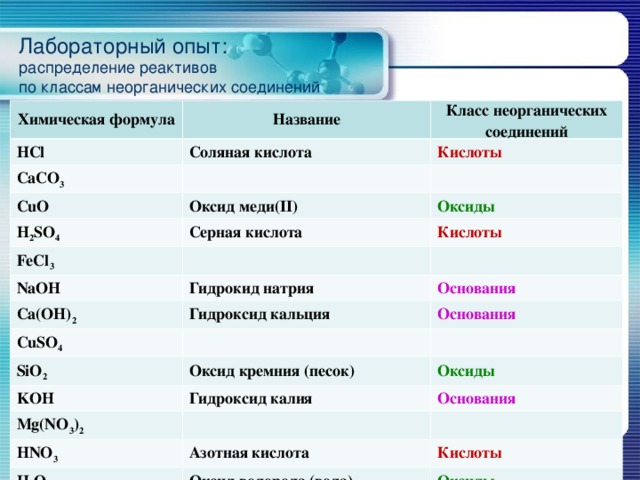
Лабораторный опыт: распределение реактивов по классам неорганических соединений
Химическая формула
HCl
Название
Класс неорганических соединений
Соляная кислота
CaCO 3
Кислоты
CuO
Оксид меди(II)
H 2 SO 4
Оксиды
Серная кислота
FeCl 3
Кислоты
NaOH
Гидрокид натрия
Ca(OH) 2
Основания
Гидроксид кальция
CuSO 4
SiO 2
Основания
Оксид кремния (песок)
KOH
Оксиды
Гидроксид калия
Mg(NO 3 ) 2
HNO 3
Основания
Азотная кислота
H 2 O
Кислоты
Оксид водорода (вода)
Оксиды

Древнегреческий поэт Гомер называл это вещество божественным, т.к. в 8 веке до н.э. это вещество ценилось дороже золота, из-за его месторождений часто возникали военные столкновения. Оно входило в состав самых древних лекарств, ему предписывали целебные свойства, очищающее и обеззараживающее действие. Его издавна применяли при обработке кожевенного и мехового сырья, древесины. С древности оно стало самым главным химическим реактивом за обеденным столом. По русскому обычаю его подносят гостям вместе с хлебом, тем самым желая им здоровья.

Соли как производные кислот и оснований
CaCO 3 FeCl 3
CuSO 4 Mg(NO 3 ) 2

Определение:
- Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
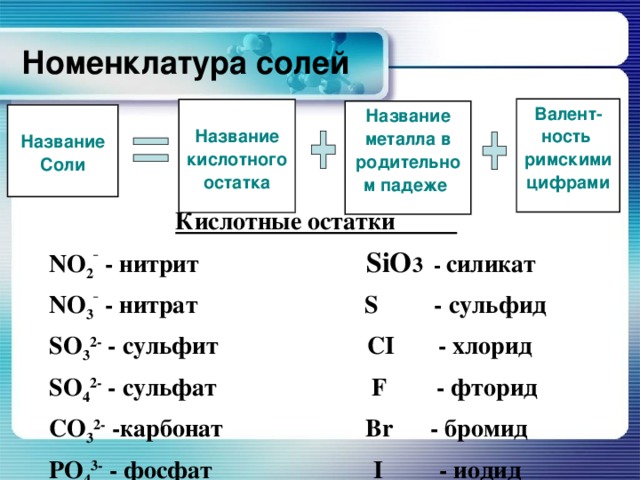
Номенклатура солей
Валент-ность
римскими цифрами
Название кислотного остатка
Название металла в родительном падеже
Название
Соли
Кислотные остатки
NO 2 ¯ - нитрит SiO 3 - силикат
NO 3 ¯ - нитрат S - сульфид
SO 3 2- - сульфит СI - хлорид
SO 4 2- - сульфат F - фторид
СO 3 2- -карбонат Br - бромид
РO 4 3- - фосфат I - иодид
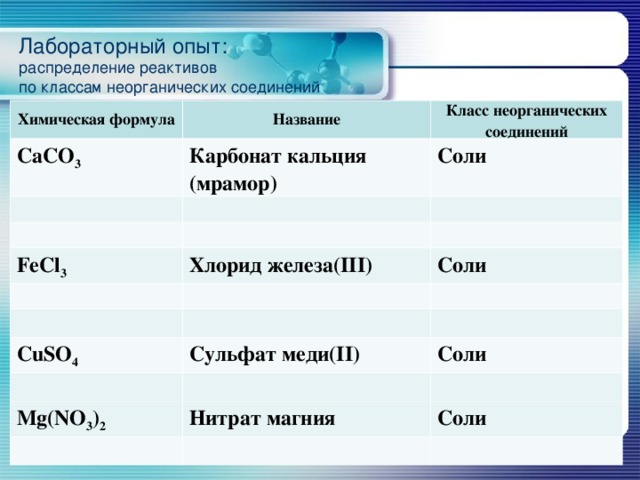
Лабораторный опыт: распределение реактивов по классам неорганических соединений
Химическая формула
Название
CaCO 3
Класс неорганических соединений
Карбонат кальция (мрамор)
Соли
FeCl 3
Хлорид железа(III)
Соли
CuSO 4
Сульфат меди(II)
Соли
Mg(NO 3 ) 2
Нитрат магния
Соли

Составить формулу сульфата алюминия:
Алгоритм составления формулы соли
1. записываем символ металла, затем символы соответствующего кислотного остатка.
2. Обозначаем заряды ионов, из которых состоит соль
3. Находим наименьшее общее кратное (НОК) для этих зарядов.
4. Делим НОК на заряды ионов и получаем соответствующие индексы.
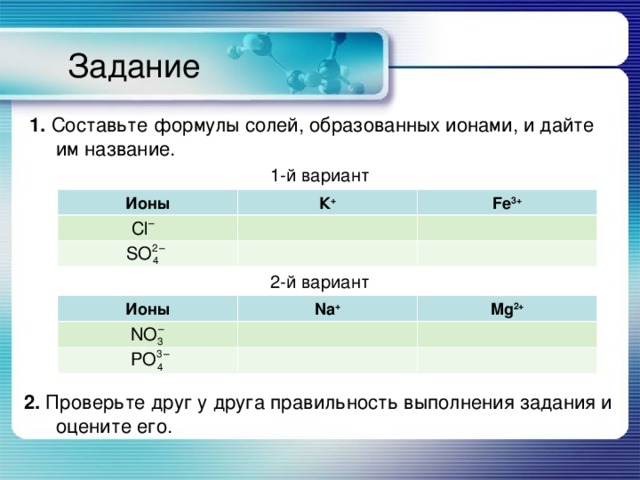
Задание
1. Cоставьте формулы солей, образованных ионами, и дайте им название.
1-й вариант
2-й вариант
2. Проверьте друг у друга правильность выполнения задания и оцените его.
Ионы
К +
Fe 3+
Ионы
Na +
Mg 2+
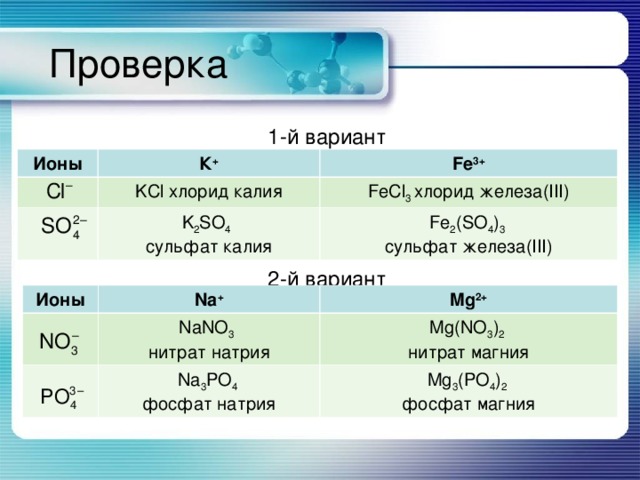
Проверка
1-й вариант
2-й вариант
Ионы
К +
Fe 3+
KCl хлорид калия
K 2 SO 4 c ульфат калия
FeCl 3 хлорид железа( III )
Fe 2 (SO 4 ) 3 сульфат железа( III )
Ионы
Na +
NaNO 3 нитрат натрия
Mg 2+
Mg(NO 3 ) 2 нитрат магния
Na 3 PO 4 фосфат натрия
Mg 3 (PO 4 ) 2 фосфат магния

Многообразие солей
хлорид натрия
NaCl
Кристаллогидрат железа или железный купорос
FeSO4* 7H2O
Кристаллогидрат сульфата меди (II)
СuSO4* 5H2O
Из мрамора (СаСО3) сделан дворец в Индии Тадж- Махал
кристаллогидрат
сульфата кальция
СаSO4 * 2H2O
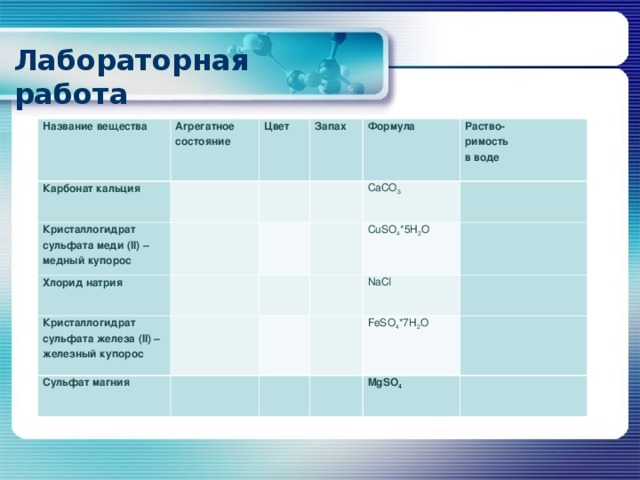
Лабораторная работа
Название вещества
Агрегатное
состояние
Карбонат кальция
Цвет
Кристаллогидрат сульфата меди ( II ) – медный купорос
Запах
Хлорид натрия
Формула
Кристаллогидрат сульфата железа ( II ) – железный купорос
Сульфат магния
CaCO 3
Раство-
римость
в воде
CuSO 4 *5H 2 O
NaCI
FeSO 4 *7 H 2 O
MgSO 4

Лабораторная работа
Название вещества
Агрегатное
состояние
Карбонат кальция
вещества
твердое
Кристаллогидрат сульфата меди (II) – медный купорос
Цвет
твердое
Хлорид натрия
белый
Запах
-
твердое
Формула
Кристаллогидрат сульфата железа (II) – железный купорос
Сульфат магния
твердое
CaCO 3
бесцветный
голубой
-
Растворимость
в воде
-
Н
твердое
CuSO 4 *5H 2 O
Р
белый
NaCI
Зеленова-тый
-
-
Р
FeSO 4 *7H 2 O
Р
MgSO 4
Р
Вывод: соли представляют собой твёрдые вещества, кристаллические, растворимые и нерастворимые в воде, с разнообразным цветом
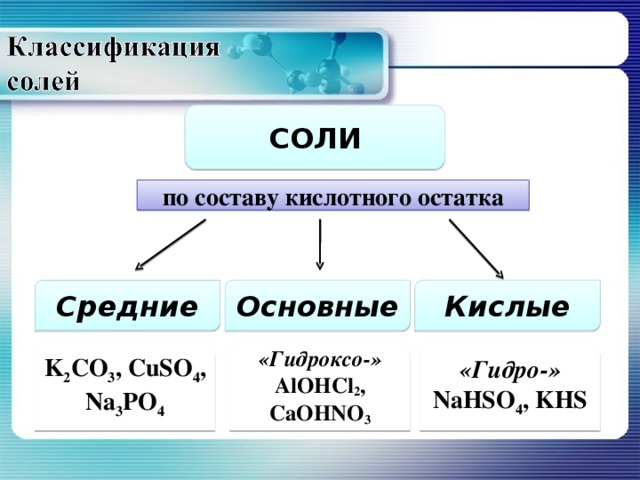
СОЛИ
по составу кислотного остатка
Средние
Основные
Кислые
K 2 CO 3 , CuSO 4 , Na 3 PO 4
«Гидроксо-»
AlOHCl 2 , CaOHNO 3
«Гидро-»
NaHSO 4 , KHS
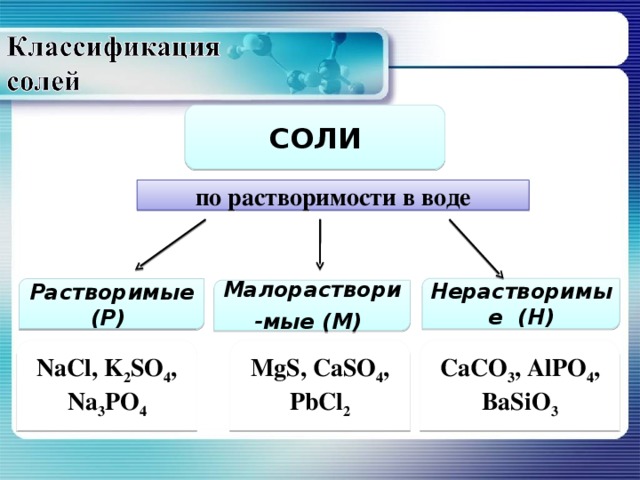
СОЛИ
по растворимости в воде
Нерастворимые (Н)
Растворимые (Р)
Малораствори-мые (М)
NaCl, K 2 SO 4 , Na 3 PO 4
MgS, C а SO 4 , PbCl 2
C а CO 3 , AlPO 4 , BaSiO 3

Задание Классификация солей
- Из перечня формул солей –
Сa(HSO 4 ) 2 , (CaOH) 2 SO 4 , Ca(NO 3 ) 2 , NaH 2 PO 4 , Na 3 PO 4 , MgOHNO 3 – выпишите:
1 вариант – формулы средних солей,
2 вариант – формулы кислых солей,
3 вариант – формулы основных солей.
Дайте им название.
2. Проверьте друг у друга результаты работы.

Проверка
1 вариант
2 вариант
Ca(NO 3 ) 2 нитрат меди( ΙΙ )
3 вариант
С a(HSO 4 ) 2 гидросульфат кальция
Na 3 PO 4 фосфат натрия
NaH 2 PO 4 дигидрофосфат натрия
(CaOH) 2 SO 4 гидроксосульфат кальция
MgOHNO 3 гидроксонитрат магния
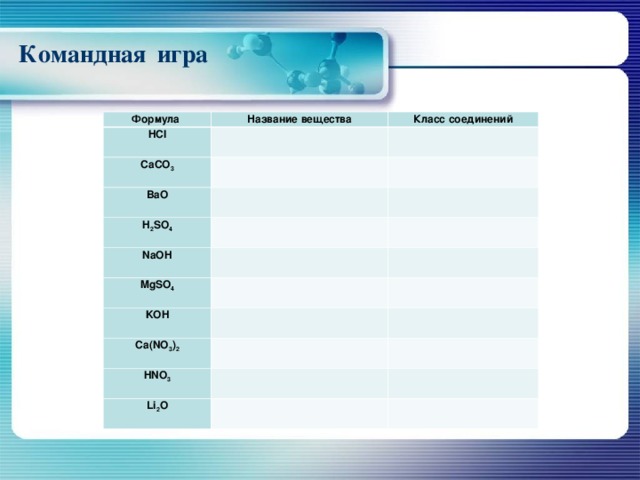
Командная игра
Формула
Название вещества
HCl
Класс соединений
CaCO 3
Ва O
H 2 SO 4
NaOH
MgSO 4
KOH
Ca ( NO 3 ) 2
HNO 3
Li 2 O
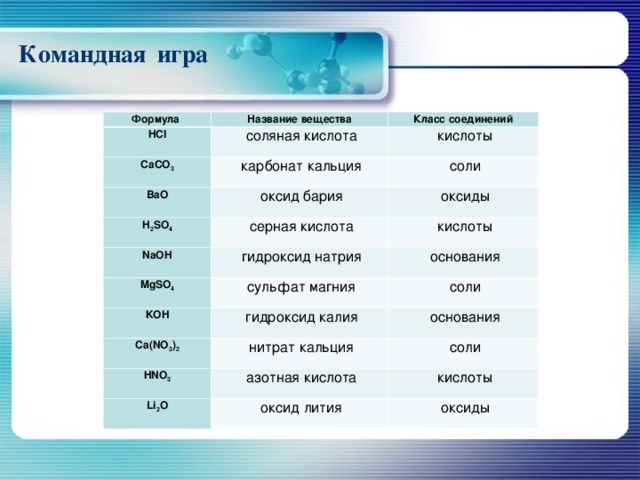
Командная игра
Формула
Название вещества
HCl
Класс соединений
соляная кислота
CaCO 3
карбонат кальция
кислоты
Ва O
соли
оксид бария
H 2 SO 4
серная кислота
оксиды
NaOH
MgSO 4
гидроксид натрия
кислоты
сульфат магния
KOH
основания
соли
гидроксид калия
Ca ( NO 3 ) 2
нитрат кальция
основания
HNO 3
соли
азотная кислота
Li 2 O
оксид лития
кислоты
оксиды

Домашнее задание
П.21, воп.1-5, формулы и названия кислотных остатков наизусть .
Составить формулы веществ, найти и выписать области применения:
- Калийная селитра (нитрат калия)
- Поваренная соль (хлорид натрия)
- Ляпис (нитрат серебра)
- Норвежская селитра (нитрат кальция)
Подведение итогов: оцените свои знания по новой теме – заштрихуйте соответствующий сектор
100 %
75% 25%
50%

Выберите из предложенных рисунков тот, который соответствует твоему настроению на конец урока
Хорошо Безразлично Тревожно