Все известные в настоящее время химические элементы (более 100 наименований) по совокупности свойств подразделяют на металлы и неметаллы. Примерно 80 % общего числа элементов относится к металлам. Некоторые из них (мышьяк, сурьму и др.) иногда называют полуметаллами, так как по одним свойствам их можно отнести к металлам, а по другим – к неметаллам.
Металлы (от греческого металлон – копи, рудники) – вещества неорганического происхождения, многие из которых обладают характерным блеском, высокой плотностью, прочностью и твердостью, пластичностью, хорошей электро- и теплопроводностью.
Классификация металлов
Металлы отличаются между собой строением и свойствами, тем не менее их можно объединить в группы (классифицировать) по следующим объединяющим их признакам:
по наличию и отсутствию железа и сплавов на его основе: черные; цветные;
по химическим и физическим свойствам: легкие; тяжелые; тугоплавкие; благородные; радиоактивные; щелочноземельные;
по характеру залегания в земной коре: редкоземельные; рассеянные; редкие;
по температуре плавления: низкоплавкие (1000 °С); высокоплавкие (1000—2000 °С); тугоплавкие (2000).
Приведенная классификация условна, многие металлы могут быть отнесены к разным группам одновременно.
Черные металлы имеют темно-серый цвет. К ним относятся железо и сплавы на его основе (сталь и чугун). Черные металлы обладают полиформизмом — способностью изменять строение кристаллической решетки при нагревании до определенных температур.
Цветные металлы в основном имеют красный, желтый или белый цвет.
К тугоплавким металлам относятся молибден (Мо), тантал (Та), вольфрам (W).
Редкоземельные металлы — лантан (La), церий (Се), неодим (Nd), празеодим (Рг).
Легкие металлы — бериллий (Be), магний (Mg), алюминий (А1) — отличаются малой плотностью.
Благородные и полублагородные металлы — серебро (Ag), золото (Аи), платина (Pt), медь (Си), палладий (Pd), иридий (1г), родий (Rh), осмий (Os), рутений (Ru) — обладают высокой устойчивостью против коррозии.
Легкоплавкие металлы — цинк (Zn), кадмий (Cd), ртуть (Hg), олово (Sn), свинец (РЬ), висмут (Bi), таллий (Т1), сурьма (Sb), а также химические элементы с ослабленными металлическими свойствами — галлий (Ga), германий (Ge).

Сталями называются сплавы железа (Fe) с углеродом (С≤ 2,14%)
Классификация сталей
Стали, классифицируют по следующим признакам:
1. Химический состав. В зависимости от химического состава различают стали углеродистые и легированные.
Легированные стали - стали, содержащие кроме постоянных примесей (марганец, кремний), один или несколько специальных элементов или повышенные концентрации марганца и кремния (1 %). В качестве легирующих элементов используются Сг, Ni, W, Мо, Тi, V, Со и др.
Углеродистые стали разделяются на:
малоуглеродистые -содержание углерода С
среднеуглеродистые - содержание углерода 0,25≤ С ≤ 0,60%
высокоуглеродистые - содержание углерода С 0,60%
Легированные стали классифицируются как:
низколегированные, суммарное содержание легирующих элементов до 2,5%
среднелегированные, суммарное содержание легирующих элементов от 2,5 до 10%;
высоколегированные, суммарное содержание легирующих элементов свыше 10%.
2. Назначение.
По назначению различают стали:
конструкционные, предназначенные для изготовления строительных и машиностроительных изделий деталей машин и приборов;
инструментальные, предназначенные для изготовления режущего, мерительного, штампового и прочего инструментов. Эти стали содержат более 0,65% углерода;
стали с особыми свойствами:
- с особыми физическими свойствами, например, с определенными магнитными характеристиками (электротехническая сталь);
- с особыми химическими свойствами, например, коррозионностойкие, жаростойкие или жаропрочные стали.
Коррозионностойкие стали предназначены для работы в агрессивных средах. Жаростойкие – обеспечивают отсутствие окисления (окалины) при работе в области высоких температур. Жаропрочные – обеспечивают необходимую прочность при работе в области высоких температур.
3. Качество.
В зависимости от содержания вредных примесей (серы и фосфора) стали бывают:
обыкновенного качества- содержание серы до 0.06% и фосфора до 0,07%;
качественные - содержание серы до 0,035% и фосфора до 0,035% ;
высококачественные - содержание серы до 0,025% и фосфора до 0,025%;
особовысококачественные - содержание серы до 0,015% и фосфора до 0,025%.
4. Структура.
По структуре после охлаждения на воздухе легированные стали подразделяют на три основных класса:
перлитный;
мартенситный;
аустенитный.
По структуре сталей полностью устанавливают их свойства. Например: сталь, имеющая перлитную структуру, обладает небольшой твердостью и высокой пластичностью, а сталь, имеющая мартенситную структуру, весьма твердая и хрупкая.

Чугунами называются сплавы железа (Fe) с углеродом, при этом содержание углерода (С) составляет более 2,14%.
Классификация чугунов 1. Степень графитизации.
Графитизация чугуна— выделение углерода в структурно-свободном виде, сопровождающееся частичным или полным разложением цементита Fe3C.
Углерод в чугуне может находится в связанном состоянии в виде карбида, называемого цементитом (Fe3C), а также в частично или полностью свободном состоянии в виде графита. Состояние углерода в чугуне определяет его прочностные свойства.
В зависимости от состояния углерода в чугуне различают:
2. Структура металлической матрицы (основы).
В зависимости от структуры металлической матрицы различают:
чугуны на ферритной основе (ферритные чугуны);
чугуны на феррито-перлитной основе (феррито-перлитные чугуны);
чугуны на перлитной основе (перлитные чугуны).
Структура металлической матрицы зависит от скорости охлаждения изделия.
3. Форма графитовых включений.
Графитовые включения в чугунах имеют следующую форму:


-

МЕДЬ
Медь - элемент одиннадцатой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь - это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком. Медь - один из первых металлов, которые человек начал применять для технических целей. Вместе с золотом, серебром, железом, оловом, свинцом и ртутью, медь известна людям с древнейших времен и сохраняет свое важное техническое значение до наших дней. Медь - металл розово-красного цвета, относится к группе тяжелых металлов, является отличным проводником тепла и электрического тока. Электропроводность меди в 1,7 раза выше, чем у алюминия, и в 6 раз выше, чем у железа. Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и выплавлялась медь. Около II - III в. выплавка меди производилась в широком масштабе в Египте, в Месопотамии, на Кавказе, в других странах древнего мира. Но, тем не менее, медь - далеко не самый распространенный в природе элемент: содержание меди в земной коре составляет 0,01%, а это лишь 23-е место среди всех встречающихся элементов.

-
АЛЮМИНИЙ
Алюминий - элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации - элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий - лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. alumen - квасцы. До открытия промышленного способа получения алюминия этот металл был дороже золота. В 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему весы из золота и алюминия.

МАГНИЙ
Магний - элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний - лёгкий, ковкий металл серебристо-белого цвета. Магний это один из самых легких металлов, устойчивых на воздухе. Благодаря этому, а так же тому, что он широко распространен в природе и относительно дешев, магний достаточно часто используется как конструкционный материал в авиастроении и в других отраслях, где прежде всего важен низкий вес конструкционных материалов. Магний - активный металл: если нагреть небольшой кусок магния до температуры плавления, он загорится и сгорит ослепительным пламенем. Хотя в сухом воздухе, при комнатной температуре, он окисляется достаточно медленно. Повысить коррозионную устойчивость магния можно введением в магниевые сплавы различных добавок.


ТИТАН
Тита́н (лат. Titanium; обозначается символом Ti) - элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан - лёгкий прочный металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C. Температура плавления 1660±20 °C. Tитан имеет твердость по Бринеллю 175 МПа. Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля - оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз - идентичные оксиды титана. Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.

Большая часть производимого Ti используется для изготовления сплавов с алюминием, ванадием, молибденом, марганцем, хромом и другими металлами, коррозионно-стойких покрытий. Диоксид TiO2 применяется при изготовлении титановых белил. Гидрид и дисульфид TiS2,титана находят применение при создании источников ток.

Пластическими массами (пластмассами) называют материалы на основе природных или синтетических высокомолекулярных соединений, из которых получают изделия методами пластической деформации путем нагревания и давления. Они сохраняют свою форму после охлаждения и отверждения.
В состав пластмасс входят:

Резина (от лат. resina «смола») — эластичный материал, получаемый вулканизацией каучука.
Применяется для изготовления шин для различного транспорта, уплотнителей, шлангов, транспортёрных лент, медицинских, бытовых и гигиенических изделий и др.
Получают из натурального или синтетического каучука методом вулканизации — смешиванием с вулканизирующим веществом (обычно с серой) с последующим нагревом.
По степени вулканизации резина разделяется на мягкую (1—3 % серы), полутвёрдую и твёрдую (более 30 % серы) (эбонит). Плотность около 1200 кг/м3.

-
История резины начинается с открытием американского континента. Издревле коренное население Центральной и Южной Америки, собирая млечный сок т. н. каучуконосных деревьев (гевеи), получали каучук. Ещё Колумб обратил внимание, что применявшиеся в играх индейцев тяжёлые монолитные мячи из чёрной упругой массы, отскакивают намного лучше, чем известные европейцам кожаные. Кроме мячей, каучук применялся в быту: изготовления посуды, герметизация днищ пирог, создание непромокаемых «чулков» (правда способ был довольно болезненным: ноги обмазывались каучуковой массой и держались над костром, в результате получалось непромокаемое покрытие); применялся каучук и как клей: с помощью него индейцы приклеивали перья к телу для украшения. Но сообщение Колумба о неизвестном веществе с необычными свойствами осталось незамеченным в Европе, хотя, несомненно, что конкистадоры и первые поселенцы Нового света широко использовали каучук.

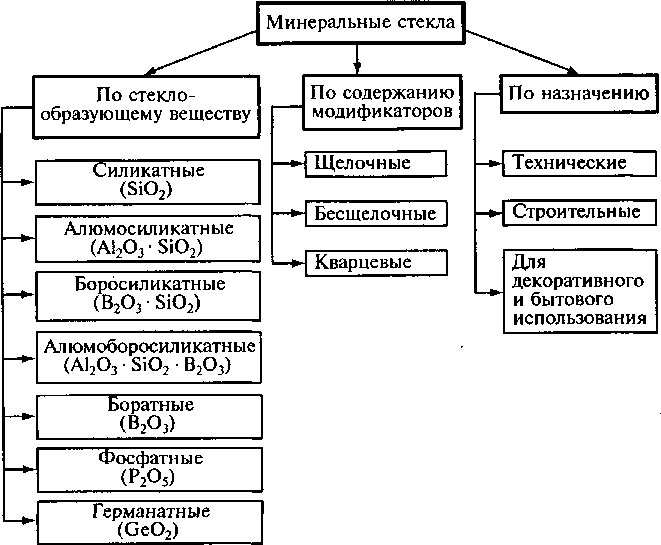
Стекло — оптически прозрачный материал, получаемый при остывании неметаллического расплава. При нагревании стекло размягчается и переходит в жидкое состояние. Стекло изотропно. В отличие от металлов при нагревании стекла нет критических точек. Оно плавится в некотором температурном интервале, который зависит от состава. Для промышленных силикатных стекол температура стеклования (tс) от 425 до 600 °С, температура размягчения (tр) от 600 до 800 °С. В интервале этих температур стекло находится в высоко вязком пластическом состоянии. Технологический процесс переработки стекломассы в изделия происходит при температуре выше tp(1000—1100 °С).
В состав неорганических стекол входят стеклообразующие оксиды кремния, бора, фосфора, германия, мышьяка, образующие структурную сетку; также входят модификаторы: оксиды натрия, калия, лития, кальция, магния, бария. Кроме того, в состав стекла вводят оксиды алюминия, железа, свинца, титана, бериллия, которые самостоятельно не образуют структурный каркас, но могут частично замещать стеклообразующие оксиды и этим придавать стеклу требуемые свойства.