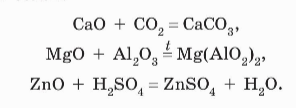ЗАНЯТИЕ 1. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
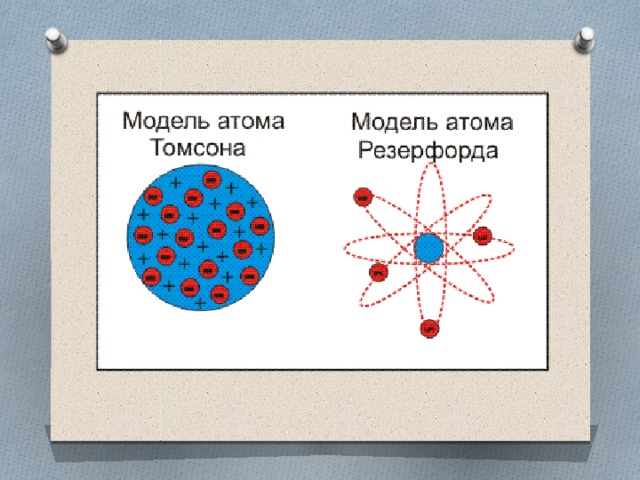
А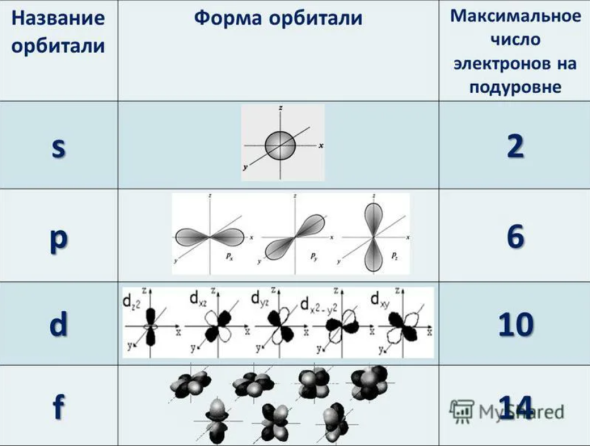 том – сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
том – сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
КАК ЗАПОЛНЯЮТСЯ ОРБИТАЛИ?
Э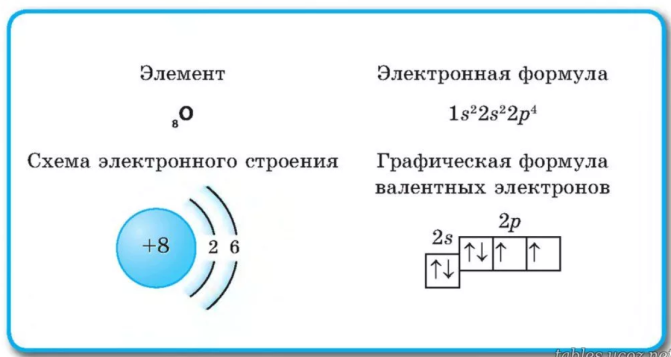 лектроны заполняют орбитали в соответствии с 3 принципами (правилами).
лектроны заполняют орбитали в соответствии с 3 принципами (правилами).
-
Принцип минимума энергии. Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s22s22p63s23p64s23d104p65s24d105р66s25d14f14...
Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир.
-
Принцип Паули. В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу.
-
Правило Хунда. Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.


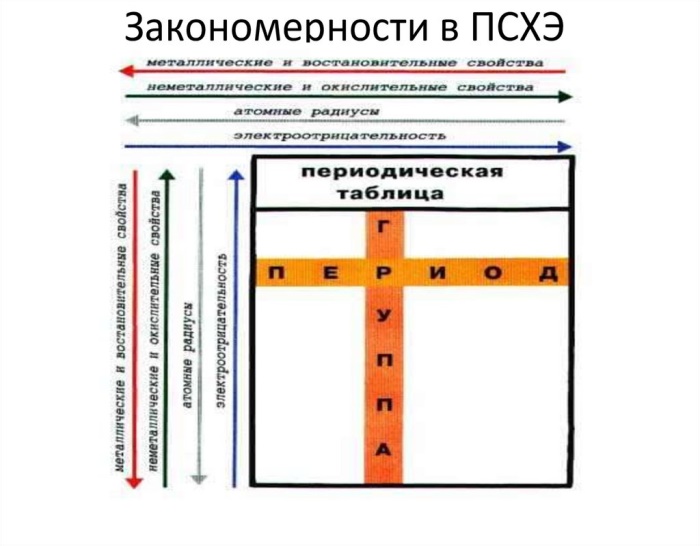
ЗАНЯТИЕ 2. ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
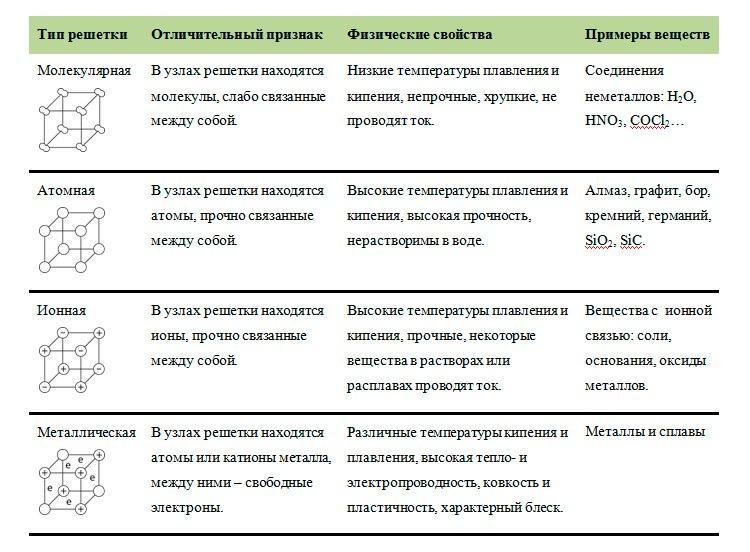
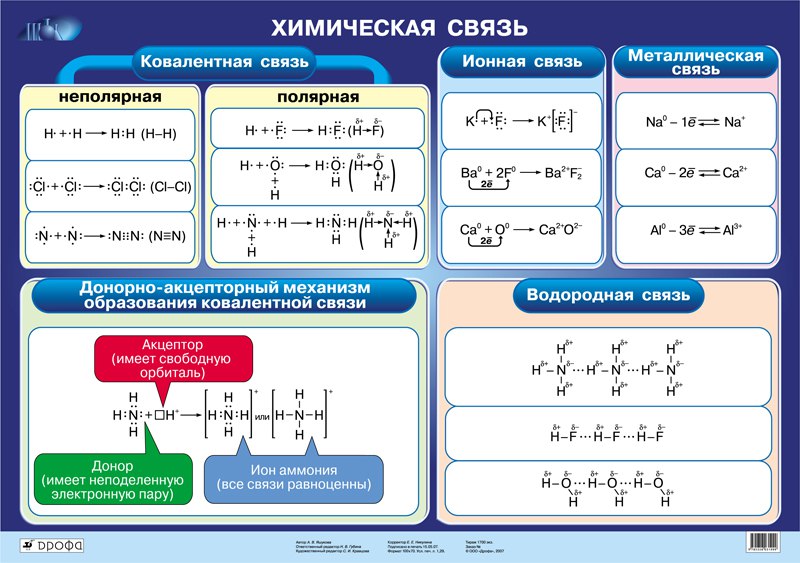
ЗАНЯТИЕ 3. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ

ЗАНЯТИЕ 4. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ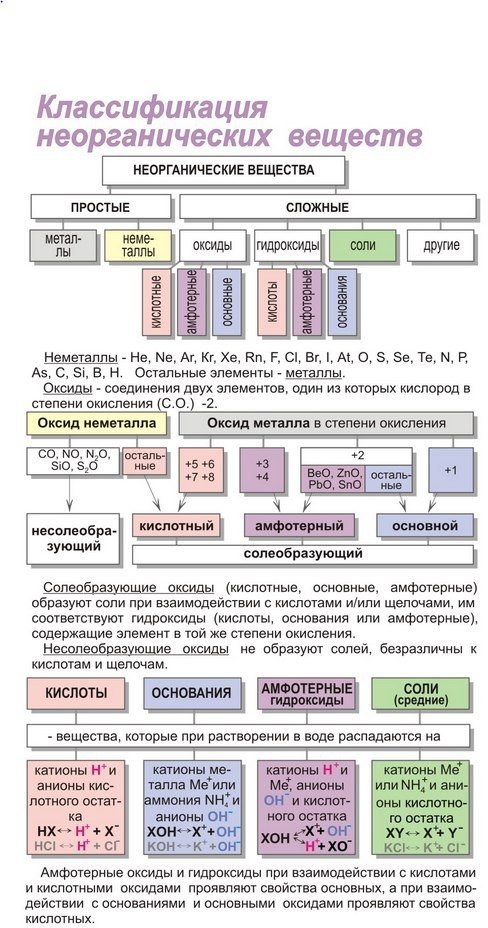

ЗАНЯТИЕ 5. ОКСИДЫ И ОСНОВАНИЯ. ИХ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ
Общие методы получения оксидов:
-
Окисление простых и сложных веществ кислородом: 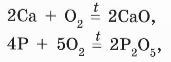

ОСНОВНЫЕ ОКСИДЫ

+ кислотный оксид
Основный оксид + кислота = соль (ПРИ НАГРЕВАНИИ!)
+ амфотерный оксид
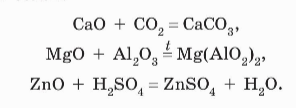
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований:









 том – сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
том – сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. 
 лектроны заполняют орбитали в соответствии с 3 принципами (правилами).
лектроны заполняют орбитали в соответствии с 3 принципами (правилами).