Просмотр содержимого документа
«Тепловой эффект химических реакций»

ГБПОУ «Починковский сельскохозяйственный техникум»
Урок химии по теме: "Тепловой эффект химических реакций". Расчёты по термохимическим уравнениям (ТХУ)
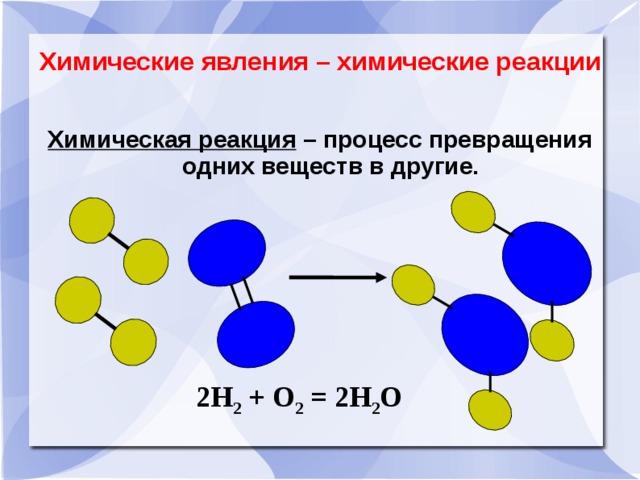
Химические явления – химические реакции
Химическая реакция – процесс превращения одних веществ в другие.
2Н 2 + О 2 = 2Н 2 О
2

Признаки химических реакций
- Изменение цвета
- Выделение газа
- Образование или растворение осадка
- Появление или исчезновение запаха
- Выделение или поглощение тепла
2
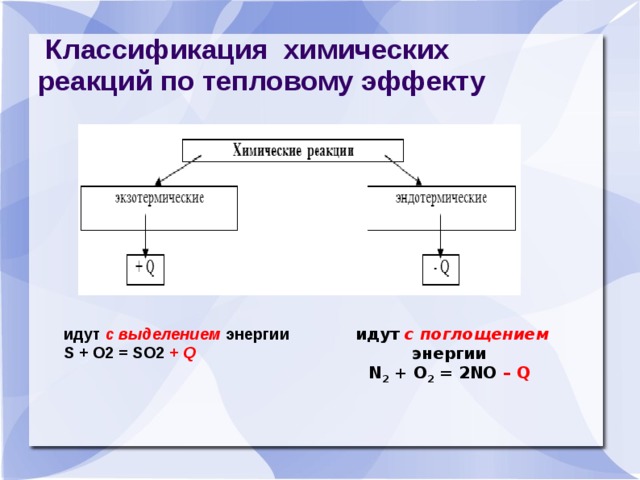
Классификация химических реакций по тепловому эффекту
идут с выделением энергии S + O2 = SO2 + Q
идут с поглощением энергии N 2 + O 2 = 2NO – Q
4
 2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж 4 " width="640"
2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж 4 " width="640"
Термохимия - раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO — 2Hg + O 2 – 180 кДж,
С(тв) + O 2 (г) — СO 2 (г) + 394 кДж
4

По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
1. Кратко записать условия задачи (“дано”).
2.Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
3.Провести вспомогательные вычисления ( М r , М, m).
4.Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
5.Записать ответ.
4

4

4

4

4

4

4

СПАСИБО ЗА ВНИМАНИЕ!







 или энтальпии
или энтальпии  системы вследствие протекания химической реакции и превращения исходных веществ в продукты реакции в количествах, соответствующих уравнению химической реакции
системы вследствие протекания химической реакции и превращения исходных веществ в продукты реакции в количествах, соответствующих уравнению химической реакции



 2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж 4 " width="640"
2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж 4 " width="640"

























