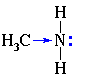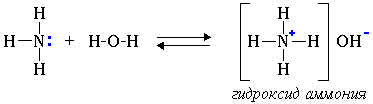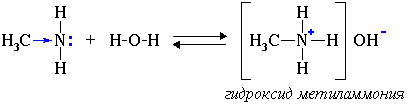Урок 2. Химические свойства насыщенных аминов.
Содержание урока:
- химические свойства: основные свойства аминов (реакции с водой и неорганическими кислотами), полное окисление.
Для аминов характерны основные свойства, которые обусловлены наличием неподелённой электронной пары на атоме азота

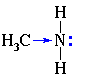
Основные свойства аминов (т.е. их способность присоединять ион водорода) проявляются в реакциях как с водой, так и с кислотами.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму) и изменяют окраску индикаторов:
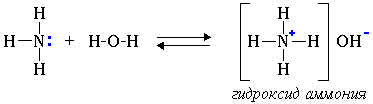
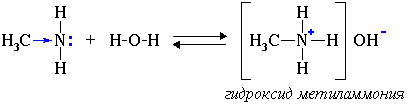
R-NH2 + H2O → [R-NH3]+ + OH- (ион алкиламмония)
Видеоопыт "Получение гидроксида диметиламмония и изучение его свойств"
https://www.youtube.com/watch?v=iZXvGFdxDpw
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
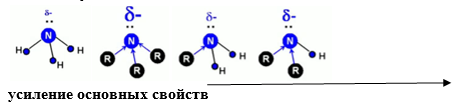
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов
СН3-NH2 + НCl ↔ [СН3-NH3]Cl
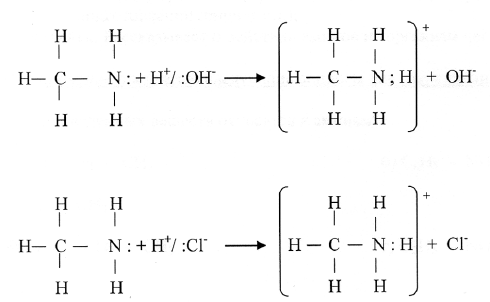
Соли аминов (как и соли аммония) – кристаллические вещества ионного строения, хорошо растворимы в воде. В водных растворах они диссоциируют как сильные электролиты полностью (они более сильные основания, чем аммиак):
[СН3-NH3]Cl = [СН3-NH3]+ + Cl-
Щелочи, как более сильные основания, вытесняют амины (как и аммиак) из их солей при небольшом нагревании:
[СН3-NH3]Cl + NaOH → СН3-NH2 + NaCl + H2O


Видеоопыт "Получение диметиламина и его горение"
https://vk.com/video-47268191_164115836


Видео «Амины»
https://www.youtube.com/watch?v=AH92Kp5CJug&nohtml5=False