ОКСИДЫ
Оксиды – это сложные вещества, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления (–2) (К2О, Р2О5, …).
Общая формула оксидов 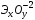 .
.
Такие соединения, как 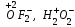 , не относятся к оксидам, так как степень окисления кислорода в них соответственно равна +2, –1.
, не относятся к оксидам, так как степень окисления кислорода в них соответственно равна +2, –1.
- Классификация оксидов
Оксиды делят на солеобразующие и несолеобразующие, или безразличные (табл. 2).
Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. К ним относят оксид углерода (II) СО, оксид азота (II) NO, оксид кремния (II) SiO и другие.
Солеобразующие оксиды – это оксиды, для которых характерно образование солей при химических реакциях. Всем солеобразующим оксидам соответствуют гидроксиды (основания, кислородосодержащие кислоты, амфотерные гидроксиды). В зависимости от химической природы оксида все солеобразующие оксиды подразделяют на основные, кислотные и амфотерные
(табл. 2).
Таблица 2 – Классификация оксидов
Оксиды


Солеобразующие Несолеобразующие (безразличные)
NO, CO, SiO


Кислотные
SO3, P2O5
Амфотерные BeO, Al2O3
Основные Na2O, CuO
Основными называются оксиды, которым соответствуют гидроксиды – основания.
Основные оксиды образуются только металлами, причем степень окисления металлов в основных оксидах обычно не превышает +2 (иногда +3), например: BaO, Na2O, CrO, FeO, MnO, …
Основные оксиды при обычных условиях – твердые кристаллические вещества.
Кислотными называются оксиды, которым соответствуют гидроксиды – кислородосодержащие кислоты.
Кислотные оксиды представляют собой либо оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высших степенях окисления (+4 и выше), например: CO2, SO3, Cl2O5, Mn2O7, CrO3, Sb2O5, …
При обычных условиях кислотные оксиды неметаллов могут быть газообразными (СО2, SO2), жидкими (N2O3, Cl2O7), твердыми (SiO2, B2O3, P2O3).
Амфотерными называются оксиды, которым соответствуют амфотерные гидроксиды. Все они твердые вещества: ZnO, BeO, Al2O3, SnO, PbO, Cr2O3, MnO2, Sb2O3, …
Образуются амфотерные оксиды элементами главных подгрупп, расположенных вблизи диагонали B – At (условной границы между металлическими элементами и неметаллическими), например: ZnO, BeO, Al2O3, GeO, SnO, Sb2O3, а также металлами побочных подгрупп в промежуточной степени окисления, например: MnO2, Fe2O3, …
Таким образом, металлы побочных подгрупп (d-элементы) образуют различные оксиды: в низших степенях окисления (+1, +2, иногда +3) – основные, в промежуточных (не выше +4 ) – амфотерные, в высших (+5, +6, +7) – кислотные.
Например:
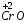 – основной оксид,
– основной оксид, 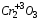 – амфотерный,
– амфотерный, 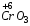 – кислотный.
– кислотный.
Номенклатура оксидов
По международной номенклатуре названия оксидов составляют следующим образом: сначала называют слово «оксид», затем русское название элемента в родительном падеже. Если элемент находится в переменной степени окисления, то его валентность (степень окисления) указывают в скобках римскими цифрами. Например,
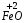 – оксид железа (II),
– оксид железа (II), 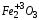 – оксид железа (III), СaO – оксид кальция.
– оксид железа (III), СaO – оксид кальция.
3. Химические свойства оксидов
3.1. Основные оксиды реагируют с кислотами, кислотными оксидами, металлами и водой. С водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных (Сa, Sr, Ba, Ra) металлов, образуя при этом растворимые
гидроксиды – щелочи.
Na2O + H2SO4 → Na2SO4 + H2O;
Na2O + SO2 → Na2SO3;
FeO + 2К → К2O + Fe;
Na2O + H2O → 2NaOH.
3.2. Кислотные оксиды взаимодействуют с основаниями, основными оксидами и водой. Некоторые кислотные оксиды (SiO2, Sb2O5) не взаимодействуют с водой, а соответствующие им гидроксиды (кислородосодержащие кислоты) получают косвенным путем. Оксиды металлов кислотного характера, такие как Mn2O7, CrO3, в воде также не растворяются.
В щелочах растворяются кислотные оксиды как неметаллов, так и металлов (в высшей степени окисления).
SO3 + 2NaOH → Na2SO4 + H2O;
MnO3 + 2KOH → K2MnO4 + H2O;
СO2 + Na2O → Na2СO3;
SO2 + H2O → H2SO3.
3.3. Амфотерные оксиды проявляют свойства и основных, и кислотных оксидов. Они взаимодействуют с основными оксидами и щелочами, а также кислотными оксидами и кислотами, таким образом, проявляя двойственные свойства:
BeO + 2NaOH → Na2BeO2 + H2O;
SnO + СaO → СaSnO2;
Al2O3 + 3SO3 → Al2(SO4)3;
ZnO + H2SO4 → ZnSO4 + H2O.
4. Способы получения оксидов
Оксиды получают окислением элементов кислородом, разложением кислородосодержащих соединений, в реакциях замещения и при окислительно-восстановительных процессах.
4.1. Прямое соединение простых веществ с кислородом:
S + O2 → SO2↑;
4 Li + О2 → 2 Li2О.
Таким способом получают оксиды неметаллов и оксиды металлов первой и второй группы главной подгруппы Периодической системы, т.е. оксиды щелочных и щелочноземельных металлов.
4.2. Получение оксидов косвенным путем:
1) Окисление сложных веществ:
2CuS + 3O2 → 2CuO + 2SO2↑;
CH4 + 2O2 → CO2↑ + 2H2O.
2) Разложение оснований при нагревании:
Cu(OH)2 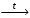 CuO + H2O.
CuO + H2O.
3) Разложение кислот при нагревании:
H2SiO3 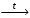 H2O + SiO2.
H2O + SiO2.
4) Разложение солей кислородосодержащих кислот:
CaCO3 → CaO + CO2↑.
5) Окислительно-восстановительные реакции:
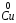 + 2
+ 2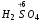 →
→ 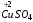 +
+ 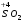 ↑ + 2
↑ + 2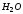 ;
;
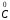 + 2
+ 2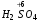 →
→  ↑ + 2
↑ + 2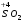 ↑ + 2
↑ + 2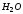 .
.
5. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Из приведенного перечня выберите формулы соединений, относящихся к оксидам: Cr2O3, Cl2O, Fe(OH)3, OF2, CaCO3, BaO2, SiO2. Назовите их и составьте графические формулы оксидов.
Составьте химические формулы оксидов фосфора (V), фосфора (III), золота (I), золота (III), марганца (IV), марганца (VII), цинка, бария, бора.
Составьте формулы высших оксидов элементов с порядковыми номерами: 14, 34, 42, 49, 53, 83.
Выпишите отдельно формулы основных, кислотных и амфотерных оксидов из предложенного перечня: ВaO, N2O5, MnO, MnO2, Mn2O7, Ag2O, CrO, Cr2O3, CrO3, As2O5, SnO, ZnO.
Элементы VII группы хлор и марганец образуют следующие оксиды: Cl2O, Cl2O7, MnO, MnO2, MnO3, Mn2O7. Объясните, какими свойствами обладает каждый оксид. Ответ подтвердите уравнениями реакций.
Напишите формулы гидроксидов, которым соответствуют следующие оксиды: оксид висмута (III), серы (IV), стронция, азота (V), марганца (VI).
Какие из предложенных оксидов взаимодействуют с водой: PbO2, N2O5, MnO, SiO2, SrO, Al2O3? Напишите уравнения соответствующих реакций.
Допишите уравнения предложенных ниже реакций:
СuO + HNO3 → ;
CrO3 + Ba(OH)2 → ;
BeO + HCl → ;
ZnO + KOH → ;
SO2 + NaOH → ;
Na2O + CO2 → .
С какими из веществ, формулы которых приведены ниже, взаимодействует оксид бария: HNO3, KOH, Н2О, CO2, К2O? Составьте уравнения возможных реакций.
С какими из веществ, формулы которых приведены ниже, взаимодействует оксид цинка: H2SO3, KOH, Н2О, CO2, К2O? Составьте уравнения возможных реакций.
Выберите формулы веществ, с которыми взаимодействует оксид азота (V): HCl, KOH, Н2О, SiO2, BaO. Составьте уравнения возможных реакций.
Осуществите следующие превращения:
Ва → BaO → BaCO3 → Ba(OH)2 → BaS → SO2 → H2SO3.







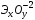 .
.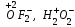 , не относятся к оксидам, так как степень окисления кислорода в них соответственно равна +2, –1.
, не относятся к оксидам, так как степень окисления кислорода в них соответственно равна +2, –1.

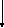
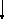


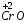 – основной оксид,
– основной оксид, 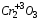 – амфотерный,
– амфотерный, 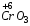 – кислотный.
– кислотный.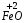 – оксид железа (II),
– оксид железа (II), 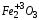 – оксид железа (III), СaO – оксид кальция.
– оксид железа (III), СaO – оксид кальция.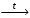 CuO + H2O.
CuO + H2O.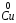 + 2
+ 2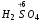 →
→ 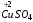 +
+ 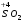 ↑ + 2
↑ + 2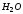 ;
;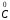 + 2
+ 2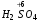 →
→ 









