Тренировочный КИМ ОГЭ по химии 2019г.
Инструкция по выполнению работы
Тренировочный КИМ состоит из четырех вариантов и составлена по типу 1 модели экзаменационной работы 2019 года (содержит 22 задания, предусматривающее выполнение «мыслительного эксперимента»). Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развернутым ответом.
На выполнение работы отводится 2 часа (120 минут).
Ответы к заданиям 1–15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов №1.
Ответы к заданиям 16–19 записываются в виде последовательности цифр. Эту последовательность цифр запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
Все бланки заполняются яркими чёрными чернилами. Допускается использование гелевой или капиллярной ручки.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
После завершения работы проверьте, чтобы ответ на каждое задание в бланках ответов №1 и № 2 был записан под правильным номером.
Желаем успеха!
Вариант – 1.
| При выполнении заданий 1—15 выберите один из четырёх предлагаемых вариантов ответа. Ответом на задания 16—19 является последовательность цифр или число. Ответ следует записать в поле для ответов справа от выполняемого задания без пробелов, запятых и других дополнительных символов. |
1. Какие два элемента имеют одинаковое число электронов на внешнем уровне?
1)Ве и В 2)В и Аl 3)O и F 4)Na и Cl
2. В каком ряду элементы расположены в порядке уменьшения их электроотрицательности?
1) азот — кислород — фтор 2) натрий — магний — алюминий
3) бериллий — магний — кальций 4) селен — сера — кислород
3. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия 2) хлорид натрия и хлор
3) азот и сульфид натрия 4) хлорид кальция и хлороводород
4. Одинаковую степень окисления +4 сера и углерод проявляют в соединениях
1) H2S и H2CO3 2)SO2 и Al4C3 3)К2SO3 и CO2 4)Fe2(SO4)3 и CH4
5. Кислотным оксидом и щелочью соответственно являются
1) SiO2 и Ba(OH)2 2)NO2 и Fe(OH)3 3)CaO и Cu(OH)2 4)CO2 и Al(OH)3
6. В реакцию замещения вступают между собой
1) SO2 и O2 2) CaO и CO2 3) Na и H2O 4)Fe2O3 и CO
7. Электрический ток проводит
1) раствор хлороводорода 2) расплав серы
3) расплав оксида кремния 4) раствор глюкозы
8. Сокращённое ионное уравнение Fe3+ + 3OH- = Fe(OH)3 соответствует взаимодействию
1) оксида железа(III) и гидроксида натрия 2) нитрата железа(III) и гидроксида меди(II)
3) хлорида железа(III) и гидроксида бария 4) хлорида железа(II) и гидроксида калия
9. С каждым из веществ — KOH, HCl, AgNO3 — взаимодействует
1) Mg 2) Fe 3) Al 4) Cu
10. Оксид серы(VI) взаимодействует с каждым из двух веществ:
1) вода и хлорид натрия 2) оксид кальция и раствор гидроксида натрия
3) кислород и оксид магния 4) вода и серебро
11. Водный раствор серной кислоты реагирует с каждым из веществ:
1) с железом и оксидом углерода(II) 2) с цинком и оксидом натрия
3) с алюминием и хлоридом натрия 4) с медью и гидроксидом калия
12. Сульфат бария можно получить в результате реакции нитрата бария с
1) оксидом серы(IV) 2) сернистой кислотой 3) сероводородом
4) сульфатом калия
13. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Мерный цилиндр нельзя использовать для нагревания раствора кислоты.
Б. С разрешения учителя в школьной лаборатории можно работать одному.
1) верно только А 2) верно только Б 3) верны оба суждения
4) оба суждения неверны
14. Элемент углерод является восстановителем в реакции
1) C + K =K4C 2) CO + H2 = CH4 + H2O 3) C + Cl2 = CCl4 4) MgO + CO2 = MgCO3
15. В каком соединении массовые доли кислорода и серы отличаются в 2 раза?
1) SO2 2) H2SO4 3) SO3 4)K2SO3
| При выполнении задания 16-17 из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны в порядке возрастания. |
16. В ряду химических элементов: Cl →Br →I
1) увеличиваются радиусы атомов
2) уменьшается электроотрицательность атомов
3) усиливаются неметаллические свойства
4) возрастает значение высшей степени окисления элементов
5) увеличивается число электронов во внешнем электронном слое атомов.
17. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Для метана верны следующие утверждения:
1) молекула содержит 4 атома водорода
2) является непредельным углеводородом
3) атом углерода в молекуле соединён с атомами водорода двойной связью
4) вступает в реакции присоединения с бромоводородом
5) вступает в реакцию замещения с хлором
| При выполнении заданий 18,19 к каждому элементу первого столба подберите соответствующий элемент из второго столбца. Запишите выбранные цифры, цифры могут повторяться. |
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА РЕАКТИВЫ
А) Na2CO3 и Na2SiO3 1) CuCl2
Б) K2CO3 и Li2SiO3 2) HCl
В) Na2SO4 и NaOH 3) MgO
4) K3PO4
19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
А) Al 1) CaCO3 и KOH
Б) SiO2 2) H2O и Na2SO4
В) Ca(OH)2 3) Ba(OH)2 и HNO3
4) SO2 и HCl
Часть 2.
| Задания 20 -22 с развернутым ответом. Сначала напишите номер задания (20, 21 или 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво. |
20. Используя метод электронного баланса, составьте уравнение реакции
Cu2O + HNO3 → NO + Cu(NO3)2 + H2O
Определите окислитель и восстановитель.
21. Через 32 г раствора с массовой долей сульфата меди (II) 5% пропустили избыток газообразного сероводорода до полного выпадения осадка черного цвета. Вычислите объем (н.у.) затраченного на реакцию газа.
22. Для проведения эксперимента предложены следующие реактивы: растворы серной кислоты, азотной кислоты, гидроксида натрия, хлорида кальция, хлорида бария, фенолфталеина. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор хлорида натрия. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение.
Вариант 2.
| При выполнении заданий 1—15 выберите один из четырёх предлагаемых вариантов ответа. Ответом на задания 16—19 является последовательность цифр или число. Ответ следует записать в поле для ответов справа от выполняемого задания без пробелов, запятых и других дополнительных символов. |
1. Какие два элемента имеют одинаковое число заполненных энергетических уровней?
1)Hе и Ne 2) Na и Cl 3) O и S 4)Be и Al
2. Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д. И. Менделеева порядковые номера
1) 4, 13, 30 2) 6, 11, 16 3) 19, 12, 3 4) 6, 14, 17
3. Одинаковый вид химической связи имеют
1) сульфид калия и оксид азота (I) 2) хлороводород и оксид бария
3) кальций и хлорид лития 4) водород и кремний
4. Одинаковую степень окисления атомы хлора имеют в соединениях:
1) Сl2O7 и HClO4 2) CaCl2 и Mg(ClO2)2 3) КClO3 и HCl 4) Cl2O и NaClO2
5. Вещества, формулы которых —ZnO и Na2SO3, являются соответственно
1) амфотерным оксидом и солью 2) основным оксидом и кислотой
3) основным оксидом и основанием 4) амфотерным гидроксидом и солью
6. Признаком протекания химической реакции между растворами нитрата серебра и хлорида кальция является
1) выделение газа 2) образование осадка 3) растворение осадка 4) появление запаха
7. Одинаковое число положительных и отрицательных ионов образуется при электролитической диссоциации
1) хлорида калия 2) хлорида бария 3) карбоната натрия 4) сульфата алюминия
8. Необратимое протекание реакции ионного обмена между растворами хлорида кальция и карбоната натрия обусловлено взаимодействием ионов
1) Ca2+ и Na+ 2) Ca2+ и NO3- 3) Cl- и Na+ 4) Ca2+ и CO3-
9. С каждым из веществ: H2O, Fe2O3, KOH— будет взаимодействовать
1) алюминий 2) магний 3) медь 4) серебро
10. Оксид алюминия взаимодействует с каждым из веществ:
1) медью и азотной кислотой 2) азотом и хлороводородом
3) оксидом калия и оксидом серы(VI) 4) гидроксидом кальция и сульфатом цинка
11. Гидроксид натрия реагирует с каждым из двух веществ:
1) гидроксидом алюминия и оксидом углерода(IV) 2) оксидом кальция и сульфатом бария 3) магнием и аммиаком 4) оксидом меди(II) и кремниевой кислотой
12. Осуществить превращение CuCl2 → CuS можно с помощью
1) серы 2) оксида серы(IV) 3) серной кислоты 4) сульфида натрия
13. Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро.
Б. Красками, содержащими ионы свинца, не рекомендуется покрывать детские игрушки и посуду.
1) верно только А 2) верно только Б 3) верны оба суждения
24) оба суждения неверны
14. Фосфор является окислителем в реакции
1) 2P+ 5Cl2 =2PCl5 2)P2O5 + 3H2O = 2H3PO4 3) 2P + 3Mg = Mg3P2
4) 2PH3 + 3O2 = 2H3PO4
15. Массовая доля серы в сульфате алюминия равна
1) 28,1% 2) 9,4% 3) 64,0% 4) 32,0%
| При выполнении задания 16-17 из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны в порядке возрастания. |
16. В ряду химических элементов Al → Mg → Na происходит уменьшение (ослабление)
1) числа электронов на внешнем энергетическом уровне
2) числа электронных слоев в атомах
3) металлических свойств
4) степени окисления в высших оксидах
5) основного характера свойств высших гидроксидов
17. Какие утверждения относительно метана справедливы?
1) хорошо растворим в воде
2) при сгорании выделяется большое количество теплоты
3) вступает в реакции замещения
4) реагирует с водородом
5) проявляет кислотные свойства
| При выполнении заданий 18,19 к каждому элементу первого столба подберите соответствующий элемент из второго столбца. Запишите выбранные цифры, цифры могут повторяться. |
18. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) Zn(ОН)2 и NaOH 1) растворение осадка
Б) H2SO4 и Na2SO3 2) выделение газа с резким запаха
В) BaI2 и AgNO3 3) выпадение белого осадка
4) выпадение желтого осадка
19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
А) СаСl2 1) Na и Fe2O3
Б) SO 2 2) CaO и Ba(OH)2
В) H2 3) H2O и NaNO3
4) Na2CO3 и AgNO3
Часть 2.
| Задания 20 -22 с развернутым ответом. Сначала напишите номер задания (20, 21 или 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво. |
20. Используя метод электронного баланса, составьте уравнение реакции
P2O3 + HBrO3 + H2O →H3PO4+ HBr
Определите окислитель и восстановитель.
21.К избытку карбоната кальция добавили 73 г раствора соляной кислоты с массовой долей 10%. Вычислите объем (н.у.) выделившегося газа.
22. Для проведения эксперимента предложены следующие реактивы: растворы гидроксида натрия, сульфата цинка, хлорида бария, хлорида цинка, нитрата натрия. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор гидроксид цинка. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение.
Вариант 3.
| При выполнении заданий 1—15 выберите один из четырёх предлагаемых вариантов ответа. Ответом на задания 16—19 является последовательность цифр или число. Ответ следует записать в поле для ответов справа от выполняемого задания без пробелов, запятых и других дополнительных символов. |
1. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
2. В атоме элемента два энергетических уровня заполнены электронами, а на третьем находятся 4 электрона. Какой это элемент?
1) кремний 2) углерод 3) кислород 4) сера
3. Ковалентная полярная связь образуется между атомами
1) натрия и брома 2) серы и кислорода 3) водорода 4) калия и хлора
4. Высшую степень окисления азот и фосфор имеют в соединениях
1) N2O5 и PH3 2) Ca3N2 и P2O5 3) HNO2 и P2O3 4)KNO3 и H3PO4
5. К кислотным оксидам относится каждое из двух веществ:
1) CO2 и CaO 2) CO и SiO2 3) SO2 и P2O5 4) P2O5 и Al2O3
6. Горение сероводорода 2H2S + 3O2 = 2SO2 + 2H2O является реакцией
1) окислительно-восстановительной, некаталитической, экзотермической
2) окислительно-восстановительной, каталитической, эндотермической
3) замещения, некаталитической, эндотермической
4) обмена, некаталитической, экзотермической
7. Наименьшее количество положительных ионов образуется при диссоциации 1 моль
1) азотной кислоты 2) карбоната натрия
3) сульфата алюминия 4) фосфата калия
8. Практически полностью в водном растворе взаимодействуют вещества:
1) нитрат серебра и хлороводород 2) нитрат кальция и хлорид калия
3) хлороводород и нитрат натрия 4) хлороводород и нитрат калия
9. И магний, и сера реагируют с
1) щелочами 2) разбавленной серной кислотой
3) азотом 4) кислородом
10. Оксид меди(II) взаимодействует с водным раствором
1) хлорида калия 2) хлороводорода 3) карбоната натрия 4) сульфата магния
11. Верны ли следующие суждения о свойствах кислот?
А. Все кислоты реагируют с металлами с выделением водорода.
Б. Концентрированная серная кислота реагирует с медью.
1) верно только А 2) верно только Б 3) оба суждения верны
4) оба суждения неверны
12. Превратить Ca(NO3)2 в CaSO3 можно с помощью
1) сероводорода 2) сульфита бария 3) сульфита натрия 4) сернистого газа
13. Верны ли суждения об экологической безопасности?
А. Не рекомендуется употреблять в пищу плодоовощные культуры, выращенные вблизи железных дорог и автомобильных магистралей.
Б. Овощные растения, выращенные с использованием избытка минеральных удобрений, не представляют опасности для организма человека.
1) верно только А 2) верно только Б 3) верны оба суждения
4) оба суждения неверны
14. SO2 является окислителем в реакции
1) SO2 + 2H2S =3S + 2H2O 2) SO2 + KOH = K2SO3 + H2O
3) SO2 + Br2 + 2H2O = H2SO4 + 2HBr 4)CaO + SO2 = CaSO3
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфита натрия?
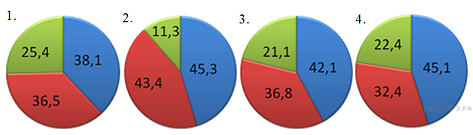
| При выполнении задания 16-17 из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны в порядке возрастания. |
16. Среди химических элементов Mg, Si, S
1) наибольший радиус имеют атомы серы
2) наибольшую электроотрицательность имеет магний
3) степень окисления −4 и +4 характерны только для кремния
4) только сера образует высший оксид с кислотными свойствами
5) простое вещество-металл образует только магний
17. Какие утверждения относительно жиров справедливы?
1) при обычных условиях — твердые вещества
2) входят в состав растительных и животных организмов
3) растворяются в воде
4) обладают моющими свойствами
5) являются одним из источников энергии для живых организмов
| При выполнении заданий 18,19 к каждому элементу первого столба подберите соответствующий элемент из второго столбца. Запишите выбранные цифры, цифры могут повторяться. |
18. Установите соответствие между двумя веществами и признаком протекающей между ними реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) AlCl3 и AgNO3 1) образование осадка
Б) Al(OH)3 и NaOH 2) растворение осадка
В) K2CO3 и HCl (р-р) 3) выделение газа
4) видимых признаков реакции не наблюдается
19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
А) CaO 1) CO2 и KNO3
Б) H2SO4 2) Cl2 и NaOH
В) Zn 3) HCl и C O2
4) KOH и Na2CO3
Часть 2.
| Задания 20 -22 с развернутым ответом. Сначала напишите номер задания (20, 21 или 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво. |
20. Используя метод электронного баланса, составьте уравнение реакции
MnO2 + HCl →Cl2+ MnCl2 + H2O
Определите окислитель и восстановитель.
21.Вычислите массу алюминия, который может прореагировать с 480 г 10%-ного раствора сульфата меди (II).
22. Для проведения эксперимента предложены следующие растворы: NaHCO3, Ba(NO3)2, HCl, LiCl, Na2SO4, H2SO4 (конц). Используя воду и необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор сульфат бария. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение
Вариант 4.
| При выполнении заданий 1—15 выберите один из четырёх предлагаемых вариантов ответа. Ответом на задания 16—19 является последовательность цифр. Ответ следует записать в поле для ответов справа от выполняемого задания без пробелов, запятых и других дополнительных символов. |
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8 2) 2 3) 6 4) 4
2. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 4, образует водородное соединение:
1) CH4 2) NH3 3) SiH4 4) H2S
3. Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород 2) хлорид бария и оксид натрия
3) хлорид натрия и оксид углерода(IV) 4) оксид лития и хлор
4. Атомы азота и углерода имеют одинаковую степень окисления в соединениях
1) NH3 и CO 2) NO2 и CCl4 3) N2O3 и CO 2 4)Na3N и CH4
5. Только основные оксиды представлены в ряду
1) CO и Na2O 2) CaO и Al2O3 3) BaO и P2O5 4) Na2O и FeO
6. Признаком протекания химической реакции между оксидом меди и водородом является
1) появление запаха 2) изменение цвета
3) выпадение осадка 4) выделение газа
7. Наибольшее количество положительных ионов образуется при диссоциации 1 моль
1) фосфата натрия 2) серной кислоты
3) нитрата железа(III) 4) сульфида калия
8. Сокращённое ионное уравнение Ca2+ + CO32- = CaCO3 соответствует взаимодействию
1) нитрата кальция и карбоната натрия 2) фосфата кальция и карбоната калия
3) нитрата кальция и карбоната бария 4) оксида кальция и оксида углерода(IV)
9. В реакцию с железом может вступать каждое из двух веществ:
1) MgCl2р-р и H2O 2) CuSO4р-р и O2 3) Na2SO4 р-р и Hg(NO3)2 р-р 4) S и NaOHр-р
10. С каждым из веществ, формулы которых NaOH, Mg, CaO будет взаимодействовать:
1) аммиак 2) оксид калия 3) оксид кремния (IV) 4) оксид меди(II)
11. Верны ли следующие суждения о свойствах щелочей?
А. Растворы щелочей не вступают в реакции с алюминием.
Б. Гидроксид калия реагирует с гидроксидом алюминия
1) верно только А 2) верно только Б
3) оба суждения верны 4) оба суждения неверны
12. Превратить BaCl2 в BaCO3 можно с помощью
1) углекислого газа 2) угарного газа 3) карбоната натрия 4) карбоната кальция
13. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии?
А. Стиральные порошки нельзя использовать для мытья посуды.
Б. Работать с хлорсодержащими дезинфицирующими средствами следует при плотно закрытой двери в помещении.
1) верно только А 2) верно только Б 3) верны оба суждения
4) оба суждения неверны
14. Сера является окислителем в реакции
1) H2S + I2 = S + 2HI 2) 3S + 2Al = Al2S3 3) 2SO2 + O2 =2SO3
4) S + 3NO2 = SO3 + 3NO
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата железа(II)?
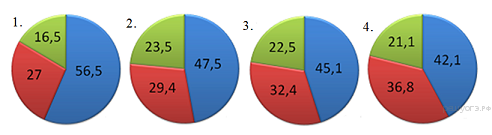
| При выполнении задания 16-17 из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны в порядке возрастания. |
16. Среди химических элементов Cl, S, P
1) наименьший радиус имеют атомы хлора
2) наибольшее значение электроотрицательности имеет сера
3) простые вещества-неметаллы образуют только хлор и сера
4) низшую степень окисления равную −3 имеет только фосфор
5) высший оксид с кислотными свойствами образует только сера
17. Какие утверждения относительно уксусной кислоты справедливы?
1) хорошо растворима в воде
2) практически не пахнет
3) проявляет свойства сильной кислоты
4) реагирует со щелочами
5) при обычных условиях находится в газообразном состоянии
| При выполнении заданий 18 - 19 к каждому элементу первого столба подберите соответствующий элемент из второго столбца. Запишите выбранные цифры, цифры могут повторяться. |
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) Ca(OH)2 и KOH 1) лакмус
Б) Ba(NO3)2 и BaCl2 2) нитрат серебра
В) KCl и HCl (р-р) 3) цинк
4) сульфат натрия
19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
А) Br2 1) CO2 и HCl
Б) SiO 2 2) HI и NaOH
В) Ca(OH)2 3) NaNO3 и H2SO4
4) HF и C
Часть 2.
| Задания 20 -22 с развернутым ответом. Сначала напишите номер задания (20, 21 или 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво. |
20. Используя метод электронного баланса, составьте уравнение реакции
H2SO4 +HI →I2 + H2O + H2S
Определите окислитель и восстановитель.
21. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
22. Даны вещества: Fe, BaBr2, Na2CO3, MnO2, KOH, H2SO4
Используя воду и необходимые вещества только из этого списка, получите в две стадии бром, не применяя электрический ток. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Критерии ответов
Часть 1.
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| Вариант 119 | 2 | 3 | 3 | 3 | 1 | 3 | 1 | 3 | 3 | 2 | 2 | 4 | 1 | 3 | 2 | 12 | 15 | 241 | 314 |
| Вариант 219 | 2 | 1 | 4 | 1 | 1 | 2 | 1 | 4 | 1 | 3 | 1 | 4 | 2 | 3 | 1 | 14 | 23 | 124 | 421 |
| Вариант 319 | 2 | 1 | 2 | 5 | 3 | 1 | 1 | 1 | 4 | 2 | 2 | 3 | 1 | 1 | 1 | 35 | 25 | 123 | 342 |
| Вариант 419 | 1 | 3 | 2 | 2 | 4 | 2 | 1 | 1 | 2 | 3 | 2 | 3 | 1 | 2 | 4 | 14 | 14 | 423 | 241 |
Часть 2.
20-1. Используя метод электронного баланса, составьте уравнение реакции
Cu2O + HNO3 → NO + Cu(NO3)2 + H2O. Определите окислитель и восстановитель.
| Cu2O + HNO3 → NO + Cu(NO3)2 + H2O |
|
| 2Cu+1 -2e →2Cu+2 2 3 | 1 |
| N+5 - 3e → N+2 3 2 |
| N+5 – о-ль Cu+1 -в-ль | 1 |
| 3Cu2O +14HNO3 → 2NO + 6Cu(NO3)2 + 7H2O | 1 |
| итого | 3 |
20-2. Используя метод электронного баланса, составьте уравнение реакции
P2O3 + HBrO3 + H2O →H3PO4+ HBr. Определите окислитель и восстановитель
| P2O3 + HBrO3 + H2O →H3PO4+ HBr |
|
| Br+5 - 6e → Br-1 6 4 2 | 1 |
| 2P +3 - 4e → 2P+5 4 6 3 |
| Br+5 – о-ль P+3 -в-ль | 1 |
| 3P2O3 + 2HBrO3 + 9H2O →6H3PO4+ 2HBr | 1 |
| Итого | 3 |
20-3. Используя метод электронного баланса, составьте уравнение реакции
MnO2 + HCl →Cl2+ MnCl2 + H2O. Определите окислитель и восстановитель.
| MnO2 + HCl →Cl2+ MnCl2 + H2O
|
|
| Mn+4 +2e →Mn+2 2 1 | 1 |
| 2Cl- - 2e → Cl20 2 1 |
| Mn+4 – о-ль Cl- -в-ль | 1 |
| MnO2 + 4HCl →Cl2+ MnCl2 + 2H2O | 1 |
| Итого | 3 |
20-4. Используя метод электронного баланса, составьте уравнение реакции
H2SO4 +HI →I2 + H2O + H2S. Определите окислитель и восстановитель.
| H2SO4 +HI →I2 + H2O + H2S
|
|
|  S+6 +8e →S-2 8 4 1 S+6 +8e →S-2 8 4 1
| 1 |
| 2I- - 2e → I20 2 1 4 |
| S+6 – о-ль I- -в-ль | 1 |
| H2SO4 +8HI →4I2 + 4H2O + H2S | 1 |
| Итого | 3 |
21-1. Через 32 г раствора с массовой долей сульфата меди (II) 5% пропустили избыток газообразного сероводорода до полного выпадения осадка черного цвета. Вычислите объем (н.у.) затраченного на реакцию газа.
| Уравнения реакции | баллы |
| CuSO4 + H2S = CuS↓+ H2SO4 | 1 |
| m(CuSO4)= m(р-ра) ∙ω = 32г ∙0,05 = 1,6 г n (CuSO4)= m/M= 1,6 :160=0,01 моль | 1 |
| По уравнению реакции: n (H2S) = n(CuSO4) = 0,01моль V(H2S)=n ∙Vm= 0,01 ∙ 22,4= 0,224л | 1 |
| Итого: | 3 |
21-2. К избытку карбоната кальция добавили 73 г раствора соляной кислоты с массовой долей 10%. Вычислите объем (н.у.) выделившегося газа.
| Уравнения реакции | баллы |
| CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ | 1 |
| m(HCl)= m(р-ра) ∙ω = 73г ∙0,1 = 7,3 г n (HCl)= m/M= 7,3 : 36,5=0,2 моль | 1 |
| По уравнению реакции: n (СО2) = 1/2n(HCl) = 0,1моль V(СО2)=n ∙Vm= 0,1 ∙ 22,4= 2,24л | 1 |
| Итого: | 3 |
21-3. Вычислите массу алюминия, который может прореагировать с 480 г 10%-ного раствора сульфата меди (II).
| Уравнения реакции | баллы |
| 2Al + 3CuSO4= 3Cu↓+ Al2(SO4)3 | 1 |
| m(CuSO4)= m(р-ра) ∙ω = 480г ∙0,1 = 48 г n (CuSO4)= m/M= 48 :160=0,3 моль | 1 |
| По УР: n (Al)=2/3∙n(CuSO4 )= 2/3 ∙0,3=0,2 моль m (Al)= 0,2 ∙ 27= 5 4 г | 1 |
| Итого: | 3 |
21-4. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
| Уравнения реакции | баллы |
| 3BaCl2 + Al2(SO4)3 = 3BaSO4↓+ 2AlBr3 | 1 |
| m(Al2(SO4)3 )= m(р-ра) ∙ω =68,4г ∙0,08 = 5,472 г n (Al2(SO4)3 )= m/M= 5,472 :342=0,016 моль | 1 |
| По УР: n(BaSO4) =3n∙ (Al2(SO4)3 )=3∙0,016=0,05 моль m (BaSO4)= 0,05 ∙ 233= 11,65 г | 1 |
| Итого: | 3 |
22-1. Для проведения эксперимента предложены следующие реактивы: растворы серной кислоты, азотной кислоты, гидроксида натрия, хлорида кальция, хлорида бария, фенолфталеина. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор хлорида натрия. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение.
| Уравнения реакции | Признак реакции | баллы |
| BaCl2 + H2SO4 = BaSO4↓+ 2HCl | выпадение белого осадка. | 2 |
| NaOH+ HCl →NaCl+ 2H2O | Обесцвечивание фенолфталеина. | 2 |
| H++ OH- = H2O |
| 1 |
| Итого: |
| 5 |
22-2. Для проведения эксперимента предложены следующие реактивы: растворы гидроксида натрия, сульфата цинка, хлорида бария, хлорида цинка, нитрата натрия. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор гидроксид цинка. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение.
| Уравнения реакции | Признак реакции | баллы |
| BaCl2 + H2SO4 = BaSO4↓+ 2HCl | выпадение белого осадка. | 2 |
| NaOH+ HCl →NaCl+ 2H2O | Обесцвечивание фенолфталеина. | 2 |
| H++ OH- = H2O |
| 1 |
| Итого: |
| 5 |
22-3. Для проведения эксперимента предложены следующие растворы: NaHCO3, Ba(NO3)2, HCl, LiCl, Na2SO4, H2SO4 (конц). Используя воду и необходимые вещества только из этого списка, получите в результате двух последовательных реакций раствор сульфат бария. Опишите признаки проводимых реакций. Для второй реакции напишите сокращенное ионное уравнение
| Уравнения реакции | Признак реакции | баллы |
| 2NaHCO3 + H2SO4= Na2SO4 + 2CO2↑+2H2O | Выделение газа без запаха и цвета | 2 |
| Na2SO4+ Ba(NO3)2 → BaSO4↓+ 2NaNO3 | выпадение белого осадка. | 2 |
| Ba2++ SO42- = BaSO4↓ |
| 1 |
| Итого: |
| 5 |
22-4. Даны вещества: Fe, BaBr2, Na2CO3, MnO2, KOH, H2SO4
Используя воду и необходимые вещества только из этого списка, получите в две стадии бром, не применяя электрический ток. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
| Уравнения реакции | Признак реакции | баллы |
| BaBr2 + H2SO4 = BaSO4↓+ 2HBr | выпадение белого осадка. | 2 |
| MnO2 + 4HBr →Br2+ MnBr2 + 2H2O | изменение цвета. | 2 |
| Ba2++ SO42- = BaSO4↓ |
| 1 |
| Итого: |
| 5 |








 S+6 +8e →S-2 8 4 1
S+6 +8e →S-2 8 4 1









