Государственное автономное профессиональное образовательное учреждение Тюменской области
«Тобольский медицинский колледж имени Володи Солдатова»
УЧЕБНИК ДЛЯ МЕДИЦИНСКИХ И ФАРМАЦЕВТИЧЕСКИХ КОЛЛЕДЖЕЙ
ПО ДИСЦИПЛИНЕ
«ОРГАНИЧЕСКАЯ ХИМИЯ»

Автор:
Хасанов Дилшод Наимович
Сборник №2
г. Тобольск – 2022
Предисловие
В последние годы большое число альтернативных школьных учебников и учебных программ по химии привело к тому, что выпускники школ, поступающие в средние профессиональные учебные заведения на базе основного общего образования, имеют разный уровень подготовки по этому предмету. Данный учебник, предназначенный для студентов средних профессиональных учебных заведений всех специальностей и написанный в соответствии с действующей примерной программой по химии, не только дает материал в объеме среднего (полного) общего образования, но и помогает студентам систематизировать и расширить знания по химии, приобретенные в школе
Раздел «Органическая химия» — это, по существу, новый для студентов материал. Особое внимание уделяется электронному строению органических веществ, свойствам функциональных групп органических соединений. Рассмотрены основные методы получения, физические, химические свойства и промышленные способы производства важнейших продуктов основного органического синтеза.
Весь материал, изложенный в учебнике, разделен на основной — предназначенный для широкого круга читателей (набран обычным шрифтом), и дополнительный — предназначенный для учащихся
Содержание
| Раздел 1. Введение в органическую химии |
Краткая история развития органической химии |
Предмет органической химии. Строение органических соединений. Теория химического строения А. М. Бутлерова |
Классификация органических соединений |
Кислотность и основность органических соединений |
| Раздел 2. Углеводороды |
| 2.1. Алканы |
| 2.2. Алкены |
| 2.3. Алкины |
| 2.4. Алкадиены |
| 2.5. Циклоалканы |
| 2.6. Ароматические углеводороды |
| 2.7. Природные источники углеводоров |
| Раздел 3. Гомофункциональные соединения |
| 3.1. Галогенопроизводные углеводороды |
| 3.2. Спирты |
| 3.3. Фенолы |
| 3.4. Простые эфиры |
| 3.5. Альдегиды и кетоны |
| 3.6. Карбоновые кислоты |
| 3.7. Сложные эфиры |
| 3.8. Жиры |
| 3.9. Поверхностно-активные вещества |
| 3.10. Амины |
| Раздел 4. Гетерофиункциональные соединения |
| 4.1. Аминокислоты |
| 4.2. Белки |
| 4.3. Углеводы |
| Раздел 5. Органический синтез |
| 5.1. Генетическая связь органических соединений |
| 5.2. Принципы органического синтеза |
| 5.3. Примеры синтезов |
Раздел 2. Углеводороды
2.1. Алканы
Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.
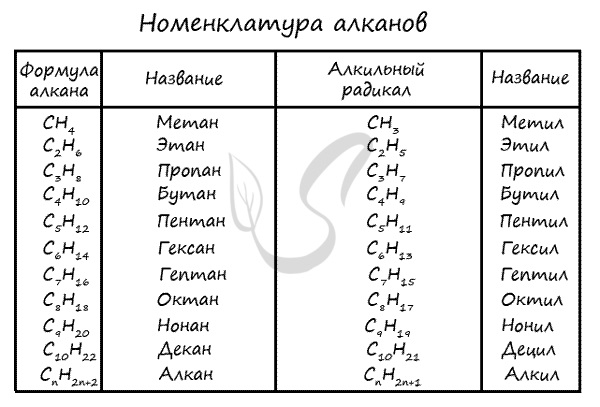
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
Тип гибридизации атомов углерода - sp3
Валентный угол (между химическими связями) составляет 109°28'
Получение алканов
В промышленности алканы получают путем:
Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
Гидрогенизацией угля (торфа, сланца)
C + H2 → (t, p) CH4
Гидрированием оксида углерода II
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
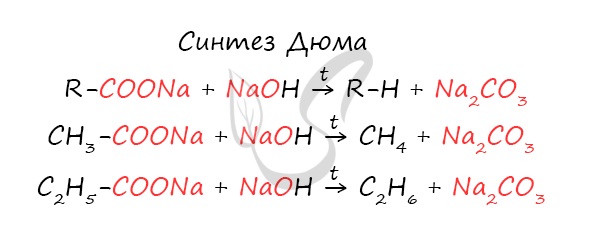
Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Реакция Вюрца
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

Синтез Гриньяра
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
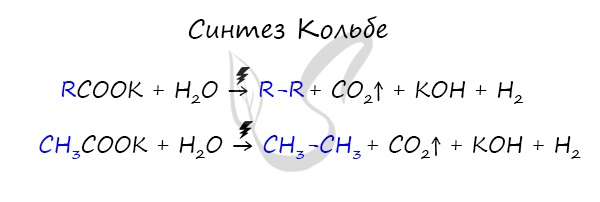
Синтез Кольбе
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Разложение карбида алюминия
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
Гидрированием ненасыщенных углеводородов
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

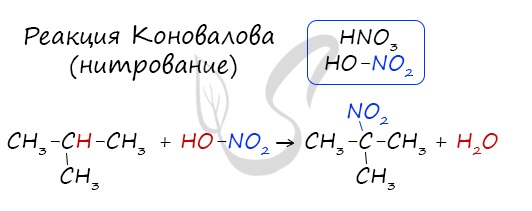
Нитрование (реакция Коновалова)
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.
Окисление
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
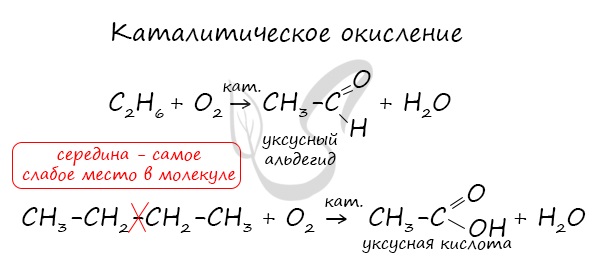
Пиролиз
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
CH4 → (t 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
Изомеризация
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Крекинг
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
2.2. Алкены
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
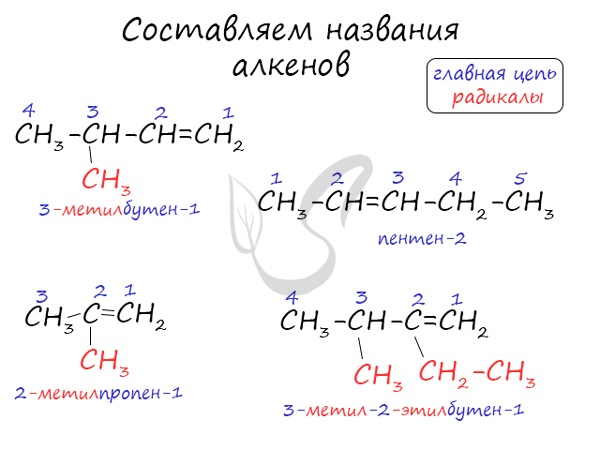
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
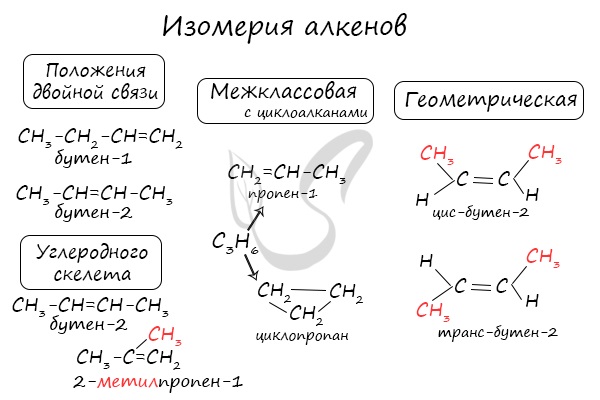
Некоторые данные, касающиеся алкены, надо выучить:
Длина связи между атомами углерода составляет 0,134 нм
Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp2
Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
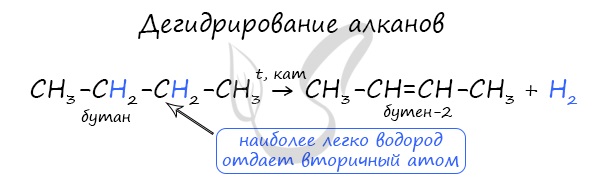
Дегидрирование алканов
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2
Дегидрогалогенирование галогеналканов
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

Дегалогенирование дигалогеналканов
В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

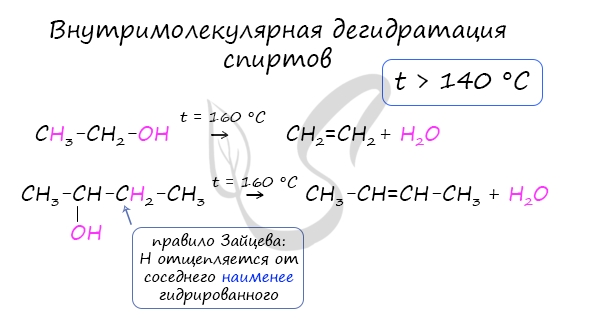
Внутримолекулярная дегидратация спиртов
При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t 140 °C.
Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
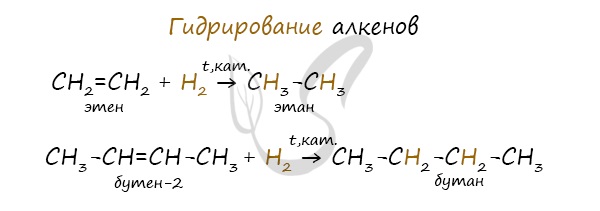
Гидрирование
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Галогенирование
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.

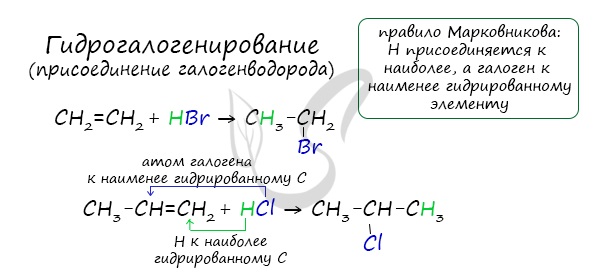
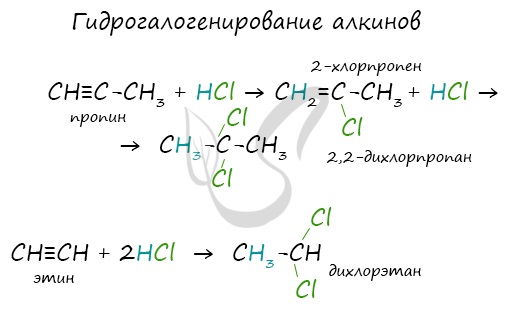
Гидрогалогенирование
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.
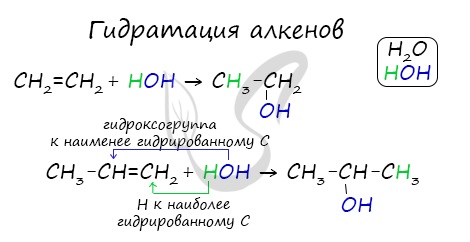
Гидратация
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.
Окисление
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.
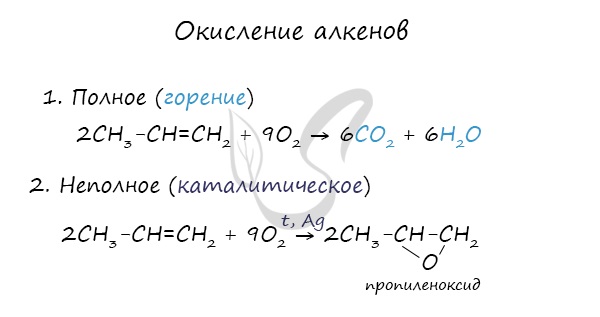
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
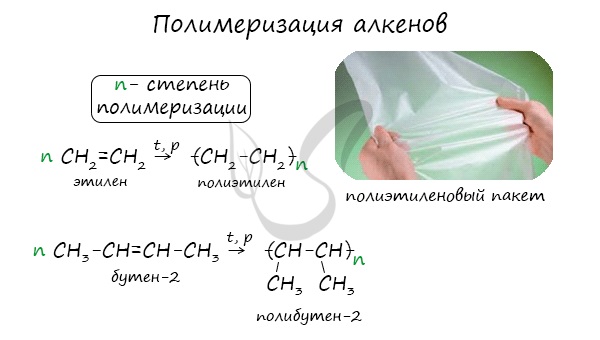
Полимеризация
Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
2.3. Алкины
Алкины - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда - этин - CH≡CH (ацетилен). Общая формула их гомологического ряда - CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса "ин" к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
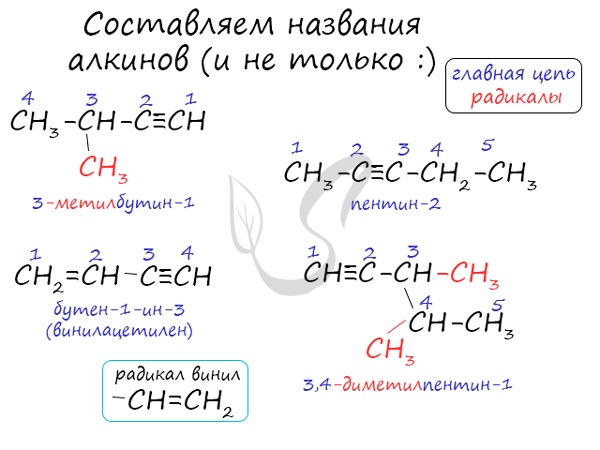

Некоторые данные, касающиеся алкинов, надо выучить:
В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
Тип гибридизации атомов углерода - sp
Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
Пиролиз метана
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
2CH4 → (t) CH≡CH + 3H2
Синтез Бертло
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
Разложение карбида кальция
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
CaC2 + 2H2O → CH≡CH + Ca(OH)2
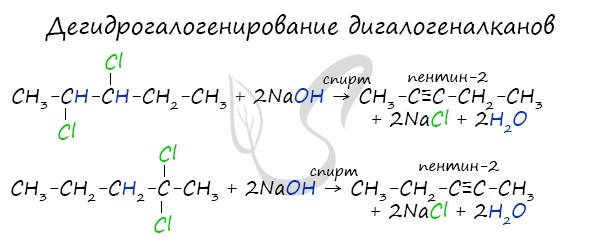
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкинов
Алкины - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Гидрирование
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH2=CH-CH3 + H2 → (t, Ni) CH3-CH2-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Галогенирование
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.

Гидрогалогенирование
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.
Реакция Кучерова
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор - соли ртути Hg2+.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.

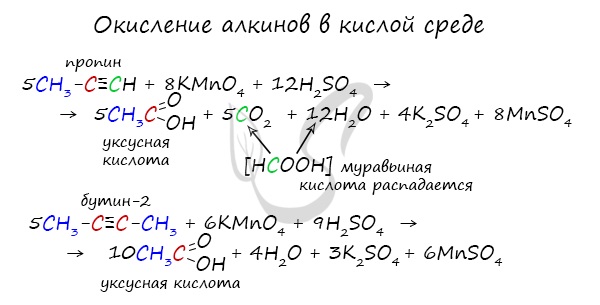
Окисление
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды - полное окисление.
2CH≡CH + 5O2 → 4CO2 + 2H2O
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте - в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
Реакция Н.Д. Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.

Димеризация ацетилена
Димеризация ацетилена происходит при наличии катализатора - солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.

Образование солей алкинов
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена - качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.

2.4. Алкадиены
Алкадиены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда - пропадиен - CH2=C=CH2. Общая формула их гомологического ряда - CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса "диен" к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составлении названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.


Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
Кумулированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример - пропадиен-1,2 (аллен) - CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом - sp-гибридизации.
Сопряженные двойные связи
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).

Пример - бутадиен-1,3 - CH2=CH-CH=CH2
Изолированные двойные связи
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример - пентадиен-1,4 - CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
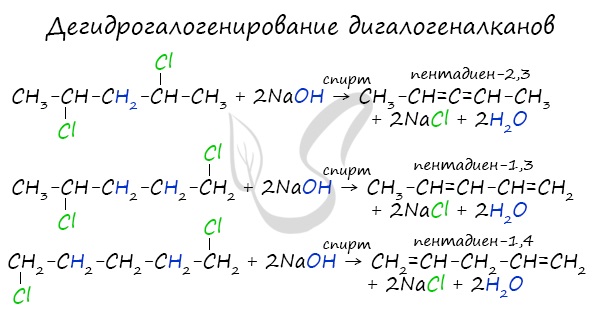
Дегидрогалогенирование дигалогеналканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Синтез С.В. Лебедева
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

Дегидрирование алканов
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
Гидрирование
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

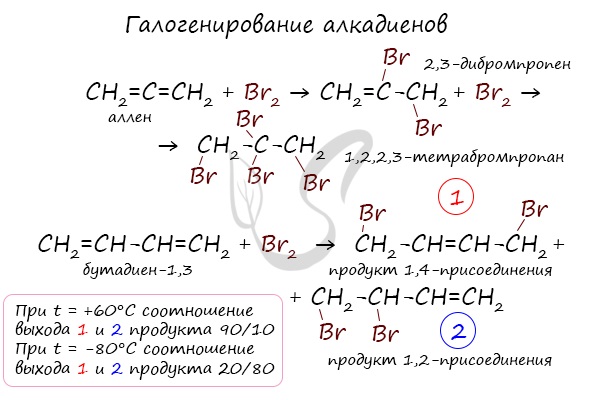
Галогенирование
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C - продукт 1,4-присоединения.
Гидрогалогенирование
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

Окисление
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация
Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

2.5. Циклоалканы
Циклоалканы (циклопарафины, нафтены) - циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки "цикло-" к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.

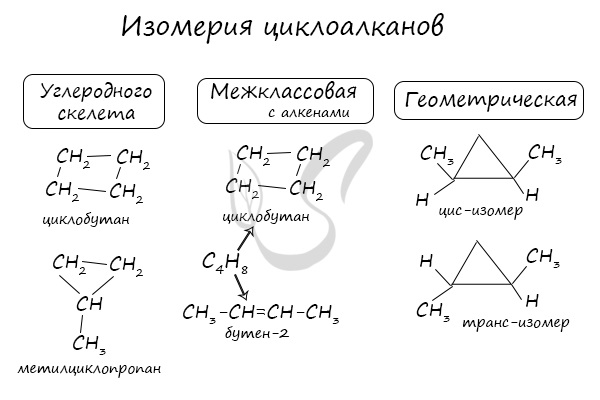
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
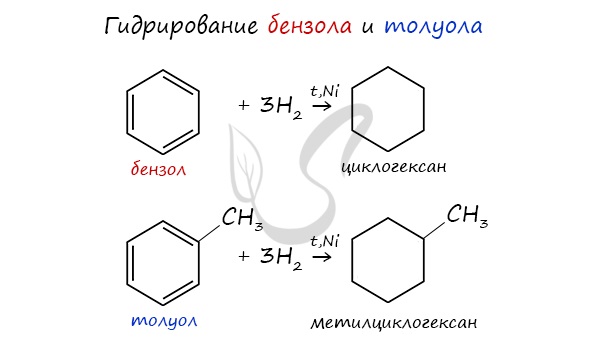
Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
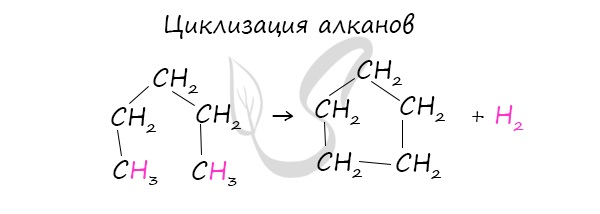
Циклизация алканов
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
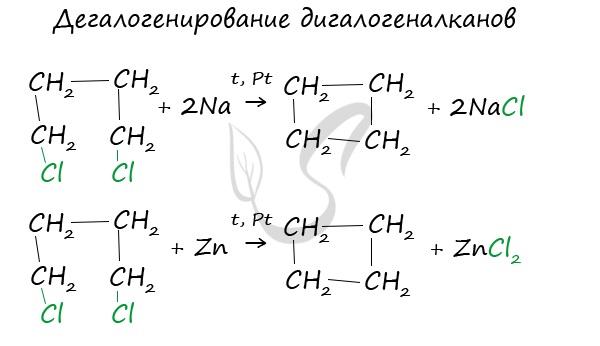
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
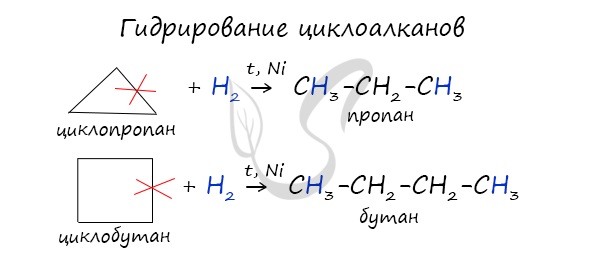
Гидрирование
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования.
Галогенирование
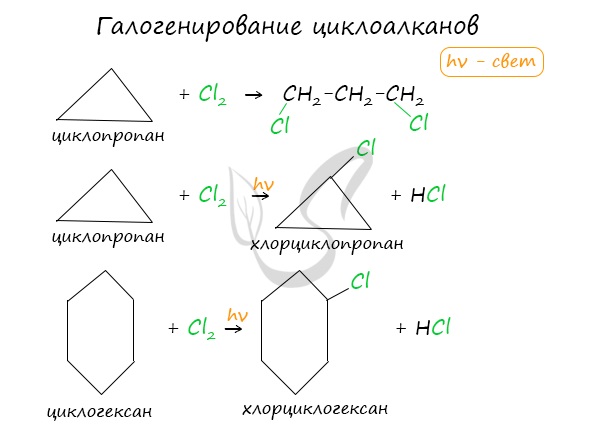
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
Гидрогалогенирование
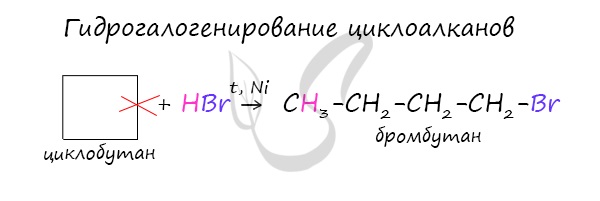
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
Дегидрирование
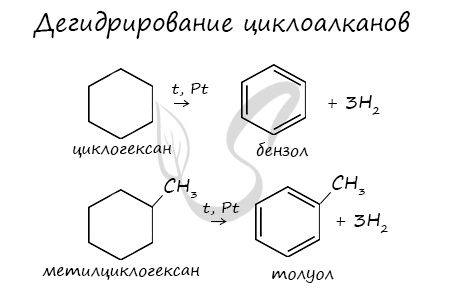
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов - гомологи бензола.
Изомеризация
В ходе нагревания с катализатором - AlCl3 циклоалканы образуют изомеры.
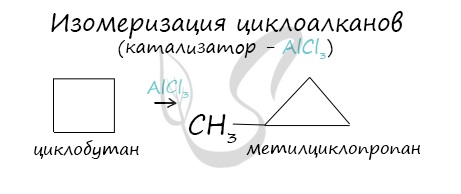
2.6. Ароматические углеводороды
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
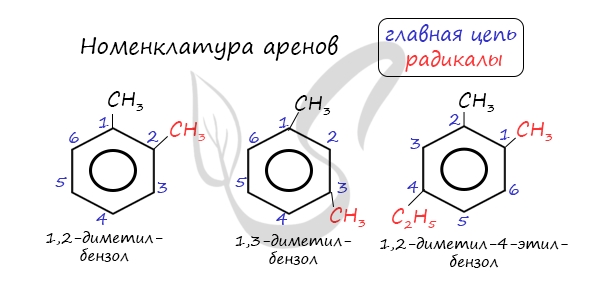
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
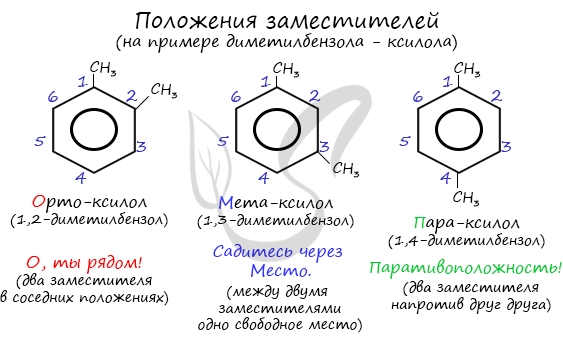
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Получение аренов
Арены получают несколькими способами:
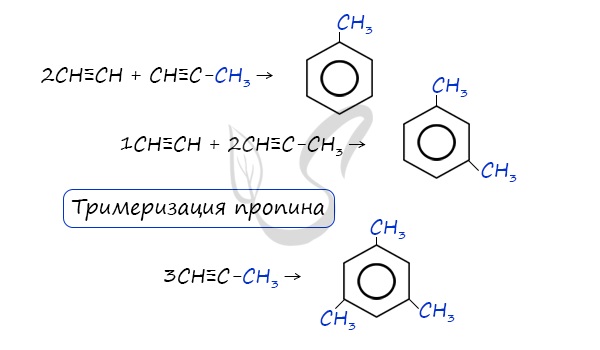
Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
Дегидроциклизация алканов
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.

При дегидроциклизации гептана получается толуол.
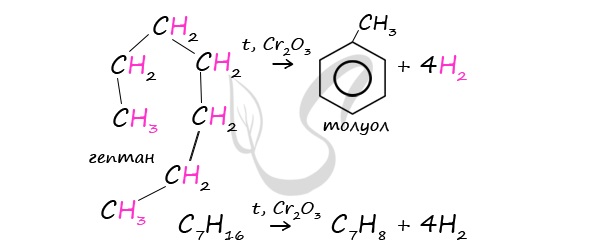
Дегидрирование циклоалканов
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.

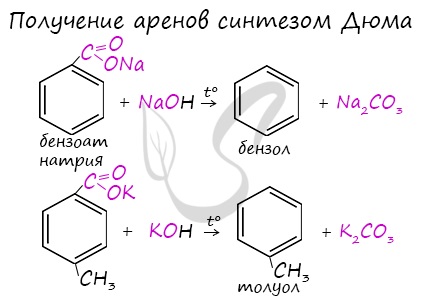
Синтез Дюма
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
Гидрирование
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.

Галогенирование
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
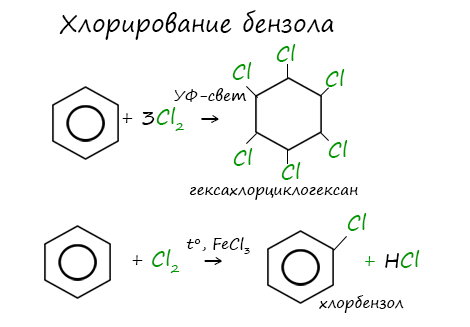
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).

Нитрование
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.

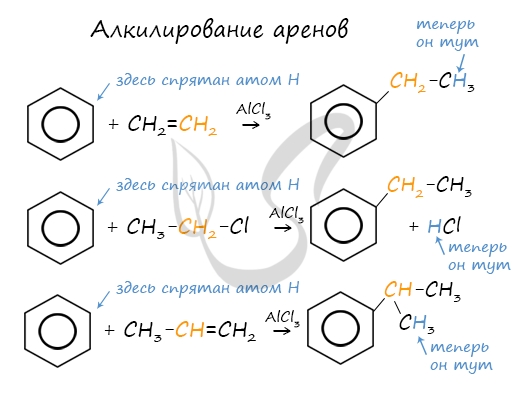
Алкилирование
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Окисление
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
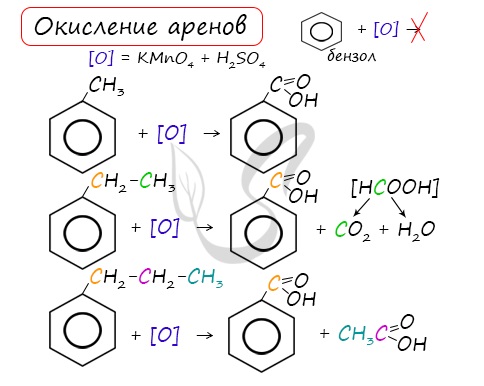
Полимеризация
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.

Контрольная работа №2 «Углеводороды»
Задания для контрольной работы
Задание 1.Напишите уравнения химических реакций для следующих превращений
CH4 → CH3Cl → C2H6 → C2H5NO2. Дайте названия продуктам реакции
Задание 2.Выведите молекулярную формулу УВ, массовая доля углерода, в котором составляет 83,3%. Относительная плотность паров этого вещества по водороду составляет 29.
Задания на дом:
Перечислите области применения алканов и алкенов



















































































