2.Место работы: Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №8»ЕМР РТ
3. Должность : учитель химии.
4. Педагогический стаж-31 год
5. Квалификационная категория: высшая
6.Ресурсы: Учебник: Химия 9 класс Габриелян О.С.: М.: Дрофа, 2011. Рекомендован Министерством образования и науки РФ.
7. Тип урока: урок изучения нового материала и первичного закрепления знаний.
9.Необходимое техническое оборудование: мультимедийный комплекс (компьютеры, проектор, экран); слайдовая презентация, видео единой коллекции ЦОР.
Реактивы: раствор азотной кислоты, концентрированная азотная кислота, медные стружки
Цель урока: изучить свойства азотной кислоты, отметить ее особенности взаимодействия с металлами. Рассмотреть области применения азотной кислоты.
составлять молекулярную и графическую формулы азотной кислоты.
-характеризовать свойства азотной кислоты, основываясь на общих свойствах кислот
-определять продукты взаимодействия азотной кислоты с металлами в зависимости от концентрации кислоты и активности металла
2.Развитие мотивов учебной деятельности и формирование личностного смысла обучения
3.Развитие навыков сотрудничества с учителем и сверстниками в разных учебных ситуациях
-умение самостоятельно обнаруживать и формировать учебную проблему, определять цель учебной деятельности
-умение работать по плану, сверять свои действия с целью и при необходимости исправлять ошибки самостоятельно
-умения слушать учителя и отвечать на вопросы.
-продолжить формирование навыков самостоятельности, взаимопомощи, эмоциональной мотивации в развитии личности, работа с учебником
| Деятельность учителя | Деятельность учеников |
| I. Организационный этап |
| – Приветствую учащихся. Отмечают отсутствующих. | – Отвечают на приветствие. Записывают число в тетради |
| II. Мотивационно-целевой этап |
| – Наш урок начнем с проверки знаний. Каждый правильный ответ – это1 балл (Слайд1)Бесцветный газ, плохо растворим в воде, легко соединяется с кислородом воздуха, образуя бурый газ (Слайд 2) ответ NO – оксид азота (II) (Слайд3) Газ бурого цвета с характерным резким запахом, хорошо растворим в воде (Слайд 4) Ответ: NО2- оксид азота (IV)  (Слайд 5 ) Составьте уравнения реакций по схеме. Назовите вещество Х NO → NO2 → Х Если про вещество Х известно из сказки Тарусовой М.С, что «Она родилась в самой волшебной, самой удивительной стране – химической лаборатории. Ее папа – оксид азота (IV), был мужчина злого нрава и носил прозвище «Лисий хвост». Ее мама была жизненно важной особой и звали ее Вода. Она появилась в атмосфере кислорода, дали ей красивое женское имя – Кислота. Но фамилию она получила……
Ребята, проверьте правильность написания уравнений химических реакций у партнера по парте(Слайд6) X – HNO3 (азотная кислота) 1.2NO+O2=2NO2 2.4NO2+2H2O+O2=4HNO3
Запишем тему нашего урока: Азотная кислота (слайд 7) (слайд 8)-Что мы знаем об азотной кислоте? (слайд 9) Давайте в течение одной минуты заполним корзину идей индивидуально, затем обменяемся информацией с партнером по парте, а далее совместно всем классом набросаем идеи в нашу корзину
Ребята в течении урока мы должны пополнять корзину недостающей информацией и систематизировать информацию из корзины об азотной кислоте. 
|
–отвечают на поставленный вопрос, записывают ответ в тетрадь
Ребята называют фамилию кислоты-азотная отвечают на поставленный вопрос, записывают уравнения химических реакций в тетрадь. взаимопроверяют уравнения химических реакций, выставляют баллы записывают тему урока в тетрадь.
Заполняют корзину идей индивидуально, затем обмениваются информацией с партнером по парте, а далее совместно ,фронтально заполняют корзину, нарисованную на доске.
|
| – Как вы думаете, какова цель нашего урока?
1. узнать (Что?)
2. понять (Что?)
3. научиться (Чему?)
4. закрепить (Что?)
5. зачем это надо?
Мы должны совместно на уроке узнать Строение азотной кислоты ,физические, химические свойства ,получение азотной кислоты Научиться правилам работы с азотной кислотой Закрепить знания о свойствах кислот А на вопрос зачем это надо? Мы ответим в разделе -области применения азотной кислоты | Ответы учащихся. |
| III. Организационно-деятельный этап |
| I. Строение азотной кислоты. (слайд 10,11) . 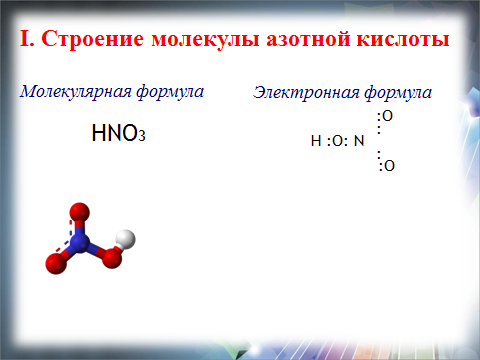 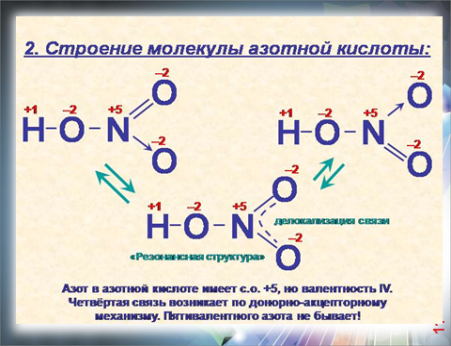 II.Характеристика азотной кислоты (слайд12) . 1.По основности азотная кислота : одноосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде: растворимая 4. По стабильности: нестабильная 5. По летучести: летучая 6. По степени диссоциации: сильная
III. Физические свойства (слайд 13) Демонстрация учителем азотной кислоты. Ребята ответьте на вопрос: Почему азотную кислоту хранят отдельно от других кислот и в темной таре? Агрегатное состояние – жидкость; Цвет – без цвета, при хранении на свету разлагается, приобретая желтоватый оттенок: 4HNO3=4NO2↑ + O2↑ + 2H2O Запах – резкий; Растворимость в воде – хорошая; «Дымит» на воздухе ,если концентрация более 60%; t кипения=830C При нагревании или даже небольшом освещении концентрированная азотная кислота разлагается:
Образующиеся оксид азота (IV) и кислород тоже очень химически активны.
Хранят ее в склянках темного стекла. Концентрированная азотная кислота и ее растворы требуют большой осторожности в обращении. Она может воспламенять многие органические вещества, окрашивает белки в желтый цвет. на коже может оставить болезненные язвы, а на одежде дыры
IV. Химические свойства Сегодня на уроке вам предстоит выяснить химические свойства этого особенного вещества. для начала нам необходимо повторить некоторые моменты: | Объяснение учителя. Учащиеся делают записи в тетрадь.
Ответы учащихся.
|
| -1) Перечислите общие свойства кислот? (называются общие свойства кислот – реакция на индикатор, взаимодействие с металлами, оксидами металлов, основаниями, растворами некоторых солей). (слайд 14)Из выданного перечня веществ выберите вещества с которыми будет реагировать разбавленная азотная кислота. Напишите уравнения соответствующих реакций в тетради: CuO, SO3, Cu(OH)2 , O2 ,Na2CO3,HCI
(слайд 15)Проверьте правильность написания уравнений реакций (взаимопроверка) Взаимодействует А) с оксидами металлов: CuO + 2HNO3 = Cu(NO3)2 + H2O Б) с основаниями: Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O В) с солями: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
| Ответы учащихся.
Выбирают вещества Записывают уравнения реакций в тетради
Запись уравнений реакций в тетради. Взаимопроверка (работа в паре) |
| -Ребята, вы наверно заметили, что среди веществ нет металлов. Конечно, азотная кислота реагирует с металлами, но не так как другие кислоты.
-Учитель демонстрирует в вытяжном шкафу взаимодействие концентрированной и разбавленной азотной кислоты с медными опилками .
-Как взаимодействует азотная кислота с другими металлами? Разобраться в этом поможет Памятка «Окисление металлов азотной кислотой разной концентрации», (слайд 16) 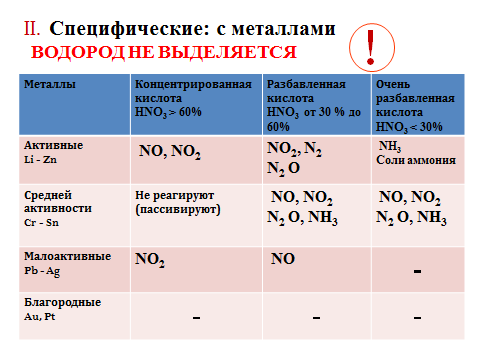 Давайте посмотрим Видеоопыт. Взаимодействие железа с концентрированной азотной кислотой (слайд 17)- (слайд 18) Видеоопыт. Взаимодействие ртути с концентрированной азотной кислотой  
|
Наблюдают, обращают внимание на правила техники безопасности при работе с азотной кислотой
Записывают в тетрадь памятку
Просматривают видео.Записывают особенности реакции Просматривают видео.Записывают особенности реакции
|
| ? Какие особенности взаимодействия азотной кислоты с металлами вы выяснили? Учащиеся отмечают, что в разной концентрации азотная кислота реагирует не только с металлами до водорода в ряду активности металлов, но и с металлами после водорода – медь, серебро и даже золото; никогда не образуется водород, продуктами реакций являются нитраты, оксиды азота и вода. | Ответы учащихся. |
| (слайд 19) Задание 1: Составьте уравнения соответствующих реакций, методом электронного баланса подберите коэффициенты: 1 вариант: Реакция разбавленной азотной кислоты с медью. 2 вариант: Реакция концентрированной азотной кислоты с медью .
| Выполняют задание по эталону Методом электронного баланса находят коэффициенты |
| Взаимопроверка (слайд 20) Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2↑ 3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO↑ | Обмениваются тетрадями ,взаимопроверка правильности написания уравнений, выставляют баллы в тетради друг другу |
| (слайд 21) Окислительные свойства. Взаимодействие с неметаллами: (S, P, C) Видеоопыт"Взаимодействие азотной кислоты с фосфором" (слайд 22) S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O B0 + 3HNO3 → H3B+3O3 + 3NO2 3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
| Просматривают видео.
Записывают в тетрадь уравнения |
| (слайд 23) Взаимодействует с органическими веществами (скипидар)(видеоопыт) Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук | Просматривают видео. |
| (слайд 24)V.Получение азотной кислоты: А) в лаборатории КNO3+ H2SO4 (конц)=KHSO4+HNO3 (слайд 25) Б ) в промышленности 4NH3 + 5О2 = 4NO + 6Н2О + Q 2NO + O2 = 2NO2 + Q 3NO2 + H2O = 2HNO3 + NO↑ + Q
| Записывают в тетрадь схему и уравнения реакций |
| (слайд 26)Давайте ответим на вопрос: Зачем это надо? -Где применяется азотная кислота? VI.Применение азотной кислоты
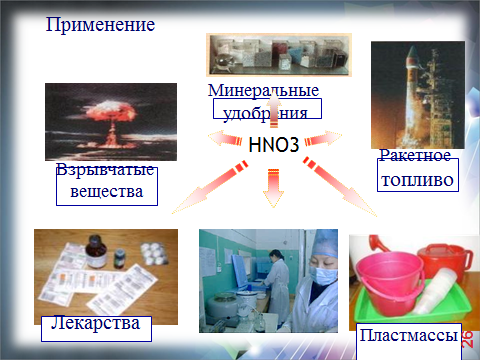
| Ребята находят по учебнику области применения азотной кислоты, |
| IV. Рефлексивно-оценочный этап |
| 1. Составьте кластер по азотной кислоте в тетради 2.Выберите цифры правильных утверждений: (слайд 27) 1.Степень окисления азота в азотной кислоте +5, а валентность только четыре. 2.Азотная кислота двухосновная кислородосодержащая кислота. 3. Азотная кислота слабый окислитель. 4.Азотная кислота окрашивает белки в желтый цвет. 5.Концентрированную азотную кислоту можно перевозить в железных цистернах. (слайд 28)Проверьте правильность ваших ответов Правильные ответы:1,4,5 | составляют кластер в тетради, взаимопроверяют и дополняют записи Выполняют самостоятельную работу. |
| (слайд 29)V. Домашнее задание§ 27, стр.158 упр. 2,3,5
| Записывают домашнее задание |
| Вот мы и нашли ответы на многие вопросы о свойствах азотной кислоты. Большую часть урока вы сами дополняли корзину идей, думали и рассуждали. Нам осталось подвести итог нашего урока. | оценивают свою работу, подсчитывают баллы. |
| VI. Подведение итогов урока |
| (слайд 30)– А сейчас давайте подведем итог вашей деятельности на уроке – оцените свою деятельность на уроке по 4 бальной системе:
Если активно участвовали – 4 балла.
Если ответили на 2 вопроса – 3 балла.
Если ответили на 1 вопрос – 2 балла. За каждое правильно выполненное задание-1 балл
Подсчитайте общее количество баллов
Если вы набрали 16-14 балла – оценка «5»
Если вы набрали 13-11 баллов – оценка «4»
Если вы набрали 10-7 баллов - оценка «3»
Если вы набрали менее 6 – вам надо подтянуться.
Спасибо всем за активную работу и поиск ответов на поставленные вопросы. | Оценивают и выставляют себе оценки за урок |































