| Движение электронов в атоме Заполни пропуски в тексте: Электрон вращается вокруг __________________ атома с невообразимой скоростью, образуя при этом объемное облако, форма и размер которого зависят от энергии электрона. Их называют ______________________ _______________________или_________________. Орбитали могут иметь разную форму. К аждый новый энергетический уровень начинается с одной ___-орбитали, которая имеет _______________________ форму. аждый новый энергетический уровень начинается с одной ___-орбитали, которая имеет _______________________ форму. 
На втором и последующих уровнях после одной s-орбитали появляются три ___-орбитали ____________________ формы. Любую орбиталь занимают не более ___ электронов. Следовательно, на s-орбитали их может быть не более___, а на трех р-орбиталях — не более ____ электронов. Н
а одной орбитали могут находиться только ___ электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелки) – Орбиталей d– и f-подуровня в атоме может быть уже пять и семь соответственно:   Запомни! Правила составления схемы строения электронных оболочек атомов: 1. Определяем общее число электронов на оболочке по порядковому номеру элемента. 2 . Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода 3. Определяем число электронов на каждом энергетическом уровне. . Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода 3. Определяем число электронов на каждом энергетическом уровне. 4. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. 2. Составь графическую и электронную формулу атома фосфора:
3. Проверь себя: 1. Найдите соответствие Название элемента Состав атома 1) кальций а. 35р 45п 35е 2) бром б. 19р20п 19е 3) калий в. 33р 42п 33е 4) мышьяк г. 20р 20п 20е 2. Найдите соответствие Вид электрона 1) 1s 2) 1 p Форма облака а . .
б . .
в  . .
г  . .
3. Запишите схему строения атома азота
4. Запишите электронную формулу атома магния.
5. Определите химический элемент, число протонов и нейтронов в ядре его атома +13 ) ) ) | 







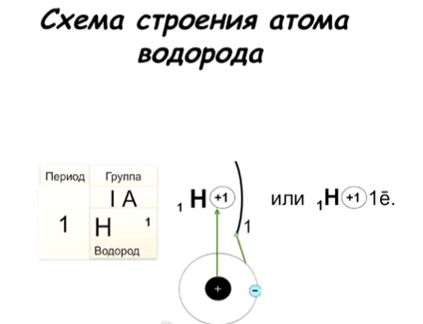
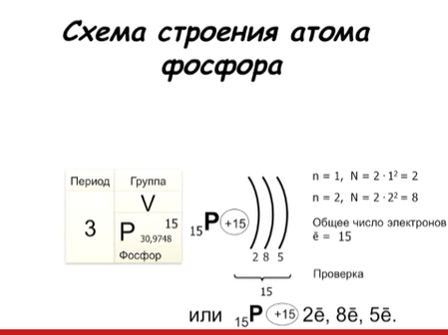

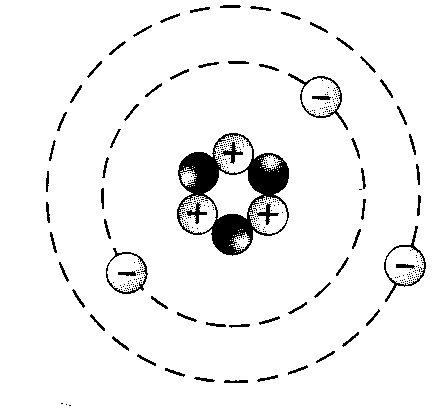
 . Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода 3. Определяем число электронов на каждом энергетическом уровне.
. Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода 3. Определяем число электронов на каждом энергетическом уровне.  .
.  .
. 

 .
.

















