Тэма: Аксід крэмнію (IV). Крэмніевая кіслата.
Мэта: пазнаёміць вучняў з будовай малекулы крэмніевай кіслаты, спосабамі яе атрымання і магчымасцямі прымянення соляў у сучаснай прамысловасці, а таксама абагульніць веды вучняў аб крэмнію, аксіду крэмнію (IV).
Задачы:
1. Адукацыйная: сфарміраваць паняцце крэмніевай кіслаты, пашырыць ўяўленне пра спосабы атрымання, уласцівасцях і спосабах прымянення сілікатаў ў прамысловасці. Пазнаёміць школьнікаў з экалагічнымі праблемамі вытворчасцей сілікатнай прамысловасці.
2. Развіваючая: працягнуць развіццё ў вучняў асноўных прыёмаў мыслення (умення аналізаваць, параўноўваць і г. д.), удасканальваць уменне вучняў самастойна працаваць з дадатковай інфармацыяй. Развіваць экалагічнае выхаванне школьнікаў, закласці ў аснову выхавання ўяўленні аб ўзаемасувязі складу, будовы, уласцівасцей і біялагічнай функцыі рэчываў, іх дваістай ролі ў жывой прыродзе.
3. Выхаваўчая: працягнуць хімічную і экалагічную адукацыю школьнікаў.
Тып урока: камбінаваны.
Абсталяванне:
праектар, камп’ютар, экран;
відэаролік “Хімічныя ўласцівасці крэмнію і яго злучэнняў”;
відэаролік “Атрыманне крэмніевай кіслаты”;
відэаролік “Вытворчасць мастацкага шкла”;
відэаролік “Працэс вытворчасці флаат-шкла”.
Ход урока
1. Арганізацыйны момант.
Прывітанне да вучняў. Адзнака адсутнічаючых на ўроку. Падрыхтоўка да ўрока, падрыхтоўка абсталявання.
2. Праверка д\з.
3. Вывучэнне новага матэрыялу.
1. Агучванне тэмы і задач урока.
2. Аповяд і тлумачэнні настаўніка аб будове малекулы і ўласцівасцях аксіду крэмнію (IV). На дошцы прыводзяцца адпаведныя запісы малекулы аксіду крэмнію з тлумачэннем будовы. Вучні выконваюць запісы ў сшытку.
Аксід крэмнію (IV) – SiO2 – кварц, горны крышталь, аметыст, агат, яшма, апаў, кремнезем (асноўная частка пяску).
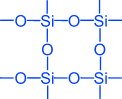
Al2O3 • 2SiO2 • 2H2O – каалін (асноўная частка гліны)
K2O • Al2O3 • 6SiО2 – ортаклаз (палявы шпат)
Прыводзяцца формулы на дошцы і вучні запісваюць у сшытак.
Кіслотны аксід. Пры сплаўленне ўзаемадзейнічае з асноўнымі аксідамі, шчолачамі, а таксама з карбанатамі шчолачных і шчолачназямельных металаў:
1) з асноўнымі аксідамі:
SiO2 + CaO t→ CaSiO3
2) са шчолачамі:
SiO2 + 2NaOH t→ Na2SiO3 + H2O
3) з вадой не рэагуе.
4) з солямі:
SiO2 + CaCO3 t → CaSiO3 + CO2 ↑
SiO2 + K2CO3 t → K2SiO3 + CO2 ↑
5) з плавікавай кіслатой:
SiO2 + 4HF t→ SiF4 + 2H2O
SiO2 + 6HF t→ H2[SiF6] (гексафторкрэмніевая кіслата) + 2H2O
(рэакцыі ляжаць у аснове працэсу апрацоўкі шкла).
3. Аповяд і тлумачэнні настаўніка аб будове малекулы і ўласцівасцях крэмніевай кіслаты’.
Крэмніевая кіслата – H2SiO3
H2SiO3 – метакрэмніевая кіслата. H4SiO4 – ортакремніевая кіслата і г. д.
Формулы прыводзяцца надошцы і запісваюцца ў сшытак.
H2SiO3 – вельмі слабая (слабей вугальнай), нетрывалая, у вадзе маларастваральная (ўтварае калоідны раствор), не мае кіслага густу.
Дзеянне моцных кіслот на сілікаты:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
2Na+ + SiO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2SiO3 ↓
2H+ + SiO32- = H2SiO3 ↓
Дадзеная рэакцыя з’яўляецца якаснай на сілікат-іон.
Прагляд відэароліка “Атрыманне крэмніевай кіслаты”.
Запіс вучнямі на дошцы і ў сшытку ўраўнення рэакцыі атрымання крэмніевай кіслаты ў поўнай і скарочанай іоннай форме.
Пры награванні раскладаецца: H2SiO3 t → H2O + SiO2
1) з кіслотамі:
Na2SiO3 + H2O + CO2 = Na2CO3+ H2SiO3
2) з солямі:
Na2SiO3 + CaCl2 = 2NaCl + CaSiO3↓
3) Сілікаты, якія ўваходзяць у склад мінералаў, у прыродных умовах разбураюцца пад дзеяннем вады і аксіду вугляроду (IV) – выветрыванне горных парод:
(K2O • Al2O3 • 6SiO2) (палявы шпат) + CO2 + 2H2O →
(Al2O3 • 2SiO2 • 2H2O)(каалін (гліна)) + 4SiO2(крэмнязём (пясок)) + K2CO3
Фізкультмінутка
Усе ўсталі, узмахнулі рукамі ўверх і ўніз (4 разы);
Рухі тулавам улева і ўправа (4 разы), рукі на поясе;
Рухі галавой улева і ўправа (4 разы), кругавыя рухі галавой (4 разы);
Гімнастыка для вачэй з выкарыстаннем трэнажора
(4 разы выконваюцца рухі вачэй).
Прымяненне злучэнняў крэмнію
Гутарка з вучнямі.
Аповяд настаўніка аб прыродных злучэннях крэмнію і вытворчасці шкла.
1. Выраб сілікатнай цэглы
2. Выраб керамічных вырабаў
3. Атрыманне шкла
Прыродныя злучэнні крэмнію – пясок (SiO2) і сілікаты, якія выкарыстоўваюцца для вытворчасці керамікі, шкла і цэменту.
Аповяд настаўніка
Кераміка
Фарфор = каалін+ гліна + кварц + палявы шпат.
Радзіма фарфору – Кітай, дзе фарфор вядомы ўжо ў 220г.
У 1746 г – наладжана вытворчасць фарфору ў Расіі.


Фаянс – ад назвы італьянскага горада Фаэнца, дзе ў 14 –15стагоддзях было развіта керамічнае рамесніцтва. Фаянс адрозніваецца ад фарфору вялікім утрыманнем гліны (85%), больш нізкай тэмпературай абпалу.
Шкло – далікатны, празрысты матэрыял, здольны размягчацца і пры застыванні прымае любую форму. Шкло атрымліваюць варэннем шыхты (сыравіннай сумесі, якая складаецца з пяску, соды і вапняка) у спецыяльных шклаварнай печах. Пры даданні аксіду свінцу атрымліваюць крышталь.
Агляд відэароліка "Вытворчасць мастацкага шкла".
Na2SiO3 + CaSiO3 + 4SiO2 = Na2O * CaO * 6SiO2 – формула аконнага шкла.
Гутарка пасля прагляду відэароліка з класам.
Агляд відэароліка "Працэс вытворчасці флаат-шкла".
Гутарка.
Запіс на дошцы Ф.І. вучоных,
якія распрацавалі методыку выпрацоўкі каляровага шкла.
Дадатковая інфармацыя аб вытворчасці шкла змешчана на стэндзе
“Хачу ўсё ведаць!”.
III. Замацаванне вывучанага матэрыялу.
Адказы на пытанні:
• Назавіце вышэйшую і ніжэйшую ступені акіслення крэмнію.
• Якая формула і характар аксіду?
• Якая формула гідраксіду крэмнію (крамянёвай кіслаты), яе асаблівасць?
Ажыццявіце ператварэнні па схеме:
1) Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2
Рашэнне нумароў задач са зборніка задач па хіміі 10 класа
В.М. Хвалюк, В.І. Рэзяпкін 2013: № 1079, 1100, 1113.
Ацэньванне работы на ўроку вучняў, выстаўленне адзнак.
IV. Рэфлексія
V. Д\з
§ 47, пр. 4
§ 48, пр. 7.
Гутарка з тлумачэннем выканання дамашніх задач.
9




























