Муниципальное Казенное Общеобразовательное Учреждение «Какамахинская СОШ им.А.Баганда»
Утверждаю:
Зам. дир. по УВР
___________ /Маллаев А.М/
_____________20___г.
Коспект
урока-игры в 10 классе
по теме
«Белки».
Учитель химии и биологии:
Уруджева Э.А.
Какамахи.
Тема урока: «Белки».
Дата проведения: ______________
Тип урока: урок освоения новых знаний.
Цель урока: углубить знания о важнейшем классе биологически значимых органических соединений – белках.
Задачи:
Обучающие:
сформировать представление у учащихся о белках как о непериодических линейных биополимерах, состоящих из различных аминокислотных остатков;
охарактеризовать состав и химическое строение полипептидных молекул, а также первичную, вторичную, третичную и четвертичную структуру белка;
ознакомить учащихся с важнейшими функциями белков;
способствовать формированию знаний у учащихся о качественных реакциях на молекулы белка.
Развивающие:
способствовать развитию познавательного интереса у учащихся, умения устанавливать межпредметные связи;
совершенствовать способность учащихся анализировать, сравнивать, устанавливать взаимосвязь между строением и свойствами веществ.
Воспитательные:
показать материальное единство органического мира;
способствовать формированию научного мировоззрения.
Планируемые образовательные результаты: учащиеся должны усвоить понятие «белки», «пептидные связи»; уметь охарактеризовать существующие уровни структурной организации белков; знать основные функции и свойства белков; уметь классифицировать белковые вещества по разным признакам; знать качественные реакции, позволяющие определить белковые молекулы.
Основные термины, понятия: белки, природные полимеры, амидная (пептидная) связь, полипептидная цепь, дисульфидные мостики, глобулярные и фибриллярные белки, гидрофильность, студни, денатурация белка, пенообразование, ксантопротеиновая и биуретовая реакции.
Оборудование: компьютер, видеопроектор, экран, демонстрационная презентация к уроку, учебник, раздаточный материал – таблицы «Строение белковых молекул».
Ход урока:
Организационный момент (1 мин).
Деятельность учителя
Деятельность учащихся
Приветствует учащихся. Отмечает отсутствующих (слайд 1).
Приветствуют учителя.
Мотивация учебной деятельности (3 мин).
Деятельность учителя
Деятельность учащихся
Учитель произносит вступительное слово:
«Органические соединения составляют в среднем 20-30% массы клетки живого организма. К ним относятся биологические полимеры – углеводы, нуклеиновые кислоты, белки и жиры. На этом уроке мы расширим ваши знания о строении и функциях молекул белка, их химических свойствах, а также познакомимся с качественными реакциями на белки»
Эпиграфом урока будут слова Фридриха Энгельса «Жизнь – это способ существования белковых тел» (слайд 2).
Учащиеся слушают вступительное слово учителя. Записывают дату и тему урока в тетради.
Повторение и актуализация опорных знаний (4 мин).
Деятельность учителя
Деятельность учащихся
Учитель проводит фронтальный опрос учащихся с целью актуализации имеющихся знаний по теме «Аминокислоты».
За правильный ответ ученик получает один балл и получает фишку. В конце урока учащиеся, имеющие 5 фишек – получают отметку «отлично», 4 – «хорошо», 3 – «удовлетворительно» в журнал (слайд 3)
Что называется аминокислотой?
Какая функциональная группировка придает аминокислоте – кислотные, а какая – щелочные свойства?
Каким особым свойством обладают аминокислоты?
В результате какой реакции образуется пептидная связь?
Как называют соединение, образованное при взаимодействии трех аминокислот?
Сколько видов аминокислот входит в состав белков?
Учащиеся отвечают на вопросы учителя с места.
Дают предположительные верные ответы:
Органические соединения, содержащие в молекулах одновременно амино- и карбоксильные группы.
Карбоксильная группа придает кислотные свойства, а аминогруппы – щелочные свойства.
Вступают в реакцию друг с другом.
В результате реакции поликонденсации.
Называется трипептидом.
20 аминокислот.
Химические свойствазложение нового материала (28 мин).
Деятельность учителя
Деятельность учащихся
4.1 Состав и строение белков.
Учитель знакомит учащихся с понятием «белки». Дает подробную характеристику структур белковых молекул.
«Среди органических веществ клетки белки занимают первое место как по количеству, так и по значению.
Белки – это высокомолекулярные природные полимеры, молекулы которых построены из остатков α-аминокислот, соединенных амидной (пептидной) связью.
В организме человека встречается 5 млн. типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Порядок их чередования может быть самым разнообразным; благодаря этому возможно существование огромного числа молекул белка, отличающихся друг от друга. Например, из 20 остатков аминокислот теоретически можно составить около 2 • 1018 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит, и формой, и свойствами.
Элементарный состав белковых веществ колеблется незначительно (в % на сухую массу):
углерод – 51-53; кислород – 21,5-23,5; азот – 16,8-18,4; водород – 6,5-7,3; сера – 0,3-2,5.
Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка - около 300 аминокислот.
Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структуры белка. Углерод карбонильной группы, азот и связанные с ними четыре атома лежат в одной плоскости. Валентные углы при sp2-гибридном атоме углерода близки к 1200, при sp3-гибридном атоме углерода - 1100.
Группа атомов –СО – NH -, с помощью которой связаны две α-аминокислоты, называется пептидной связью .
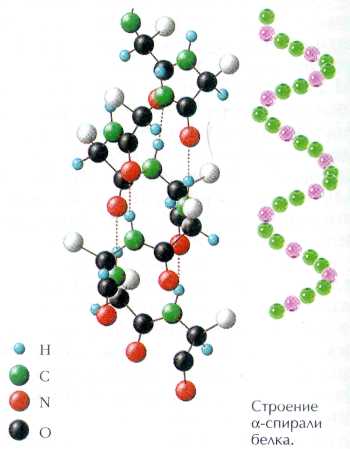
В пространстве полипептидная цепь белка может располагаться двумя способами. Она может быть закручена в спираль, на каждом витке которой располагается 3,6 звена аминокислот с обращенными наружу радикалами. Отдельные витки скреплены между собой водородными связями между группами NH и СО различных участков цепи. Такая структура белка называется α-спираль и наблюдается, к примеру, у α-кератина (шерсть, волосы, ногти).
Если боковые группы аминокислотных остатков не очень велики (глицин, аланин, серии), две полипептидных цепи могут быть расположены параллельно и скрепляться между собой водородными связями. При этом полоса получается не плоской, а складчатой. Это β-структура белка, характерная, например, для фиброина шелка.
Таким образом, вторичная структура - это спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами СО и NH .
Полипептидные цепочки с определенной вторичной структурой могут быть по-разному расположены в пространстве. Это пространственное расположение α-спирали или β-структуры в пространстве получило название третичной структуры.
Третичная структура - пространственная конфигурация спирали в пространстве. Эта структура поддерживается за счет гидрофобных взаимодействий, водородных, дисульфидных, ионных связей.
По характеру «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.
В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют более сложные структуры. Четвертичная структура - способ совместной укладки нескольких глобул. Есть не у всех белков» .
4.2 Функции белков
Учитель знакомит учащихся с основными функциями белковых молекул (слайд 10).
«Функции белков в клетке чрезвычайно многообразны:
Одна из важнейших — строительная (структурная) функция: белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур.
Исключительно важное значение имеет каталитическая (ферментативная) роль белков. Все ферменты — вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз.
Двигательная функция живых организмов обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы.
Транспортная функция белков заключается в присоединении химических элементов (например, кислорода) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела.
Защитная функция. При поступлении в организм чужеродных белков или микроорганизмов в белых кровяных тельцах — лейкоцитах — образуются особые белки — антитела. Они связывают и обезвреживают несвойственные организму вещества (антигены).
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции.
Белки служат и одним из источников энергии в клетке, т. е. выполняют энергетическую функцию. При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.»
4.3 Химические свойства белков.
Учитель знакомит учащихся с основными химическими свойствами белков, а также с качественными реакциями на белковые молекулы.
С помощью презентации учитель показывает учащимся опыты, для наглядной демонстрации химических свойств белков .
«Белки обладают следующими химическими свойствами:
Гидратация белков. В процессе гидратации молекулы белка связывают молекулы воды, проявляя гидрофильные свойства. Набухают, масса и объем белков увеличиваются. При ограниченном набухании концентрированные белковые растворы образуют сложные системы – студни.
Гидролиз белков. В кислой среде белки расщепляются до составляющих аминокислот.
Горение белков. Белки горят с образованием азота, углекислого газа и воды. Горение сопровождается характерным запахом жженых перьев.
Пенообразование. Это способность белков образовывать высококонцентрированные системы «жидкость-газ», называемые пенами. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле).
Денатурация белков. Это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. нативной (естественной) пространственной структуры. Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость. Способность к гидратации, теряется биологическая активность.
Качественные (цветные) реакции на белки :
Биуретовая реакция. Слабощелочные растворы белков реагируют с раствором сульфата меди (II) и образуются комплексные соединения, имеющие сине-фиолетовую окраску.
Ксантопротеиновая реакция. Реакция между ароматическими и гетероатомными циклами молекул белка и концентрированной азотной кислотой приводит к появлению желтой окраски.
Учащиеся записывают определения понятий «белки», «пептидная связь», «первичная структура», «вторичная структура» и «третичная структура» в рабочую тетрадь.
Вклеивают раздаточный материал – таблицу «Строение белковых молекул».
Конспектируют в тетрадь основные моменты, отраженные на слайдах презентации.
Учащиеся кратко конспектируют в рабочую тетрадь основные функции белков.
Учащиеся записывают в тетрадь основные химические свойства белков.
Наблюдают за демонстрационными опытами презентации.
Первичное закрепление изученного материала. Рефлексия деятельности (5 мин).
Деятельность учителя
Деятельность учащихся
Учитель предлагает учащимся пройти мини-тест по теме «Белки», который представлен на слайде.
Время, которое отводится для ответов на вопросы теста, составляет 5 мин.
По окончанию времени ученики меняются своими листочками и оценивают работу соседа.
Варианты правильных ответов учитель открывает на слайде.
1. Первичная структура белка удерживается:
а) водородными связями;
б) пептидными связями;
в) гидрофобными связями;
г) дисульфидными связями.
2. Вторичную структуру белковой молекулы поддерживают в основном … связи.
а) водородные;
б) ионные;
в) пептидные;
г) гликозидные.
3. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.
4. Как поступают в клетки животных незаменимые аминокислоты?
а) синтезируются в самих клетках;
б) поступают вместе с пищей;
в) поступают вместе с витаминами;
г) поступают всеми указанными путями.
5. Полипептидная цепь, свернутая в клубок, – это … структура белка.
а) первичная;
б) вторичная;
в) третичная;
г) четвертичная.
Учащиеся на листочках выполняют задания теста, предложенного учителем. Затем обмениваются с соседом по парте листами и проверяют правильность данных ответов.
Правильные ответы:
1. б. 2. а.
3. г. 4. б.
5. в.
Подведение итогов урока (2 мин).
Деятельность учителя
Деятельность учащихся
Учитель совместно с учащимися оценивает урок и принимает их предложения и пожелания.
Учитель выставляет отметки в журнал.
Осознание учащимися своей учебной деятельности, самооценка результатов своей деятельности и всего класса.
Учащиеся считают количество полученных фишек за правильные ответы.
Информация о домашнем задании (3 мин) – слайд.
§ 27 (с. 227-241) прочесть, ответить на вопросы 1-5 на стр. 241-242.
Задание 10 на стр. 242 выполнить письменно.
Решить предложенные задачи (по желанию, на оценку):
Вычислите массу соли, которую можно получить при взаимодействии 150 г 5%-ного раствора аминоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-ного раствора щелочи потребуется для реакции?
Навеску аминоуксусной кислоты разделили на две порции в соотношении 1:2. Меньшую порцию нейтрализовали избытком раствора гидроксида натрия. При этом образовалось 29,1 г соли. Какую массу сложного эфира можно получить из большей порции аминоуксусной кислоты, если массовая доля выхода эфира составляет 73%? Для реакции этерификации использовали этанол.
Долгосрочное индивидуальное задание.
Выполнить на выбор творческую работу:
теме «Превращения белков в организме»
Список использованной литературы (слайд 18):
Габриелян О. С. Органическая химия, 10 класс: методическое пособие: книга для учителя / О. С. Габриелян, Т. П. Попкова, А. А. Карцева. - М.: Просвещение, 2006. -159 с.
Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразовательных учреждений / О.С. Габриелян, Ф.Н. Маскалев, С.Ю. Пономарев, В.И. Теренин - М.: Дрофа, 2008. – 318 с.
Левина Э.М. Химия в схемах и таблицах для 8-11 классов общеобразовательных школ / Э.М. Левина, В.В. Кириллов. – СПб: Тригон, 2008. – 176 с.
Органическая химия. 10-11 класс. - М.: Лаборатория систем мультимедиа. - МарГТУ, 2002. - (Образовательная коллекция).
Щербатых Ю.В. Биология в схемах и таблицах: учебное пособие. – М.: Эксмо, 2007. – 384 с.
http://files.school-collection.edu.ru/dlrstore/5bc7baa2-0ff5-7ba3-5838-35fb7120ea4e/00148919052680926.htm
http://him.1september.ru/
http://school-sector.relarn.ru/nsm/chemistry/Rus/chemy.html
http://www.himhelp.ru/section25/section27kilur/section141/
Приложение 1.
Раздаточный материал.
Таблица - «Строение белковых молекул»
-NH-CO-
В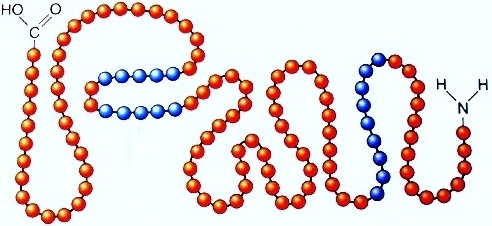 торичная -спиралевидная
торичная -спиралевидная
Закручивание полипептидной линейной цепи в спираль – спиралевидная структура.
Внутримолекулярные водородные связи (CO…HN CO…HN).
Третичная – глобулярная. Упаковка вторичной спирали в клубок – клубочковидная структура. Дисульфидные и ионный связи.

Четвертичная структура
Совместная упаковка и укладка нескольких полипептидных цепей сложных белков за счет водородных связей, электростатических и гидрофобных взаимодействий приводит к образованию четвертичной структуры. 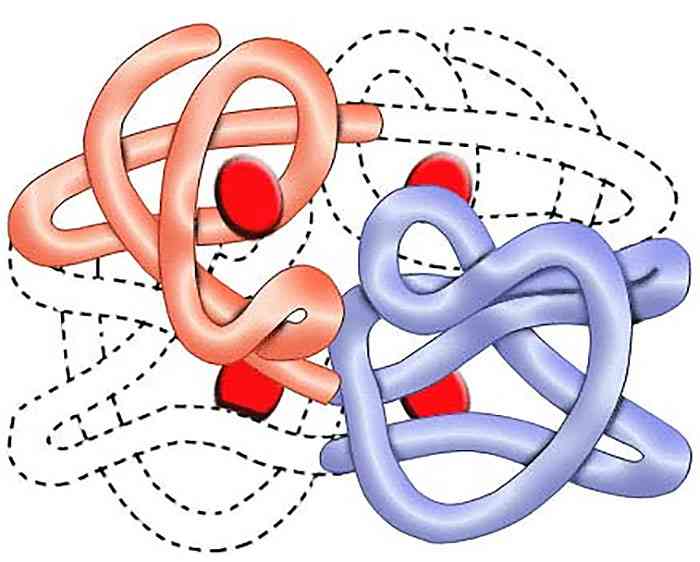






 торичная -спиралевидная
торичная -спиралевидная