
Спирты

Определение
- Спирты — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, -OH),непосредственно связанных с атомом углерода в углеводородном радикале.
Общая формула одноатомных спиртов C n H 2n+1 OH

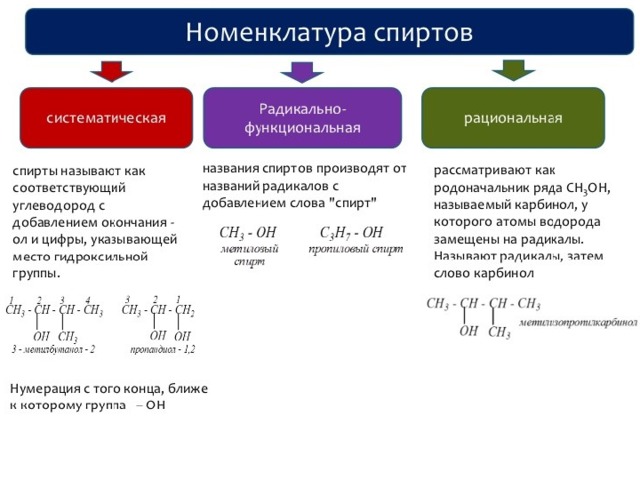
Названия спиртов
- Названия одноатомных спиртов образуются от названия углеводорода с самой длинной углеродной цепью, содержащей гидроксильную группу, путём добавления суффикса - ол.
- Положение гидроксильной группы в главной цепи молекулы указывают цифрой после суффикса - ол.
- Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, ...) указывается количество гидроксильных групп.
Классификация спиртов
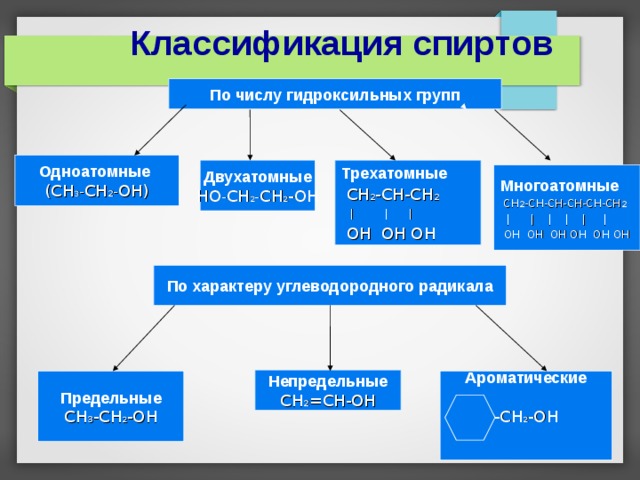
По числу гидроксильных групп
Одноатомные
(СН 3 - CH 2 - ОН)
Трехатомные
Двухатомные
СН 2 -СН-СН 2
| | |
ОН ОН ОН
НО - СН 2 - СН 2 -ОН
Многоатомные
СН 2 -СН-СН- CH-CH- СН 2
| | | | | |
ОН ОН ОН ОН OH OH
По характеру углеводородного радикала
Непредельные
СН 2 =СН-ОН
Ароматические
Предельные
-СН 2 -ОН
СН 3 -СН 2 -ОН
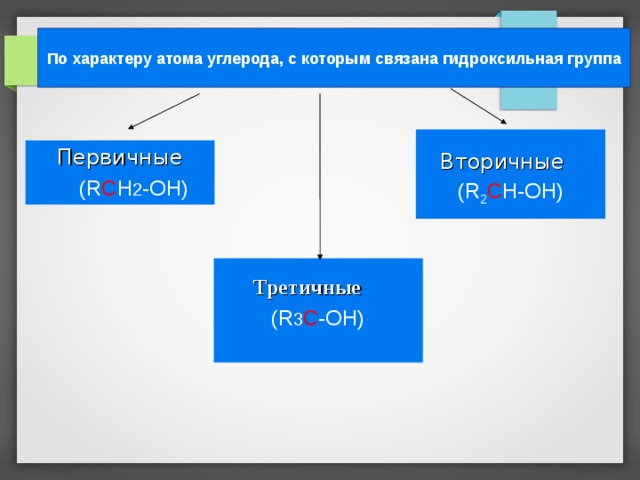
По характеру атома углерода, с которым связана гидроксильная группа
Первичные
(R C H 2 -OH)
Вторичные
(R 2 C H-OH)
Третичные
(R 3 С -ОН)
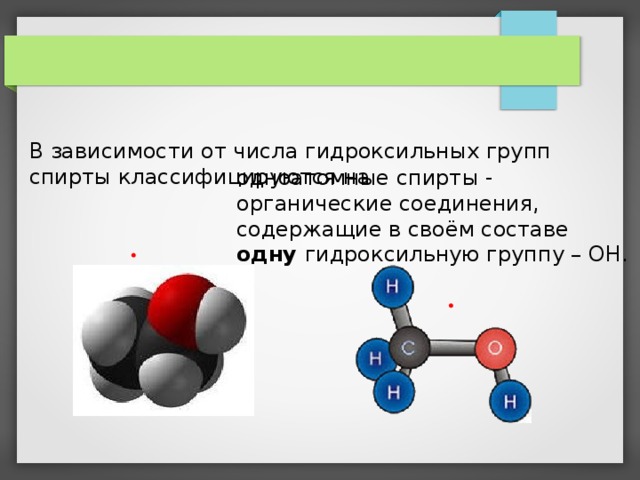
В зависимости от числа гидроксильных групп спирты классифицируются на
одноатомные спирты - органические соединения, содержащие в своём составе одну гидроксильную группу – ОН.
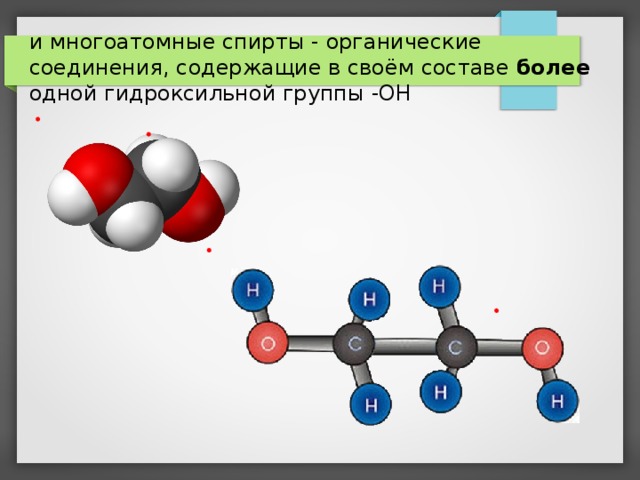
и многоатомные спирты - органические соединения, содержащие в своём составе более одной гидроксильной группы -ОН
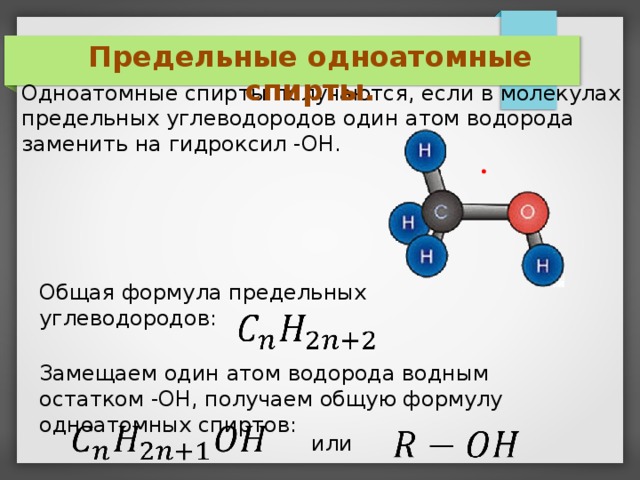
Предельные одноатомные спирты.
Одноатомные спирты получаются, если в молекулах предельных углеводородов один атом водорода заменить на гидроксил -OH.
Общая формула предельных углеводородов:
Замещаем один атом водорода водным остатком -OH, получаем общую формулу одноатомных спиртов:
или
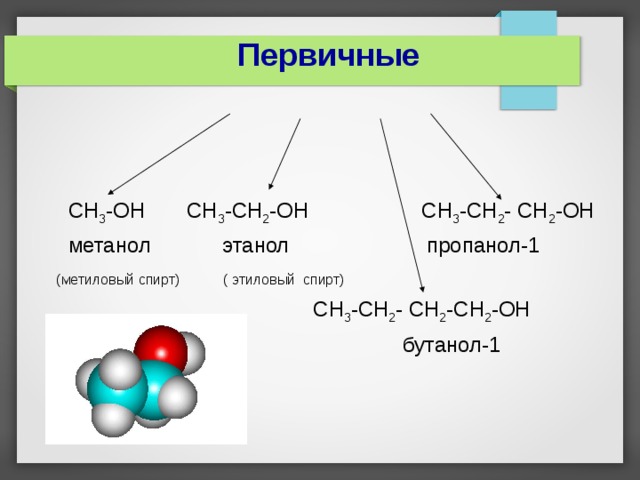
Первичные
СН 3 -ОН СН 3 -СН 2 -ОН СН 3 -СН 2 - СН 2 -ОН
метанол этанол пропанол-1
(метиловый спирт) ( этиловый спирт)
СН 3 -СН 2 - СН 2 - C Н 2 - OH
бутанол-1
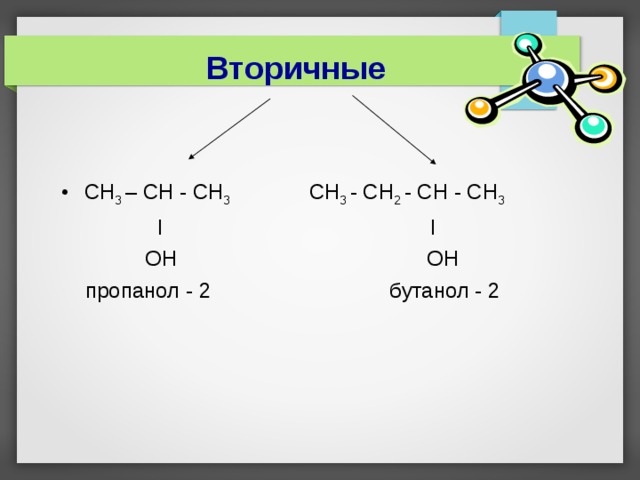
Вторичные
- СН 3 – СН - СН 3 СН 3 - СН 2 - CH - СН 3
I I
OH OH
пропанол - 2 бутанол - 2
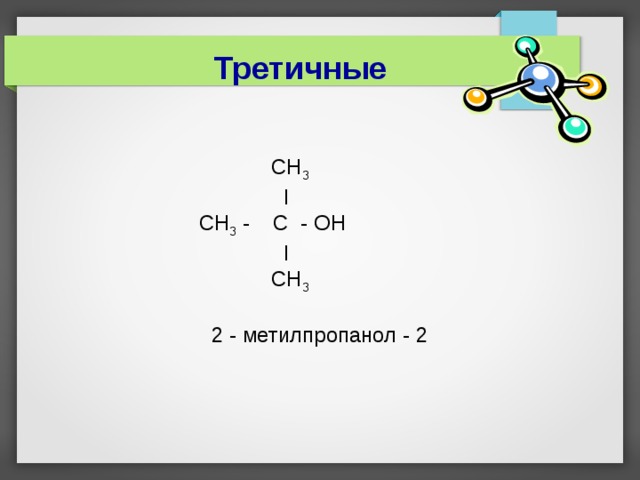
Третичные
СН 3
I
СН 3 - C - O Н
I
СН 3
2 - метилпропанол - 2

Изомерия спиртов
1. Изомерия углеродного скелета (соединения отличаются порядком расположения углерод-углеродных связей)
CH3-CH2-CH2-CH2-OH CH3-CH-CH2-OH
|
CH3
(бутанол-1) (2-метилпропанол-1)
2. Изомерия положения функциональной OH - группы ( т.е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений)
CH3-CH2-CH2-OH CH3-CH-CH 3
I
OH
(пропанол-1) ( пропанол-2)

3. Необходимо отметить, что для спиртов характерен еще один вид изомерии – межклассовая ( предельные одноатомные спирты изомерны простым эфирам).
Например : этиловый спирт (С 2 H 5 O Н) и диметиловый эфир(С H 3 -О-СН 3 )– изомеры: эти вещества имеют одинаковый состав, но разное строение, т.е. различный порядок соединения атомов в молекулах, а потому и разные свойства.
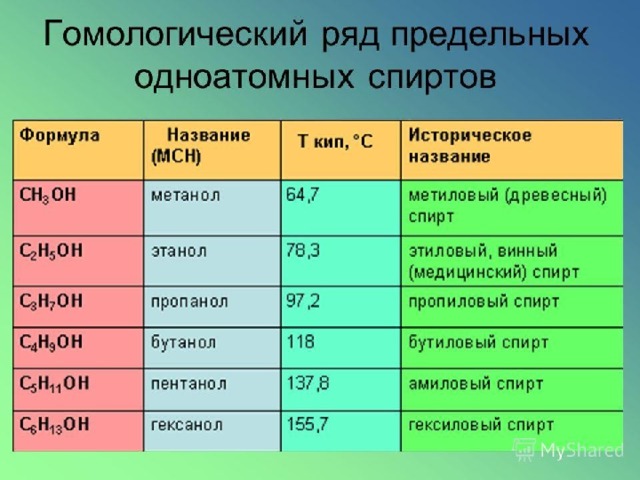

Физические свойства одноатомных спиртов.
В любом гомологическом ряду существует закономерность.
С увеличением молекулярной массы предельных углеводородов и спиртов увеличивается температура кипения.
Также, t o кипения спиртов значительно больше t o кипения углеводородов.
Почему?
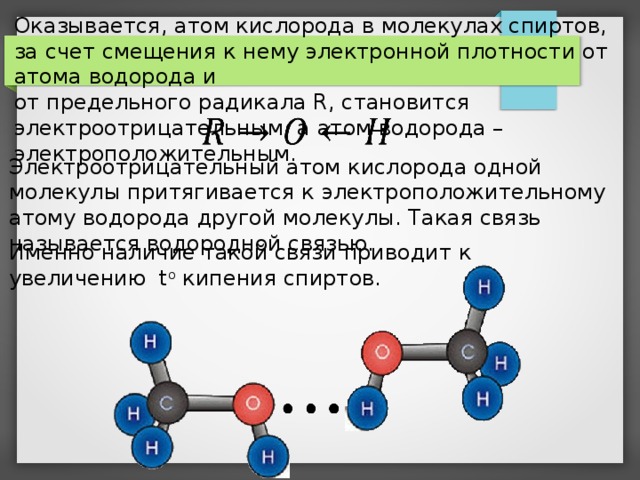
Оказывается, атом кислорода в молекулах спиртов, за счет смещения к нему электронной плотности от атома водорода и
от предельного радикала R, становится электроотрицательным, а атом водорода – электроположительным.
Электроотрицательный атом кислорода одной молекулы притягивается к электроположительному атому водорода другой молекулы. Такая связь называется водородной связью.
Именно наличие такой связи приводит к увеличению t o кипения спиртов.
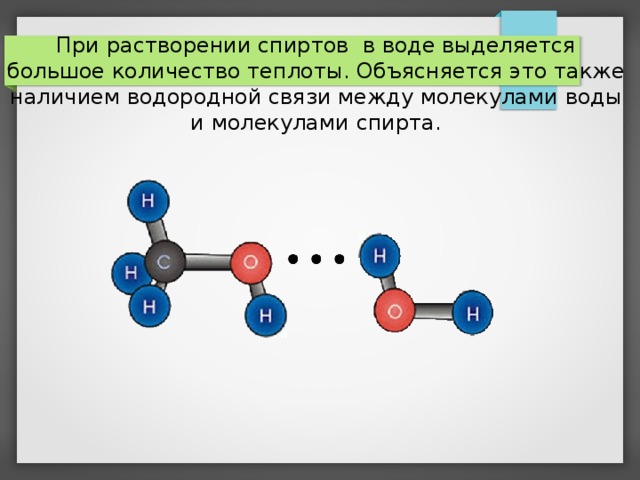
При растворении спиртов в воде выделяется большое количество теплоты. Объясняется это также наличием водородной связи между молекулами воды и молекулами спирта.
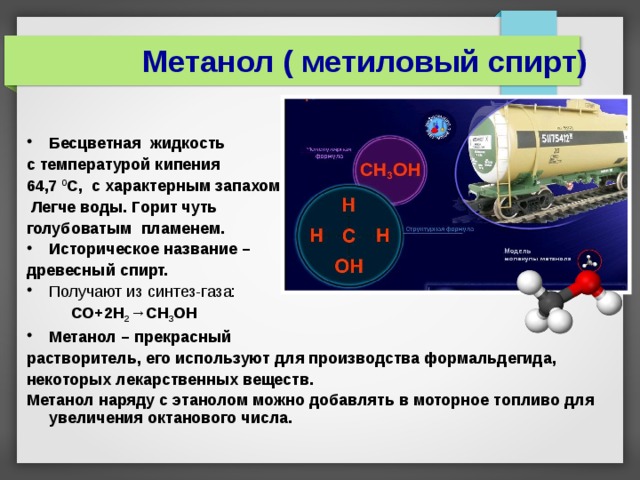
Метанол ( метиловый спирт)
с температурой кипения
64,7 0 С, с характерным запахом.
Легче воды. Горит чуть
голубоватым пламенем.
древесный спирт.
СО+2Н 2 →СН 3 ОН
растворитель, его используют для производства формальдегида,
некоторых лекарственных веществ.
Метанол наряду с этанолом можно добавлять в моторное топливо для увеличения октанового числа.

Метанол – очень ядовит!
Метанол – нервно-сосудистый яд!
- Ядовитое действие метанола основано на поражении нервной и сосудистой системы. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению, наступает паралич зрения и поражения сетчатки глаз. Доза в 30 мл и более вызывает СМЕРТЬ!
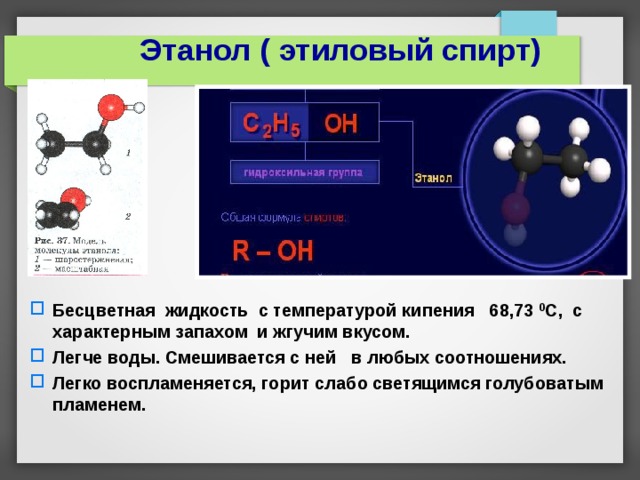
Этанол ( этиловый спирт)
- Бесцветная жидкость с температурой кипения 68,73 0 С, с характерным запахом и жгучим вкусом.
- Легче воды. Смешивается с ней в любых соотношениях.
- Легко воспламеняется, горит слабо светящимся голубоватым пламенем.

Применение этанола
1. производство уксусной кислоты;
2. косметика и парфюмерия;
3. медицинские препараты;
4. лекарственные средства;
5. производство сложных эфиров;
6. производство лаков;
7,8 производство синтетических каучуков

Тема урока:
Химические свойства и получение насыщенных одноатомных спиртов
Цели урока:
Рассмотреть химические свойства и способы получения насыщенных одноатомных спиртов. Развивать умения составлять и анализировать уравнения химических реакций спиртов:
- Со щелочными металлами
- Органическими и минеральными кислотами
- Галогеноводородами
- Внутримолекулярной дегидратации
- Окисление полное и частичное

Укажите ,формулы каких классов веществ приведены в следующем перечне
2
2

Дайте название следующим соединениям, укажите
к какой группе относятся эти спирты

Химические свойства спиртов
- Взаимодействие со щелочными металлами
(замещение атома водорода в гидроксиле металлом)
2
Этилат натрия

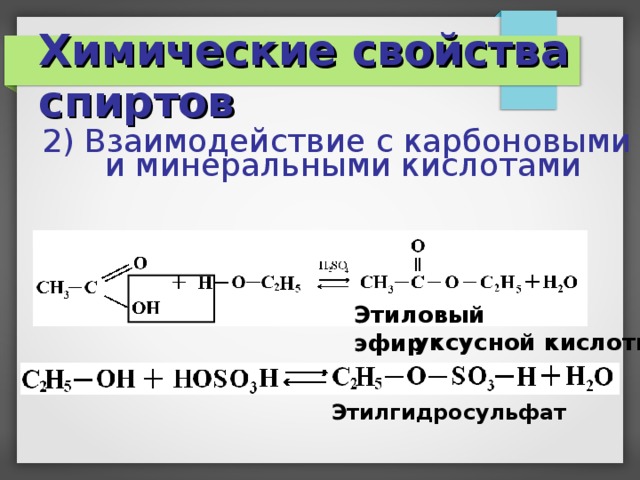
Химические свойства спиртов
2) Взаимодействие с карбоновыми
и минеральными кислотами
Этиловый эфир
уксусной кислоты
Этилгидросульфат
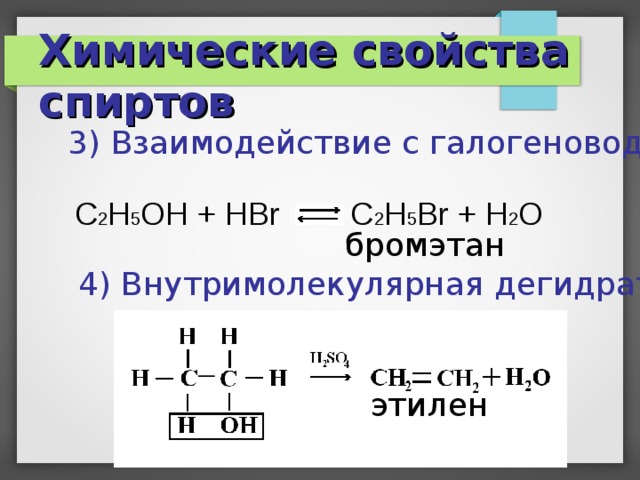
Химические свойства спиртов
3) Взаимодействие с галогеноводородами
C 2 H 5 OH + HBr C 2 H 5 Br + H 2 O
бромэтан
4) Внутримолекулярная дегидратация
этилен
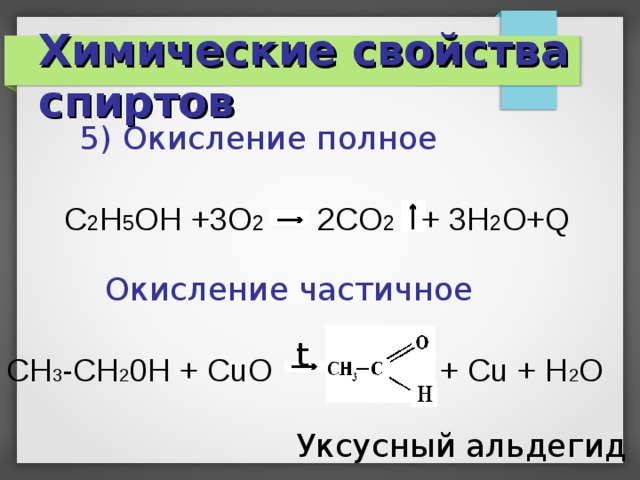
Химические свойства спиртов
5) Окисление полное
C 2 H 5 OH +3O 2 2CO 2 + 3H 2 O+Q
Окисление частичное
t
CH 3 -CH 2 0H + CuO + Cu + H 2 O
Уксусный альдегид

![Щелочной гидролиз галогеналканов. С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI Гидратация алкенов. СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН Гидрирование альдегидов и кетонов. СН 3 -СОН + Н 2 С 2 Н 5 ОН Окисление алкенов . СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН Специфические способы получения спиртов. Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора. СО+ 2Н 2 СН 3 -ОН Брожение глюкозы. С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2](https://fsd.multiurok.ru/html/2018/01/23/s_5a665b17e2de9/img31.jpg)
- Щелочной гидролиз галогеналканов.
С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI
СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН
- Гидрирование альдегидов и кетонов.
СН 3 -СОН + Н 2 С 2 Н 5 ОН
СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН
- Специфические способы получения спиртов.
Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора.
СО+ 2Н 2 СН 3 -ОН
Брожение глюкозы.
С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2
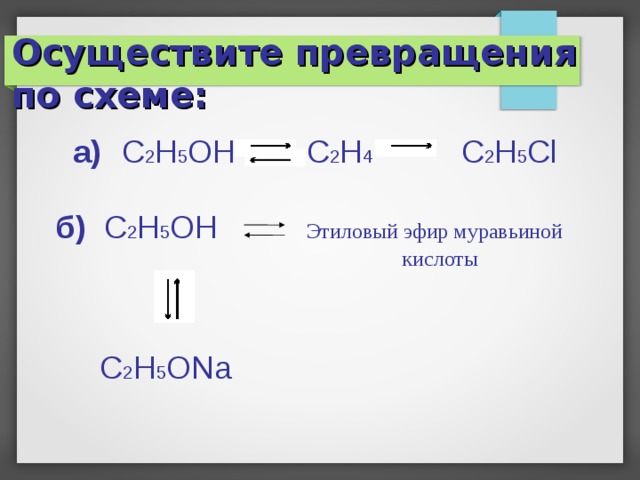
Осуществите превращения по схеме:
а) C 2 H 5 OH C 2 H 4 C 2 H 5 Cl
б) C 2 H 5 OH Этиловый эфир муравьиной
кислоты
C 2 H 5 ONa






































![Щелочной гидролиз галогеналканов. С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI Гидратация алкенов. СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН Гидрирование альдегидов и кетонов. СН 3 -СОН + Н 2 С 2 Н 5 ОН Окисление алкенов . СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН Специфические способы получения спиртов. Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора. СО+ 2Н 2 СН 3 -ОН Брожение глюкозы. С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2](https://fsd.multiurok.ru/html/2018/01/23/s_5a665b17e2de9/img31.jpg)











