| 2.Актуализация знаний
3.Освоение нового материала.
4.Первичное закрепление.
5.Рефлексия.
6.Домашнее задание. | Ребята, вы завершили изучение классов неорганических соединений. Предлагаю повторить, выполнив задание : Формулы перечисленных ниже веществ: SO2 ,Cu, HCl, Cu(OH)2, S, Na2SO4, CuO, CuCl2, H2SO4,СuSO4, запишите в одну из колонок таблицы | оксиды | основания | кислоты | соли | |
|
|
|
| Выделите соединение, используемое, как фунгицид.
2.Составьте генетический ряд металла
Беседа с учащимися. -Что называют степенью окисления? -Вспомните правила определения степени окисления? -Какую степень окисления проявляет кислород? - Какие элементы проявляют постоянную степень окисления?
1.Расставьте степени окисления для каждого элемента веществ в ряду. 2.Осуществите практически первых два перехода. 3.Составьте уравнение и укажите тип реакции.
-Как изменилась степень окисления элементов в первом и во втором уравнении?
- все реакции можно разделить на два типа. К первому относятся реакции, протекающие с изменением степеней окисления, реакции без изменения степени окисления. -Ребята, подумайте, как будет звучать тема урока. . Таким образом, ребята вы познакомитесь ещё с одним признаком по которому классифицируют химические реакции. - Какие же процессы протекают в реакции?
Сейчас вам предстоит провести лабораторный опыт. Для этого у вас на партах инструктивная карта. Читайте, выполняйте, соблюдая ТБ. Опыт: взаимодействие железа с сульфатом меди.  Fe0 +Cu+2 SO4 Fe+2 SO4+Cu0 Fe0 +Cu+2 SO4 Fe+2 SO4+Cu0
-Как изменилась ст.ок. железа? -Значит, оно отдало 2 электрона. Давайте запишем этот процесс, обозначив отдачу электронов знаком минус:  Fe0-2e Fe+2 «отдал-окислился» Fe0-2e Fe+2 «отдал-окислился»
- Как называют атомы ,отдавшие электроны?
-Ребята посмотрите записи и определите название данного процесса. -правильно процесс потери электронов называется окислением. Выполним те же действия для меди:  Cu+2 +2e Cu0 окислитель. восстановление.«взял-восстановился» Cu+2 +2e Cu0 окислитель. восстановление.«взял-восстановился»
Процессы протекающие в реакциях: окисления, восстановления.
Задание на первичное закрепление: в данных переходах определите число электронов, теряемых или приобретаемых элементом, укажите процесс: а)Mn+7 Mn+2 б)S-2 S+4 в) N20 2N-3   
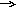    Задание №2 работа самостоятельно. Указать процесс: а)О-1 О-2 б)Р0 Р+5 в) 2F-1 F20 г)S+6 S-2 Задание №2 работа самостоятельно. Указать процесс: а)О-1 О-2 б)Р0 Р+5 в) 2F-1 F20 г)S+6 S-2
     Задание №3 по данным схемам превращения веществ составьте схему перехода электронов для элементов, у которых изменяются степени окисления. а)H2SO4 SO2 б)KNO3 KNO2 в)CH4 CO2 г)KNO3 O2 d)HCl Cl2 Задание №3 по данным схемам превращения веществ составьте схему перехода электронов для элементов, у которых изменяются степени окисления. а)H2SO4 SO2 б)KNO3 KNO2 в)CH4 CO2 г)KNO3 O2 d)HCl Cl2
Ребята подведем итоги. Окружающий нас мир – это множество химических реакций, протекающих ежесекундно и в основном окислительно-восстановительные. Ребята проанализируйте тему занятия и ответьте на вопросы: Я-узнал, я-научился, мне было сложно.
П.43 упр1,3.
| Выполняют задание. | оксиды | основания | кислоты | соли | | SO2 CuO | Cu(OH)2 | HCl H2SO4 | Na2SO4, CuCl2 | Осуществляют взаимопроверку.
   Составляют и записывают: Cu CuO CuCl2 Cu(OH)2 Составляют и записывают: Cu CuO CuCl2 Cu(OH)2
    Отвечают устно. - Cтепень окисления-это условный заряд атомов химических соединении, если предположить, что оно состоит из ионов. – Кислород с.о. -2. – Металлы главных подгрупп I,II,III групп, фтор. Cu0 Cu+2 O-2 Cu+2 SO4 Cu+2 (O-2 H+ )2 (учащийся у доски) Отвечают устно. - Cтепень окисления-это условный заряд атомов химических соединении, если предположить, что оно состоит из ионов. – Кислород с.о. -2. – Металлы главных подгрупп I,II,III групп, фтор. Cu0 Cu+2 O-2 Cu+2 SO4 Cu+2 (O-2 H+ )2 (учащийся у доски)
Выполняют лабораторный опыт. Отмечают признаки реакций. Составляют уравнения.  2Cu+O2 2CuO (соедин.) 2Cu+O2 2CuO (соедин.)
 CuO+H2SO4 CuSO4 +H2O(обмен) CuO+H2SO4 CuSO4 +H2O(обмен)
Выполняют задания. Сравнивают и приходят к выводу, что в первом уравнении произошло изменение степеней окисления, а во втором нет.
Записывают тему урока, формулируют цели.
Записывают определение ОВР в тетради. Предполагают, что возможны два процесса: восстановление и окисление. Выполняют опыт, составляют уравнения реакции ,указывают степень окисления железа и меди. 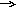 Fe0 +Cu+2 SO4 Fe+2SO4+Cu0 Fe0 +Cu+2 SO4 Fe+2SO4+Cu0
Отвечают : железо из нулевой с.о. перешело в с.о. +2. Записывают процесс, обозначив отдачу знаком минус.  Fe0-2e Fe+2 Fe0-2e Fe+2
Отвечают: восстановители. Делают вывод, что железо восстановитель. Определяют процесс. Записывают рядом с ионом железа  Fe0-2e Fe+2 восстановитель, окисляется Fe0-2e Fe+2 восстановитель, окисляется
Записывают процесс восстановления, обозначив принятие электронов знаком плюс. Формулируют определения: восстановитель, окислитель. Наиболее полный и дополненный учителем ответ записывают в тетрадь. Рассуждают : в исходном состоянии марганец в степени окисления+7, а в конечном в ст.ок. +2. следовательно в ходе процесса марганец получил 5 электронов, марганец-окислитель, процесс восстановления. Ответ записывают в виде схемы:  Mn+7 +5е Mn+2 окислитель, восстановление. Mn+7 +5е Mn+2 окислитель, восстановление.
    Составляют схемы:а)О-1+1е О-2 ок-тель, в-ние б)Р0 -5е Р+5 в-тель, ок-ние в) 2F-1 F20 в-тель, ок-ние г)S+6 S-2 ок-тель, в-ние. Работают в паре. Обсуждают результаты. Выполняют работу на карточках, сдают в конце урока. Составляют схемы:а)О-1+1е О-2 ок-тель, в-ние б)Р0 -5е Р+5 в-тель, ок-ние в) 2F-1 F20 в-тель, ок-ние г)S+6 S-2 ок-тель, в-ние. Работают в паре. Обсуждают результаты. Выполняют работу на карточках, сдают в конце урока.
Пункт а,б задания №3 обсуждается выполнение в группе. Пункт в,г,д самостоятельное выполнение.
Делают выводы: окислительно-восстановительные реакции- единство двух процессов: окисления и восстановления. Обсуждают: что узнали, чему научились.
|






 Fe0 +Cu+2 SO4 Fe+2 SO4+Cu0
Fe0 +Cu+2 SO4 Fe+2 SO4+Cu0  Fe0-2e Fe+2 «отдал-окислился»
Fe0-2e Fe+2 «отдал-окислился» Cu+2 +2e Cu0 окислитель. восстановление.«взял-восстановился»
Cu+2 +2e Cu0 окислитель. восстановление.«взял-восстановился»

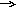


 Задание №3 по данным схемам превращения веществ составьте схему перехода электронов для элементов, у которых изменяются степени окисления. а)H2SO4 SO2 б)KNO3 KNO2 в)CH4 CO2 г)KNO3 O2 d)HCl Cl2
Задание №3 по данным схемам превращения веществ составьте схему перехода электронов для элементов, у которых изменяются степени окисления. а)H2SO4 SO2 б)KNO3 KNO2 в)CH4 CO2 г)KNO3 O2 d)HCl Cl2

 Составляют и записывают: Cu CuO CuCl2 Cu(OH)2
Составляют и записывают: Cu CuO CuCl2 Cu(OH)2 
 Отвечают устно. - Cтепень окисления-это условный заряд атомов химических соединении, если предположить, что оно состоит из ионов. – Кислород с.о. -2. – Металлы главных подгрупп I,II,III групп, фтор. Cu0 Cu+2 O-2 Cu+2 SO4 Cu+2 (O-2 H+ )2 (учащийся у доски)
Отвечают устно. - Cтепень окисления-это условный заряд атомов химических соединении, если предположить, что оно состоит из ионов. – Кислород с.о. -2. – Металлы главных подгрупп I,II,III групп, фтор. Cu0 Cu+2 O-2 Cu+2 SO4 Cu+2 (O-2 H+ )2 (учащийся у доски)

















