| Тип урока | Комбинированный урок |
| Цели деятельности учителя | Сформировать представление об алюминии и его соединениях. Способствовать усвоению материала о положении металла в периодической системе Д.И. Менделеева; особенностях строения атома металла; физических свойствах металлов, основанных на его строении; химических свойствах , роли алюминия в жизни человека |
| Образовательные
ресурсы | Г.Е. Рудзитис, Ф.Г. Фельдман «Химия 9 класс», оборудование и реактивы для проведения ученического эксперимента, раздаточный материал |
| методы и формы
обучения | Методы: словесно-наглядно-практические Формы: беседа, лабораторная работа, работа с карточками |
| Формы контроля | Устный (вопросы), самоконтроль (по образцу), взаимоконтроль. |
| Планируемые результаты |
| Предметные | Метапредметные УУД | Личностные УУД |
| Научатся: устанавливать зависимость физических свойств алюминия от положения в ПСХЭ, писать уравнения реакций Получат возможность: расширить знания об алюминии и использовать новые знания в практической деятельности и повседневной жизни. | Регулятивные: составлять план и последовательность действий; вносить коррективы и дополнения в способы своих действий в случае расхождения с эталоном реального действия и его продукта. Познавательные: осуществлять поиск и выделение необходимой информации; проводить анализ способов решения задачи с точки зрения их рациональности и экономичности. Коммуникативные: учиться управлять поведением партнёра: убеждать его, контролировать, корректировать и оценивать действия. | Формировать: ответственное отношение к учению, готовности и способности к саморазвитию и самообразованию на основе мотивации к обучению; коммуникативную компетентность в образовательной деятельности
|
| ОРГАНИЗАЦИОННАЯ СТРУКТУРА УРОКА |
| Этапы урока. Время (мин) | Обучающие
и развивающие компоненты,
задания
и упражнения | Деятельность учителя | Деятельность учащихся по достижению планируемых результатов | Показатели достижения результата |
| 1. Организационный этап (2 мин) Цель: подготовка учащихся к включению в учебную деятельность на личностно значимом уровне. Задачи: - проверить готовность к уроку; - создать условия для мотивации учащихся к учебной деятельности, позитивному настрою на урок |
| Приветствует школьников, организует рабочую обстановку | Приветствуют учителя. Выполняют самооценку готовности к уроку | - полная готовность класса и оборудования к уроку; - быстрое включение учащихся в деловой ритм; - кратковременность организационного момента; - организация внимания всех учащихся |
| 2.Проверка домашнего задания Цель: установление правильности и осознанности выполнения домашнего задания, выявление пробелов и их коррекция. Задачи: - проверить правильность выполнения домашнего задания; - выявить пробелы и наметить пути их устранения | Тестовое задание (Приложение1) | Проводит проверку выполнения домашнего задания.
. | Отвечают на вопрос теста.
Осуществляют взаимопроверку.
| - проверены и скорректированы опорные знания учащихся |
| 3. Постановка цели и задач урока. Мотивация учебной деятельности учащихся Цель: создание условий, в результате которых учащиеся самостоятельно выдвигают цель и формулируют задачи урока. Задачи: - создать условия для мотивации учебной деятельности учащихся; - подвести к формулировке цели (темы) и постановке задач урока (создать условия для самостоятельного целеполагания) | Просмотр презентации | 1.Соединения этого металла встречаются не только на Земле, но еще на Луне и Марсе. 2.Он составляет 8.80% массы земной коры, следовательно, он является третьим по распространенности на нашей планете элементом. 3.В теле взрослого человека присутствует до 140 мг данного металла. 4.По приказу Наполеона III были изготовлены столовые приборы из этого металла, которые подавались на торжественных обедах императору и самым почётным гостям. Другие гости при этом пользовались приборами из традиционных драгоценных металлов — золота и серебра. 5.В 1860-е годы каждая парижская модница непременно должна была иметь в своем наряде хотя бы одно украшение из этого металла, ценившегося выше серебра и золота.
Как вы думаете, о каком веществе пойдёт сегодня речь? Какова цель сегодняшнего урока? | Отвечают на вопросы. Приходят к выводу, что на уроке будут знакомиться с темой «Алюминий и его соединения». Записывают тему урока в тетрадь. | - сформулирована совместно с учащимися цель урока, определены задачи. |
| 4. Первичное усвоение новых знаний Цель: организация усвоения учащимися нового знания в результате самостоятельной и парной работы. Задачи: - создать условия для освоения учащимися нового материала; - обеспечить и организовать исследовательскую деятельность учащихся в группах | Показ слайда
Постановка проблемного вопроса
(Приложение 2) | Название алюминий происходит от латинского слова «алюмен» - квасцы, сульфат калия – алюминия KAl(SO4)2. Эту соль люди начали использовать задолго до нашей эры. Сначала в качестве протравы для окрашивания тканей, потом в медицинских целях в качестве кровоостанавливающего средства. Описание этого вещества есть и у Плиния Старшего, и у Геродота – самых авторитетных древних историков. Среди русских химиков XIX века бытовало название «глиноземий» и даже «Глиний», которые потом были благополучно забыты.
Применения изделий из алюминия и его сплавов хранит много интересных историй и фактов. Так в повести Н. Г. Чернышевского «Что делать?» (1862-1863) один из главных героев в своём письме другому пишет, что ему довелось увидеть слиток металла, «который называется алюминиум», и что, учитывая свойства алюминия, он уверен, что за алюминием большое будущее (во времена Н. Г. Чернышевского алюминий ещё только начинали открывать). Как вы считаете «Алюминий – это металл будущего или прошлого»? Дальнейшее знакомство с Алюминием мы продолжим в группах. Вы делитесь в группы по 5 человек. (Таким образом получается 6 групп, задания совпадают у 1и4, 2 и 5, 3 и 6) Напоминает правила ТБ при работе с кислотами и щелочами, а так же при нагревании веществ.
|
Делают предположения
Делятся по группам
Внимательно слушают, выполняют работу в группах | - организована и методически обеспечена групповая работа учащихся по усвоению новых знаний.
|
|
Демонстрационный опыт
Работа в паре с раздаточным материалом, заполнение таблицы (Приложение 3)
|
Работа выполняется – 7 минут
Организует выступление групп, обсуждение вопросов, оформление кластеров
Демонстрирует опыты с концентрированной серной, соляной и азотной кислотами
Организует работу в парах по изучению физических свойств алюминия. Используя, коллекцию металлов и справочный материал, заполните таблицу. Итак, каковы физические свойства металлов? От чего зависят физические свойства алюминия Показывает видеоролик производство алюминия. Организует обсуждение просмотренного. |
Группы выступают поочередно, представляют свои результаты, делают выводы. Оформляют кластеры.
Выполняют работу с раздаточным материалом и записывают результаты в таблицу.
Отвечают на вопросы
Внимательно смотрят
|
| 5. Первичная проверка понимания Цель: установление правильности и осознанности усвоения нового знания, выявление причин ошибок и их исправление. Задачи: - организовать фронтальную беседу для решения проблемного вопроса; - выявить типичные ошибки и провести их коррекцию | Проблемный вопрос
| «Алюминий – это металл будущего или прошлого»?
| Отвечают на вопросы, используя в качестве опоры записи в тетради.
| - организована работа по закреплению материала с помощью проблемного вопроса.
|
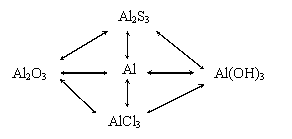
| 6. Первичное закрепление Цель: организация усвоения новых знаний и способов действий на уровне применения в измененной ситуации. Задачи: - организовать самостоятельное выполнение каждым учащимся заданий на применение новых знаний, способа действий; - установить правильность и осознанность усвоения учебного материала, выявление пробелов, неверных представлений, их коррекция; - организовать самопроверку учащимися своих решений | «Осуществить превращения» (Приложение 4)
| Организует работу с раздаточным материалом (Приложение 4).
Проверку осуществляет с использованием интерактивной доски или презентации
| Работают с раздаточным материалом, записывая в тетради ответы. Поощряются хорошей оценкой первые 3-4 ученика, первыми правильно выполнивших задания. | - использованы приобретенные знания в практической деятельности; - решены типовые задания на новый способ действий корректировка ошибок; - самостоятельное выполнение учащимися заданий
|
| 7. Информация о домашнем задании, инструктаж по его выполнению Цель: обеспечение понимания учащимися цели, содержания и способов выполнения домашнего задания. Задачи: - закрепить изученный учебный материал; - сообщить объем и содержание домашнего задания. |
| § 42 стр. 131 вопр. 11 Сообщение или презентация «История Открытия алюминия», «Биологическая роль алюминия» Консультирует учащихся по выполнению домашнего задания. Отвечает на вопросы учеников
| Обсуждают выполнение домашнего задания, задают вопросы учителю | - сообщен объем и содержание домашнего задания с фиксацией в дневнике; - произведен разбор по выполнению домашнего задания, указаны трудности с которыми могут столкнуться учащиеся; - объявлены критерии оценки домашнего задания.
|
| 8. Рефлексия (подведение итогов занятия) Цель: подведение итога урока, организация рефлексии, оценка результатов деятельности учащихся. Задачи: - установить соответствие между поставленной целью и результатом урока; - зафиксировать новое содержание, изученное на уроке; - организовать рефлексию и самооценку обучающихся |
| Проводит рефлексию: «Сегодня я узнал…» «Я почувствовал…» «Было интересно…» «Я получил…» «Я выполнял задание…» «Я научился…» «Я понял, что…» «У меня получилось…» «Теперь я могу…» «Я смог…» «Меня удивило…» «В жизни мне будет полезно…» Озвучивает отметки за урок, поощряет словесно активных ребят на уроке. | Отвечают на вопросы учителя. Проводят самооценку. Высказывают свое личное мнение по актуальности изученной темы, совместной работе с одноклассниками | - подведен итог урока; - проведена рефлексия учебной деятельности в конце или в течение всего урока; - использованы приемы рефлексии; - проведен анализ достижения цели урока; - получена достоверная информация о достижении учащимися планируемых результатов;
|