Содержание.
Введение. Основная часть
2.1. Внутренняя энергия.
2.2. Внутренняя энергия и механическая работа. Первое начало термодинамики.
2.3. Способы изменения внутренней энергии. Теплопередача
III. Заключение.
Список использованной литературы.
Введение.
Все расчеты в термодинамике основываются на использовании функций состояния, называемых термодинамическими функциями. Каждому набору независимых параметров соответствует своя термодинамическая функция. Изменения функций, происходящие в ходе каких-либо процессов, определяют либо совершаемую системой работу, либо получаемую системой теплоту.
Термодинамические функции являются функциями состояния. Поэтому приращение любой из функции равно полному дифференциалу функции, которой она выражается. Полный дифференциал функции f(x,у) переменных х и у определяется выражением
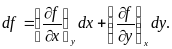 (1)
(1)
Поэтому, если в ходе преобразований мы получим для приращёния некоторой величины f выражение вида
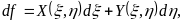 (2)
(2)
можно утверждать, что эта величина является функцией параметров 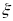 и
и , причем функции
, причем функции 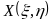 и
и  представляют собой частные производные функции
представляют собой частные производные функции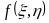 :
:
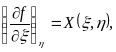
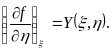 (3)
(3)
С одним из термодинамических потенциалов мы уже хорошо знакомы. Это внутренняя энергия системы.
Внутренняя энергия — важнейшее условие существования и характеристика всех тел живой и неживой природы. Для того чтобы определить её значение в организации жизни на нашей планете, вспомним основные физические понятия термодинамики.
Макроскопические тела состоят из движущихся и взаимодействующих частиц: молекул, атомов, ионов. В свою очередь, атомы и ядра атомов тоже состоят из движущихся и взаимодействующих частиц.
Как известно, движущиеся тела обладают кинетической энергией, следовательно, частицы (молекулы, атомы, ионы), из которых состоит вещество, тоже обладают кинетической энергией.
Выражение первого начала для обратимого процесса можно представить в виде
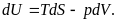 (5)
(5)
Сравнение с (2) показывает, что в качестве так называемых естественных переменных для потенциала U выступают переменные S и V. Из (3) следует, что

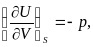 (6)
(6)
Из соотношения

следует, что в случае, когда тело не обменивается теплотой с внешней средой, совершаемая им работа равна

или в интегральной форме
 (нет теплообмена).
(нет теплообмена).
Таким образом, при отсутствии теплообмена с внешней средой работа равна убыли внутренней энергии тела.
При постоянном объеме
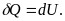
Следовательно, теплоемкость при постоянном объеме равна
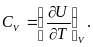 (7)
(7)
II. Основная часть.
2.1.Внутренняя энергия.
Внутреннюю энергию тела составляют кинетическая энергия всех его молекул и потенциальная энергия их взаимодействия.
Внутренняя энергия входит в баланс энергетических преобразований в природе. После открытия внутренней энергии был сформулирован закон сохранения и превращения энергии.
Рассмотрим взаимное преобразование механической и внутренней энергий.
 Пусть на свинцовой плите лежит свинцовая пуля. Поднимем его вверх и отпустим. Когда мы подняли шар, то предоставили ей потенциальной энергии. При падении шара энергия уменьшается, потому что пуля опускается ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия пули. Происходит превращение потенциальной энергии пули в кинетическую. Но вот шар ударился о свинцовую плиту и остановилась. И кинетическая и потенциальная энергии ее относительно плиты стали равны нулю. Рассматривая шар и плиту после удара, мы видим, что их состояние изменилось: пуля немного сплющилась, а на плите образовалась небольшая вмятина; измерив температуру, мы замечаем. что тела нагрелись.
Пусть на свинцовой плите лежит свинцовая пуля. Поднимем его вверх и отпустим. Когда мы подняли шар, то предоставили ей потенциальной энергии. При падении шара энергия уменьшается, потому что пуля опускается ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия пули. Происходит превращение потенциальной энергии пули в кинетическую. Но вот шар ударился о свинцовую плиту и остановилась. И кинетическая и потенциальная энергии ее относительно плиты стали равны нулю. Рассматривая шар и плиту после удара, мы видим, что их состояние изменилось: пуля немного сплющилась, а на плите образовалась небольшая вмятина; измерив температуру, мы замечаем. что тела нагрелись.
Нагрев означает увеличение средней кинетической энергии молекул тела. При деформации изменяется взаимное расположение частиц тела, поэтому меняется их потенциальная энергия. Таким образом, можно утверждать, что в результате удара пули о плиту происходит преобразование механической энергии, которую имела в начале опыта шар, на внутреннюю энергию тела.
2.2. Внутренняя энергия и механическая работа. Первое начало термодинамики
При протекании термодинамического процесса тела обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами.
1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел, либо лучистым переносом внутренней энергии излучающих тел путем электромагнитных волн. При этом энергия передается от более нагретого тела к менее нагретому.
Количество энергии, переданной первым способом от одного тела к другому, называется количеством теплоты - Q, а способ - передача энергии в форме теплоты.
2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передача энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой - L, а способ- передача энергии в форме работы.
Количество энергии, полученной телом в форме работы, называется работой, совершенной над телом, а отданную энергию - затраченной телом работой. энергия работа термодинамика энтропия карно
Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера термодинамического процесса. В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле (или системе тел). Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии молекул.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул.
Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P,T), U = f (v,T), U= f (P,v). Так как каждому состоянию рабочего тела (системы) соответствует вполне определенное значение параметров состояния, то для каждого состояния рабочего тела (например, газа) будет характерна своя однозначная, вполне определенная величина внутренней энергии U. То есть U является функцией состояния газа. И разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависеть от пути перехода от первого состояния во второе. Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов.
 Этот закон является законом сохранения и превращения энергии:
Этот закон является законом сохранения и превращения энергии:
"энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах".
Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии термодинамической системы:
"теплота, подведенная к системе, расходуется на изменение энергии системы и совершение работы". Уравнение первого закона термодинамики имеет следующий вид:
Q = (U2 - U1) + L, (1)
где Q - количество теплоты, подведенной (отведенной) к системе; L - работа, совершенная системой (над системой); (U2 - U1) - изменение внутренней энергии в данном процессе. Если подводится бесконечно малое количество теплоты, то
?Q=dU+?L (2).
Это запись первого начала в дифференциальной форме, в то время как формулу (1) называют записью первого начала в интегральной форме. В таком виде первое начало используется при анализе так называемых равновесных процессов, когда давление внутри термодинамической системы и во внешней среде одинаковы. Единственным видом работы в таком процессе является работа расширения
? L = P·dV. (3)
Она имеет ещё несколько названий: механическая работа, работа изменения объёма. Примечание: в формуле (3) используются два обозначения дифференциала: а) d и ?. Первый считается полным, второй неполным. Первый используется только для обозначения бесконечно малых изменений функций состояния. К ним относятся внутренняя энергия, энтальпия, энтропия. Их значения определяются только состоянием системы, и не зависят от того, какие термодинамические процессы происходили при переходе системы из начального равновесного состояние в конечное, т.е U = U2 - U1= ?U. Неполный дифференциал используется для обозначения бесконечно малых значений величин (работы, теплоты), которые зависят от процесса перехода системы из одного состояния в другое. Например ?? L = ·dV; L= ·dV. Работу можно найти, если известна зависимость Р от V. А для этого надо знать, какой термодинамический процесс при этом совершила система. Если:
Q 0 - теплота подводится к системе; Q
L 0 -работа совершается системой; L
Для единицы массы вещества уравнение первого закона термодинамики имеет вид:
q = Q /m = (u2- u1) + l (4)
Здесь l = L/m, удельное значение работы и u=U/m удельное значение внутренней энергии. Первый закон (начало) термодинамики указывает, что тепло Q, полученное термодинамической системой извне, идёт на увеличение его внутренней энергии и на совершение работы против сил внешнего давления (механической работ, работы изменения объёма). Двигатель, постоянно производящий работу и не потребляющий никакой энергии, называется «вечным двигателем I-го рода».
Из этого можно высказать следующее определение первого закона термодинамики: "вечный двигатель первого рода невозможен".
2.3. Способы изменения внутренней энергии. Теплопередача
Внутреннюю энергию макроскопической системы можно изменить в процессе совершения работы или путём теплопередачи. 
Если взять монету и потереть её о поверхность стола, то через некоторое время можно ощутить, что монета нагрелась, следовательно, выросла её внутренняя энергия. На ощупь можно определить повышение температуры гвоздя, забиваемого молотком. В этом случае механическая энергия молотка превращается во внутреннюю энергию гвоздя и молотка.
Можно наблюдать уменьшение внутренней энергии системы, когда она сама совершает работу. Если на дно толстостенной банки налить немного воды и закрыть банку пробкой, а затем накачать в неё воздух, то при некотором давлении пробка из банки вылетит. В банке при этом образуется туман, который хорошо виден. Пробка вылетит под действием избыточного давления воздуха в банке. При этом воздух совершил механическую работу за счёт своей внутренней энергии. Об уменьшении внутренней энергии свидетельствуют понижение температуры воздуха в банке и, как следствие этого, образование тумана.
Внутреннюю энергию можно изменить, не совершая работу. Например, внутренняя энергия воздуха в комнате и всех предметов, находящихся в ней, будет увеличиваться, если при закрытых окнах и дверях включить батареи центрального отопления или затопить печь. Если опустить в горячую воду ложку, то температура ложки повысится, а воды понизится. В этом случае изменение внутренней энергии макроскопических тел происходит без совершения работы в процессе теплопередачи (теплообмена).
Теплопередачей называется способ изменения внутренней энергии тела, при котором происходит передача энергии от одной части тела к другой или от одного тела к другому без совершения работы.
При теплопередаче не происходит превращения энергии из одной формы в другую, как при совершении работы. Этот процесс характеризуется передачей внутренней энергии от более нагретого тела к менее нагретому. Существует три вида теплопередачи: теплопроводность, конвекция и излучение.
Заключение.
Внутренней энергией называют сумму кинетической энергии движения составляющих его частиц (молекул, атомов, ионов) и потенциальной энергии их взаимодействия
Единицей измерения внутренней энергии является джоуль (1 Дж).
К внутренней энергии относят и энергию движения и взаимодействия частиц, входящих в состав атомов и ядер вещества, однако в молекулярной физике имеют дело с процессами, которые происходят при не слишком высоких температурах и не связаны с превращением вещества. В этих процессах внутриатомная и внутриядерная энергия не изменяется.
Внутренняя энергия, так же как температура, давление и объём (термодинамические параметры), характеризует состояние системы. При изменении состояния тела изменяется и значение внутренней энергии.
Как известно, кинетическая энергия тела прямо пропорциональна квадрату его скорости. Поскольку молекулы имеют разные скорости и, следовательно, разные кинетические энергии, то их совокупность характеризуется средней кинетической энергией, которая прямо пропорциональна среднему квадрату скорости движения молекул:
Ėk = m0v̇2 / 2. Материал с сайта http://doklad-referat.ru
Так как температура тела прямо пропорциональна средней кинетической энергии составляющих его частиц, то внутренняя энергия тела зависит от его температуры и об изменении внутренней энергии можно судить по изменению температуры тела.
Внутренняя энергия тела зависит и от его агрегатного состояния. Так, она больше у стоградусного пара, чем у воды такой же массы при той же температуре. Это объясняется различием потенциальных энергий взаимодействия молекул пара и воды.
Внутренняя энергия зависит и от деформации тела: она больше у деформированного тела, чем у недеформированного.
Следует иметь в виду, что внутренняя энергия тела не зависит от его движения как целого и от его положения в пространстве. Так, значения внутренней энергии у шарика, лежащего на полу и поднятого на некоторую высоту, одинаковы при одинаковых прочих условиях.
Список использованной литературы.
И.В. Савельев. Курс общей физики. книга 3. М.: Физматлит, 1998
Д.В. Сивухин. Общий курс физики. т.II. М.: Наука, 1975
А. К. Кикоин, И.К.Кикоин. Молекулярная физика. М.: Наука, 1976
А.Н. Матвеев. Молекулярная физика. М.: Высшая школа, 1981
Интернет-ресурсы.
Внутренняя энергия, так же как температура, давление и объём (термодинамические параметры), характеризует состояние системы. При изменении состояния тела изменяется и значение внутренней энергии.
Как известно, кинетическая энергия тела прямо пропорциональна квадрату его скорости. Поскольку молекулы имеют разные скорости и, следовательно, разные кинетические энергии, то их совокупность характеризуется средней кинетической энергией, которая прямо пропорциональна среднему квадрату скорости движения молекул:
Ėk = m0v̇2 / 2. Материал с сайта http://doklad-referat.ru
Так как температура тела прямо пропорциональна средней кинетической энергии составляющих его частиц, то внутренняя энергия тела зависит от его температуры и об изменении внутренней энергии можно судить по изменению температуры тела.
Внутренняя энергия тела зависит и от его агрегатного состояния. Так, она больше у стоградусного пара, чем у воды такой же массы при той же температуре. Это объясняется различием потенциальных энергий взаимодействия молекул пара и воды.
Внутренняя энергия зависит и от деформации тела: она больше у деформированного тела, чем у недеформированного.
Следует иметь в виду, что внутренняя энергия тела не зависит от его движения как целого и от его положения в пространстве. Так, значения внутренней энергии у шарика, лежащего на полу и поднятого на некоторую высоту, одинаковы при одинаковых прочих условиях.






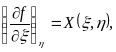
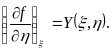 (3)
(3) Пусть на свинцовой плите лежит свинцовая пуля. Поднимем его вверх и отпустим. Когда мы подняли шар, то предоставили ей потенциальной энергии. При падении шара энергия уменьшается, потому что пуля опускается ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия пули. Происходит превращение потенциальной энергии пули в кинетическую. Но вот шар ударился о свинцовую плиту и остановилась. И кинетическая и потенциальная энергии ее относительно плиты стали равны нулю. Рассматривая шар и плиту после удара, мы видим, что их состояние изменилось: пуля немного сплющилась, а на плите образовалась небольшая вмятина; измерив температуру, мы замечаем. что тела нагрелись.
Пусть на свинцовой плите лежит свинцовая пуля. Поднимем его вверх и отпустим. Когда мы подняли шар, то предоставили ей потенциальной энергии. При падении шара энергия уменьшается, потому что пуля опускается ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия пули. Происходит превращение потенциальной энергии пули в кинетическую. Но вот шар ударился о свинцовую плиту и остановилась. И кинетическая и потенциальная энергии ее относительно плиты стали равны нулю. Рассматривая шар и плиту после удара, мы видим, что их состояние изменилось: пуля немного сплющилась, а на плите образовалась небольшая вмятина; измерив температуру, мы замечаем. что тела нагрелись. Этот закон является законом сохранения и превращения энергии:
Этот закон является законом сохранения и превращения энергии:










