

Второе начало термодинамики. Понятие об энтропии.
На основе первого начала термодинамики невозможно установить, в каком направлении и до какого предела будет протекать тот или иной процесс, связанный с превращением энергии, т.е. указывает, какой процесс и в каком направлении может протекать при данных условиях температуры, давления и концентрации без сообщения энергии извне. Также, наряду с необратимыми процессами термодинамика рассматривает обратимые процессы, т.е. такие, которые могут идти как в прямом, так и в обратном направлениях при бесконечно малом изменении действующих на систему сил и без изменения работоспособности системы в обоих направлениях. Вопросы обратимости и необратимости различных физических и химических процессов, а также перехода теплоты в работу и работы в теплоту разрешаются вторым началом термодинамики. В этом и состоит его важное практическое значение. Зная направление перехода энергии, можно при наличии определенного механизма получить полезную работу.

Как и первое начало, оно имеет характер аксиомы, обобщающей эмпирические сведения, т.е. было выведено из практического опыта, накопленного человечеством.
Оно имеет несколько равноценных формулировок, из которых наиболее часто используют следующие:
невозможен самопроизвольный переход энергии (в форме теплоты) от менее нагретого тела к более нагретому (постулат Клаузиуса, 1850);
невозможно создание вечного двигателя второго рода, т. е. машины, способной в течение принципиально неограниченного времени производить работу за счет отбора энергии (в форме теплоты) от некоторого источника без каких-либо других взаимодействий с окружающей средой (Томсон, 1851).
Следует также отметить, что первая формулировка второго начала термодинамики в несколько иной форме была высказана М. В. Ломоносовым еще в 1747 г. в его знаменитом труде «Размышление о причине теплоты и холода».
Исходя из этих формулировок, можно сделать вывод, что в замкнутой системе переход теплоты в работу будет совершаться только при наличии разности температур, т. е. при наличии нагревателя и холодильника, обусловливающих процесс перехода теплоты от тела - более нагретого к более холодному. Причем при постоянной температуре теплота не может самопроизвольно превращаться в работу.
Обе приведенные формулировки второго начала термодинамики не связаны с какими-либо конкретными представлениями о строении материи. Однако, как впервые показал Л. Больцман (1896), содержание второго закона обусловлено особенностями строения, v а именно молекулярной природой вещества. Иными словами, второе начало (в отличие от первого) относится исключительно к системам из большого числа частиц, т.е. таким, поведение которых может быть охарактеризовано статистическими величинами, например температурой и давлением. В связи с этим с точки зрения молекулярно-кинетических представлений второе начало термодинамики можно сформулировать следующим образом: все процессы, происходящие в природе, стремятся перейти самопроизвольно от состояния менее вероятного к состоянию более вероятному.
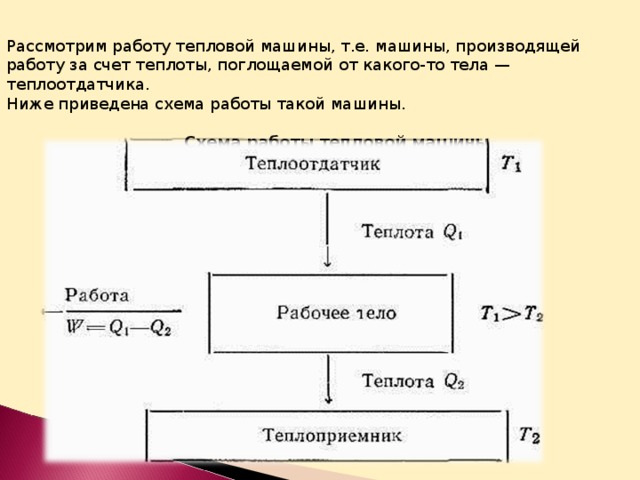
Рассмотрим работу тепловой машины, т.е. машины, производящей работу за счет теплоты, поглощаемой от какого-то тела — теплоотдатчика.
Ниже приведена схема работы такой машины.
Схема работы тепловой машины

Из схемы ясно, что не вся теплота Q 1 , получаемая рабочим телом, превращается в работу, а лишь некоторая ее часть А = Q 1 — Q 2 . Другая часть теплоты Q 2 передается телу с более низкой температурой — теплоприемнику. Таким образом, сущность работы тепловой машины заключается не только в получении теплоты Q 1 от теплоотдатчика и в совершении работы А , но и в передаче некоторого количества теплоты Q 2 теплоприемнику, температура которого ниже, чем температура теплоотдатчика.
Следовательно, теплоту никогда не удается полностью (на сто процентов) превратить в работу. Там, где нет перепада температур, т.е. Т 1 = Т 2 , невозможно превратить теплоту в работу. Если бы это условие не было необходимым, можно было бы использовать для получения полезной работы огромные природные запасы теплоты, заключенные, например, в водах морей и океанов. Однако необходимость иметь для этой цели теплоприемник с более низкой, чем вода в океане, температурой, естественно, сильно ограничивает и технически усложняет подобную возможность.

Чтобы получить математическое выражение второго начала термодинамики, следует более детально рассмотреть действия идеальной тепловой машины. Идеальной тепловой машиной мы называем такую машину, которая работала бы без трения и без потерь теплоты. В ней рабочим телом является идеальный газ. Работа машины основана на принципе обратимого термодинамического цикла, называемого циклом Карно.
Цикл — это круговой процесс. Рассматриваемый цикл состоит из четырех последовательно совершающихся процессов:
1) изотермического расширения;
2) адиабатического расширения;
3) изотермического сжатия;
4) адиабатического сжатия газа.
Все процессы проводятся обратимо, в результате чего газ возвращается в исходное положение.

Пусть в качестве рабочего тела взят 1 моль газа; начальное состояние его характеризуется температурой Т 1 давлением р 1 и объемом V 1 (точка А на рис. 1).
В первом процессе изотермическое расширение газа от объема V 1 до объема V 2 осуществляется при введении его в соприкосновение с теплоотдатчиком, имеющим температуру Т 1 .
Допускаем, что масса теплоотдатчика так велика, что его температура в этом процессе заметно не изменяется. Поскольку внутренняя энергия идеального газа зависит только от температуры, то в данном процессе она остается постоянной, и
V 2
потому согласно уравнению А = RT ln V 1 работа расширения А производится газом целиком за счет поглощения теплоты Q 1 :
V 2
Q 1 = А 1 = RT ln V 1 ( 1 )

На рис . 1 этот процесс представлен отрезком АВ изотермы Т 1 . Прекратив в точке В подачу тепла и полностью изолировав газ от теплообмена с окружающей средой, предоставим ему адиабатически расширяться. Работа А 2 , совершаемая газом при расширении, происходит
Рис. 1 . Цикл Карно целиком за счет уменьшения внутренней энергии, т. е. за счет понижения его температуры.
Пусть последняя достигнет некоторого значения Т 2 . Объем газа в точке С в данных условиях обозначим через V 3 . При небольших изменениях температуры теплоемкость газа практически остается величиной постоянной, поэтому изменение внутренней энергии идеального газа в этих условиях
ΔU = C V (Т 2 – T 1 ). ( 2 )

Работа, произведенная газом в этом процессе, в точности равна убыли внутренней энергии А 2 = — ΔU , откуда
А 2 = C V ( T 1 - T 2 ), ( 3 )
где C V — теплоемкость газа при постоянном объеме.
На рис. 1 этот процесс представлен отрезком ВС адиабаты, конечное состояние — точкой С.
При температуре теплоприемника Т 2 в результате соприкосновения газа с теплоприемником осуществляется изотермическое сжатие газа до объема V 4 , чтобы при последующем адиабатном сжатии газ достиг точно исходной температуры Т 1 . Вся работа А 3 , затрачиваемая на сжатие, переходит в теплоту Q 2 , которая и отводится в холодильник. Следовательно,
V 4
- Q 2 = А 3 = RT 2 ln V 3 ( 4 )
На рис. 1 этот процесс представлен отрезком CD изотермы Т 2 , конечное состояние — точкой D ,
Последний процесс — адиабатное сжатие газа — проведем следующим образом: отъединим газ от теплоприемника и сожмем до объема V \, приведя его этим в исходное состояние.

На рис. 1 этот процесс представлен отрезком CD изотермы Т 2 , конечное состояние — точкой D ,
Последний процесс — адиабатное сжатие газа — проведем следующим образом: отъединим газ от теплоприемника и сожмем до объема V \, приведя его этим в исходное состояние.
В этом процессе внутренняя энергия газа возрастает на величину, равную затраченной работе сжатия:
ΔU = C V ( Т 2 – T 1 ); — А 4 = ΔU,
т. е.
А 4 = C V (Т 2 — Ti ) = — C V ( T 1 - T 2 ). ( 5 )
На рис. 1 этот процесс представлен отрезком адиабаты DA . Поскольку рассмотренный процесс в целом является круговым, внутренняя энергия газа в конечном состоянии равна таковой в начальном состоянии. Общее количество теплоты, полученное газом, равно общему количеству произведенной им работы:
Q 1 — Q 2 = А l + А 2 + А 3 + А 4 . ( 6 )
 Т 2 , то коэффициент полезного действия машин может изменяться в пределах от 0 (при Т 1 = Т 2 ) до 1 (когда Т 2 = 0К.). Однако получить к. п. д. тепловой машины η = 1 невозможно, так как нельзя создать теплоприемник с температурой, равной абсолютному нулю. Поэтому даже в идеальном случае существует предел превращения теплоты в работу. Все эти выводы получены, как уже подчеркивалось, для идеального газа в качестве рабочего тела. Следовательно, коэффициент полезного действия цикла Карно - есть максимальный коэффициент полезного действия тепловых машин, работающих циклами, и невозможно построить такую машину, которая, получив Q джоулей теплоты, превратила бы в работу больше энергии, чем η Q " width="640"
Т 2 , то коэффициент полезного действия машин может изменяться в пределах от 0 (при Т 1 = Т 2 ) до 1 (когда Т 2 = 0К.). Однако получить к. п. д. тепловой машины η = 1 невозможно, так как нельзя создать теплоприемник с температурой, равной абсолютному нулю. Поэтому даже в идеальном случае существует предел превращения теплоты в работу. Все эти выводы получены, как уже подчеркивалось, для идеального газа в качестве рабочего тела. Следовательно, коэффициент полезного действия цикла Карно - есть максимальный коэффициент полезного действия тепловых машин, работающих циклами, и невозможно построить такую машину, которая, получив Q джоулей теплоты, превратила бы в работу больше энергии, чем η Q " width="640"
На основании этого соотношения второму началу термодинамики можно дать еще и такую формулировку: коэффициент полезного действия тепловой машины не зависит от природы и вида тел, участвующих в процессе, а зависит только лишь от разности температур теплообменника (Т 1 ) и теплоприемника (Т 2 ).
Так как Т 1 Т 2 , то коэффициент полезного действия машин может изменяться в пределах от 0 (при Т 1 = Т 2 ) до 1 (когда Т 2 = 0К.). Однако получить к. п. д. тепловой машины η = 1 невозможно, так как нельзя создать теплоприемник с температурой, равной абсолютному нулю. Поэтому даже в идеальном случае существует предел превращения теплоты в работу.
Все эти выводы получены, как уже подчеркивалось, для идеального газа в качестве рабочего тела. Следовательно, коэффициент полезного действия цикла Карно - есть максимальный коэффициент полезного действия тепловых машин, работающих циклами, и невозможно построить такую машину, которая, получив Q джоулей теплоты, превратила бы в работу больше энергии, чем η Q

На основе анализа работы идеальной машины Карно и взаимных превращений различных видов энергии друг в друга можно сделать следующий общий вывод: любая форма, энергии может полностью перейти в теплоту, но теплота преобразуется в другие формы энергии только частично.
Основываясь на этом, термодинамика доказывает, что внутренняя энергия U не может быть полностью превращена в работу при Т = const . Поэтому условно запас внутренней энергии системы можно представить в виде двух слагаемых:
U = F + D , ( 12 )
где F — полезная часть внутренней энергии, которая способна произвести работу и которая по предложению Гельмгольца названа свободной энергией; D — непроизводительная часть, так называемая связанная энергия, которая ни при каких условиях не может быть превращена в полезную работу и которая способна переходить только в теплоту и рассеиваться.

Свободная энергия в любой системе заключена в виде потенциальной энергии. По мере совершения системой работы ее энергия убывает . Чем больше система содержит свободной энергии, тем большую работу она сможет совершить. Так, более разреженный газ содержит меньше свободной энергии и больше связанной, чем сжатый газ при той же температуре. Следовательно, сжатый газ способен совершить больше полезной работы.
Величина непроизводительной, т.е. «обесцененной», части энергии D тем больше, чем меньше разность температур в системе. Мерой такого «обесценения» энергии является термодинамическая функция, зависящая от состояния системы и названная Клаузиу с ом энтропией (греческое — обращать внутрь). Эта функция обозначается в термодинамике буквой S .

Остановимся несколько подробнее на ее характеристике. Из анализа цикла Карно коэффициент полезного действия
Q 1 – Q 2 T 1 – T 2
η = Q 1 = T 1
Откуда
Q 2 T 2 Q 1 Q 2 Q 1 Q 2
1 - Q 1 = 1 - T 1 , T 1 = T 2 и T 1 = T 2 = 0 ( 13 )
Если любой цикл произвольного вида разбить бесконечно большим числом адиабат и изотерм на множество i элементарных циклов Карно, отвечающих бесконечно малым количествам теплоты δQ , принимаемым и отдаваемым рабочим телом, то для каждого из них можно записать:
δQ 1 δQ 2 = 0 ; δQ́ 1 δQ́ 1 = 0 ; δQ˝ 1 δQ˝ 1 = 0 ;
T 2 T 1 T 2 T 1 T 2 T 1
где δ Q / T называется приведенной теплотой. Алгебраическая сумма приведенных теплот цикла равна нулю, т. е.
δQi
Σ T = 0. ( 14 )
i

В пределе ( i ) эта сумма переходит в интеграл ∮ δ Q / T (интеграл, взятый по замкнутому контуру). В теории интегралов доказывается, что если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение является полным дифференциалом некоторой функции от параметров, определяющих состояние системы. Можно записать
δ Q
dS = T (15)
где S — функция состояния системы S = f ( p , V , T , ...). Именно эта функция ( S ), введенная Клаузиусом (1850), и была названа энтропией.

Так как dS является полным дифференциалом, то изменение энтропии в каком-либо процессе зависит только от начального и конечного состояний и не зависит от пути перехода:
ΔS = S 1 - S 2 , ( 16 )
где ΔS — изменение энтропии при переходе системы из состояния (1) в состояние (2).
Выражение ( 15 ) является математической записью второго начала термодинамики для обратимых процессов. Подставляя в уравнение первого начала термодинамики вместо δ Q равную величину TdS из уравнения ( 15 ), получим аналитическое выражение первого и второго законов термодинамики для обратимых процессов:
dU = TdS — δА. ( 17 )

Наиболее просто изменение энтропии ΔS определяется для обратимых изотермических процессов. Для них из уравнения (42) вытекает, что
Q
ΔS = T , ( 18 )
т.е. в обратимых изотермических процессах изменение энтропии равняется тепловому эффекту процесса, деленному на абсолютную температуру. Изменение энтропии рассчитывается на 1 моль и выражается в джоулях на градус. Единица измерения энтропии (так называемая «энтропийная единица», сокращенно э. е.) имеет следующее выражение:
1 э. е. = 1 ДжДмоль.К).
Так, при плавлении льда при 273,16 К поглощается теплота в количестве 6009,48 Дж/моль (мольная теплота плавления). Следовательно, изменение энтропии в этом процессе равно:
6009.48
ΔS = 273.16 ≈ 22 Дж/(моль-К). 273,16

До сих пор, когда мы говорили об изменении энтропии, имелись в виду обратимые процессы; установлено, что величина ΔS для бесконечно мало обратимого процесса выражается уравнением (42). Однако, как мы уже знаем, обратимые процессы являются идеальными. Реальные же процессы, протекающие в природе, практически необратимы, так как при любых превращениях часть энергии переходит в теплоту, а последняя, как следует из второго начала термодинамики, может превращаться в другие виды энергии лишь частично.
На основании многочисленных опытов было установлено, что во всяком необратимом процессе коэффициент полезного действия всегда меньше, чем в обратимом процессе, т. е.
Q 1 - Q 2 T 1 - T 2 Q 2 T 2 Q 1 Q 2
Q 1 T 1 ; Q 1 T 1 ; Т1 Т2 0
в пределе алгебраическая сумма ΣδQi / T Q / T
 Т (19) В системах изолированных, т. е. лишенных теплообмена с окружающей средой, процессы протекают без изменения тепловой энергии (δ Q = 0). Поэтому в изолированных системах при изотермических и полностью обратимых процессах изменение энтропии ( dS ) равно нулю. Если в замкнутых системах при Т = const и V — const будут идти необратимые процессы, энтропия этих систем будет возрастать. " width="640"
Т (19) В системах изолированных, т. е. лишенных теплообмена с окружающей средой, процессы протекают без изменения тепловой энергии (δ Q = 0). Поэтому в изолированных системах при изотермических и полностью обратимых процессах изменение энтропии ( dS ) равно нулю. Если в замкнутых системах при Т = const и V — const будут идти необратимые процессы, энтропия этих систем будет возрастать. " width="640"
Из этого следует, что при необратимых процессах будет иметь место неравенство
δ Q
dS Т (19)
В системах изолированных, т. е. лишенных теплообмена с окружающей средой, процессы протекают без изменения тепловой энергии (δ Q = 0). Поэтому в изолированных системах при изотермических и полностью обратимых процессах изменение энтропии ( dS ) равно нулю.
Если в замкнутых системах при Т = const и V — const будут идти необратимые процессы, энтропия этих систем будет возрастать.

В изолированных системах самопроизвольно могут протекать только процессы, которые сопровождаются увеличением энтропии. Это означает, что состояние устойчивого термодинамического равновесия в изолированной системе отвечает максимуму энтропии: AS = макс. Энтропия изолированной системы ни при каких условиях не может самопроизвольно убывать. Однако из всех предыдущих рассуждений нельзя сделать вывод о том, что процессы, протекающие с уменьшением энтропии, вообще невозможны. Дело в том, что подобные процессы в изолированных системах не могут возникать самопроизвольно, так как для их осуществления необходим определенный теплообмен с окружающей средой.
Для удобства запоминания все сказанное выше об энтропии представим схемой:
Неизолированные системы
 ; dU TdS — δ А ; δ А ( 20 ) В этих уравнениях U и S не зависят от пути течения процесса. Работа А зависит от способа проведения процесса и будет максимальной, когда процесс полностью обратим. Эту максимальную работу обычно обозначают А / А макс . В необратимых процессах работа всегда меньше, т. е. А А макс , поэтому отношение А / А макс ≤ 1 может служить мерой необратимости. " width="640"
; dU TdS — δ А ; δ А ( 20 ) В этих уравнениях U и S не зависят от пути течения процесса. Работа А зависит от способа проведения процесса и будет максимальной, когда процесс полностью обратим. Эту максимальную работу обычно обозначают А / А макс . В необратимых процессах работа всегда меньше, т. е. А А макс , поэтому отношение А / А макс ≤ 1 может служить мерой необратимости. " width="640"
Уравнения первого и второго начал термодинамики, пригодные для обратимых и необратимых процессов, можно записать так:
dS ; dU TdS — δ А ; δ А ( 20 )
В этих уравнениях U и S не зависят от пути течения процесса. Работа А зависит от способа проведения процесса и будет максимальной, когда процесс полностью обратим. Эту максимальную работу обычно обозначают А / А макс . В необратимых процессах работа всегда меньше, т. е. А А макс , поэтому отношение А / А макс ≤ 1 может служить мерой необратимости.

Больцман и Гиббс показали, что энтропия есть некая средняя величина, которая является функцией неупорядоченности (хаотичности) движения множества молекул, т. е. имеет явно выраженный статистический характер.
При нагревании хаотичность, беспорядочность движения молекул усиливается и энтропия системы повышается. Например, при нагревании воды в пределах от 273 до 298 К энтропия ее возрастает на 6,61 Дж/(град • моль).
Исходя из этого, Л. Больцман (1896) определил статистический смысл энтропии как логарифм вероятности существования системы
S = k ln w , ( 21 )
где w — вероятность существования системы; k — постоянная Больцмана
Количественной мерой термодинамической вероятности w является число различных микросостояний, которыми может быть осуществлено макросостояние, характеризуемое заданными термодинамическими параметрами. Следует иметь в виду, что понятие термодинамической вероятности состояния не совпадает с понятием математической вероятности. Первая всегда больше единицы (обычно выражается очень большими числами),_ а вторая составляет доли единицы, так как определяется отношением числа интересующих нас с какой-либо точки зрения случаев к общему числу возможных случаев.
Таким образом, в силу статистического характера второе начало неприменимо для системы с одной или малым числом частиц или молекул, т.е. для микрообъемов. Так, например, в газах вследствие хаотичности теплового движения молекул в отдельных микрообъемах плотность может кратковременно оказаться более высокой по сравнению со средней плотностью в макрообъеме. Это явление носит название флуктуации. Образование микроучастков с повышенной плотностью газа протекает самопроизвольно и с уменьшением энтропии, что не согласуется со вторым началом термодинамики. Аналогичные явления могут происходить и в отдельных микрообъемах растворов: концентрация частиц растворенного вещества на какой-то краткий период может оказаться в микрообъеме выше средней концентрации в макрообъеме.
Второе начало термодинамики и живые организмы
Живые организмы подчиняются всем основным законам природы. К ним полностью применим закон сохранения и превращения энергии, а также второе начало термодинамики.
В процессе жизнедеятельности любой организм, растительный и животный, осуществляет постоянный обмен вещества с окружающей средой. Он поглощает в виде пищи разнообразные вещества, ассимилирует и трансформирует их в состав своего тела, а затем в процессе диссимиляции разрушает и удаляет в виде отработанных продуктов во внешнюю среду. Многочисленные эксперименты установили, что все эти процессы строго подчиняются закону сохранения материи.
Однако некоторые ученые считают, что в отличие от неживых систем организмы являются накопителями энергии и в них идут процессы, противоположные второму началу термодинамики, иными словами, рассматривают живые организмы как системы не энтропические, а эктропические (накопители свободной энергии). При этом живой организм рассматривается вне связи со средой его обитания. Диалектика же учит, что организм необходимо рассматривать в его тесной и неразрывной связи с окружающей средой.
Действительно, необходимую для процессов жизнедеятельности энергию живой организм получает из пищевых продуктов, которые являются носителями химической энергии высокого потенциала. При распаде этих веществ в организме энергия высвобождается и используется организмом как тепловая, как механическая работа и в реакциях различного синтеза. Продукты распада живого организма содержат значительно меньше химической энергии, поэтому с этой точки зрения приложимость второго начала термодинамики к органическому миру не вызывает сомнений.
Но, с другой стороны, живые организмы являются системами открытыми, поэтому, используя энергию обмена, могут сами заряжаться до более высокого потенциала и с этой точки зрения имеет место противоречие второму началу термодинамики. Так, зеленые растения для повышения энергетического потенциала используют солнечную энергию, а животные — энергию, поступающую с пищей. Таким образом, хотя энтропия самого организма может изменяться в любом направлении, т. е. она может уменьшаться за счет непрерывного поглощения свободной энергии из окружающей среды, энтропия системы организм — среда, взятом в целом, несомненно увеличивается. Это дает основание для общего вывода: для живых организмов, как и для тел неживой природы, полностью выполняются законы термодинамики.

Термодинамические потенциалы. Характеристические
функции
В изолированных системах энтропия может только увеличиваться и достигать своего максимума, когда система находится в равновесии. Поэтому она и используется для суждения о направлении самопроизвольных процессов в таких системах. Однако в естественных условиях подавляющее большинство процессов протекает в неизолированных системах. По этой причине для них потребовалось ввести другие критерии равновесия. Направление процессов при этом можно характеризовать работой, которую они могут совершать при определенных условиях.

Величина работы, как известно, зависит от пути процесса. Поэтому, казалось бы, она не может служить критерием для суждения о направленности того или иного процесса. Однако если ограничиться рассмотрением частного случая процесса при постоянной температуре, то оказывается, что максимальная работа при обратимом его протекании будет определяться изменением некоторой функции состояния. Действительно, из уравнения (11,47) можем написать δ А = TdS — dU , или при Т = const
δ А ≤ — d ( U — TS). ( 1 )
Как видим, при обратимом изотермическом процессе работа, производимая системой, равна убыли некоторой функции состояния
A = U — TS . ( 2 )
Функция ( U — TS ) получила название изохорно-изотермического^ потенциала (сокращенно изохорный потенциал) или свободной энергии. Иногда эту функцию называют еще потенциалом Гельмгольца.
При этом для всякого изотермического процесса
ΔА = Δ U — T Δ S или dA = dU — TdS . ( 3 )
Таким образом, максимальная работа при изохоруо-изотермических равновесных процессах равна убыли свободной энергии системы, т.е. W = — ΔА, или в общем
случае
δ А ≤ — dA . ( 4 )

Изменение свободной энергии определяется только начальным и конечным состоянием системы и не зависит от характера процесса. Величина работы может зависеть лишь от способа проведения процесса. Так, например, при необратимом процессе произведенная работа всегда будет меньше убыли свободной энергии, так как при этом часть изменения свободной энергии неизбежно превращается в теплоту.
Из определения А следует, что U = А + TS , т. е . что внутренняя энергия системы состоит из двух частей: свободной энергии при постоянном объеме и связанной энергии TS . Как видим, связанная энергия равна произведению энтропии на абсолютную температуру. Свободная энергия —это та часть внутренней энергии, которая при обратимом изотермическом процессе может быть полностью превращена в работу.
Если к условию постоянства температуры добавить условие постоянства объема, т. е. δ А = pdV = 0, то из уравнения ( 4 ) получим
0 ≤ — dA или dA ≤ 0. (5)
Следовательно, при постоянных температуре и объеме свободная энергия не изменяется при обратимых процессах, а при необратимых может только убывать. Это означает, что данная функция действительно является критерием, который позволяет судить о направлении процессов Е незамкнутых системах. Очевидно, для таких систем условием равновесия является минимум свободной энергии (при постоянных V и Т).
Как видим, условия, которым должны удовлетворять процессы для того, чтобы по изменениям величины А можно было судить о направлении этих процессов, иные, чем для энтропии. Для энтропии это было условие постоянства внутренней энергии и объема (изолированная система), для изохорно-изотермического потенциала это условие постоянства объема и температуры — легко измеряемых параметров системы. Величина А, являясь производным понятием по отношению к энтропии, представляет собой практически более удобный критерий для характеристики направленности процессов, чем энтропия.
Таким образом, свободная энергия при постоянных V и Т в естественных (самопроизвольных) процессах стремится уменьшиться. Когда она достигает минимального значения (совместимого с данными V и Т), система приходит в равновесие.

В технике большинство процессов совершается не при постоянном объеме, а при постоянном давлении. Поэтому кроме свободной энергии при постоянном объеме целесообразно ввести такую функцию состояния, которая служила бы критерием равновесия в условиях постоянства давления и температуры.
Если объем системы изменяется, то согласно уравнению (5)
pdV ≤ — dA или dA + pdV ≤ 0. При постоянном давлении
d(A + pV) ≤ 0 ( 6 )
Таким образом, новая функция состояния, называемая изобарно-изотермическим потенциалом (или потенциалом Гиббса), обозначается обычно через G и определяется уравнениями:
G = H – TS
G = U – TS + pV E ( 7 )
G = A + pV
т. е. G находится в таком же отношении к функции А, как энтальпия Н к внутренней энергии U .

Для любого процесса ΔG = Δ А + Δ ( pV ). Отсюда следует, что для любого изобарного процесса
ΔG = Δ А + Δ ( pV ). ( 8 )
Для всякого изотермического процесса
ΔG = ΔH — TΔS или dG = dH — TdS . ( 9 )
Согласно уравнениям (52) и (56) можно вывести уравнение
А M = А - pΔV , ( 10 )
где А M — максимальная полезная работа, равная максимальной работе А за вычетом работы против внешнего давления. Для изотермического процесса при р = const
δ А M ≤ — dG . ( 11 )

При обратимых процессах величина G не изменяется, а при необратимых может только убывать. Следовательно, равновесное состояние системы при постоянных давлении и. температуре соответствует минимуму изобарно-изотермического потенциала.
Суммируя все выше изложенное, можно сделать вывод о том, что описание термодинамических свойств любой системы может быть выражено через термодинамические функции системы: U = f ( S , V ),
Н = f ( S , р), А = f ( V , T ), G = f ( p , T ), связь между которыми представлена на схеме
 0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством dQ = dW =0 dT dT , ( 1 ) Из уравнения (60) следует, что W = 0. Согласно третьему закону термодинамики уравнение ΔG = ΔH — TΔS при Т 0 принимает вид Δ G T 0 ΔH T=0 " width="640"
0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством dQ = dW =0 dT dT , ( 1 ) Из уравнения (60) следует, что W = 0. Согласно третьему закону термодинамики уравнение ΔG = ΔH — TΔS при Т 0 принимает вид Δ G T 0 ΔH T=0 " width="640"
Тре тье начало термодинамики
Третье начало термодинамики, или тепловая теорема, было сформулировано Нернстом в 1906 г. и потому часто называется его именем. Большое значение в развитии этой теоремы имели работы М. Планка (1911). Тепловая теорема Нернста имеет следующую формулировку: при абсолютном нуле энтропия любого однородного тела равна нулю.
При этом делается допущение, что при Г-0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством
dQ = dW =0
dT dT
, ( 1 )
Из уравнения (60) следует, что W = 0.
Согласно третьему закону термодинамики уравнение
ΔG = ΔH — TΔS при Т 0 принимает вид
Δ G T 0 ΔH T=0

Таким образом, изменение изобарно-изотермического потенциала реакции становится равным изменению энтальпии. Расхождение между этими функциями состояния увеличивается с повышением температуры. Другими словами, с повышением температуры направление химической реакции зависит уже от двух факторов — от знака изменения энтальпии и от значения изменения энтропии. В 1907 г. Эйнштейн доказал, что теплоемкость твердых тел при абсолютном нуле ( T = 0) должна быть равна нулю. Благодаря тепловой теореме Нернста оказалось возможным определять абсолютную величину энтропии на основании измерения теплоемкостей при разных температурах. На основании этой теоремы можно вывести известные соотношения, которые позволяют по тепловому эффекту реакции вычислять ее свободную энергию, а зная последнюю, можно предсказать и направление реакции.
















 Т 2 , то коэффициент полезного действия машин может изменяться в пределах от 0 (при Т 1 = Т 2 ) до 1 (когда Т 2 = 0К.). Однако получить к. п. д. тепловой машины η = 1 невозможно, так как нельзя создать теплоприемник с температурой, равной абсолютному нулю. Поэтому даже в идеальном случае существует предел превращения теплоты в работу. Все эти выводы получены, как уже подчеркивалось, для идеального газа в качестве рабочего тела. Следовательно, коэффициент полезного действия цикла Карно - есть максимальный коэффициент полезного действия тепловых машин, работающих циклами, и невозможно построить такую машину, которая, получив Q джоулей теплоты, превратила бы в работу больше энергии, чем η Q " width="640"
Т 2 , то коэффициент полезного действия машин может изменяться в пределах от 0 (при Т 1 = Т 2 ) до 1 (когда Т 2 = 0К.). Однако получить к. п. д. тепловой машины η = 1 невозможно, так как нельзя создать теплоприемник с температурой, равной абсолютному нулю. Поэтому даже в идеальном случае существует предел превращения теплоты в работу. Все эти выводы получены, как уже подчеркивалось, для идеального газа в качестве рабочего тела. Следовательно, коэффициент полезного действия цикла Карно - есть максимальный коэффициент полезного действия тепловых машин, работающих циклами, и невозможно построить такую машину, которая, получив Q джоулей теплоты, превратила бы в работу больше энергии, чем η Q " width="640"







 Т (19) В системах изолированных, т. е. лишенных теплообмена с окружающей средой, процессы протекают без изменения тепловой энергии (δ Q = 0). Поэтому в изолированных системах при изотермических и полностью обратимых процессах изменение энтропии ( dS ) равно нулю. Если в замкнутых системах при Т = const и V — const будут идти необратимые процессы, энтропия этих систем будет возрастать. " width="640"
Т (19) В системах изолированных, т. е. лишенных теплообмена с окружающей средой, процессы протекают без изменения тепловой энергии (δ Q = 0). Поэтому в изолированных системах при изотермических и полностью обратимых процессах изменение энтропии ( dS ) равно нулю. Если в замкнутых системах при Т = const и V — const будут идти необратимые процессы, энтропия этих систем будет возрастать. " width="640"

 ; dU TdS — δ А ; δ А ( 20 ) В этих уравнениях U и S не зависят от пути течения процесса. Работа А зависит от способа проведения процесса и будет максимальной, когда процесс полностью обратим. Эту максимальную работу обычно обозначают А / А макс . В необратимых процессах работа всегда меньше, т. е. А А макс , поэтому отношение А / А макс ≤ 1 может служить мерой необратимости. " width="640"
; dU TdS — δ А ; δ А ( 20 ) В этих уравнениях U и S не зависят от пути течения процесса. Работа А зависит от способа проведения процесса и будет максимальной, когда процесс полностью обратим. Эту максимальную работу обычно обозначают А / А макс . В необратимых процессах работа всегда меньше, т. е. А А макс , поэтому отношение А / А макс ≤ 1 может служить мерой необратимости. " width="640"







 0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством dQ = dW =0 dT dT , ( 1 ) Из уравнения (60) следует, что W = 0. Согласно третьему закону термодинамики уравнение ΔG = ΔH — TΔS при Т 0 принимает вид Δ G T 0 ΔH T=0 " width="640"
0 зависимость теплового эффекта и максимальной работы для конденсированных систем выражается равенством dQ = dW =0 dT dT , ( 1 ) Из уравнения (60) следует, что W = 0. Согласно третьему закону термодинамики уравнение ΔG = ΔH — TΔS при Т 0 принимает вид Δ G T 0 ΔH T=0 " width="640"




















