

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Выпускная квалификационная работа - КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ ОРХИДЕЙ PHALAENOPSIS SPP.
Просмотр содержимого документа
«Выпускная квалификационная работа - КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ ОРХИДЕЙ PHALAENOPSIS SPP.»
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«ПЕРМСКИЙ ГОСУДАРСТВЕННЫЙ ГУМАНИТАРНО-
ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ»
ЕСТЕСТВЕННОНАУЧНЫЙ ФАКУЛЬТЕТ
Кафедра ботаники
Выпускная квалификационная работа
КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ ОРХИДЕЙ
P HALAENOPSIS SPP.
Работу выполнила:
студентка 651 группы
направления подготовки
44.03.05 Педагогическое образование, профили «Биология и Химия»
Дементьева Нина Сергеевна
___________________
(подпись)
| «Допущена к защите в ГАК» Зав. кафедрой ____________________ (подпись) «____» ___________ 20__ г. | Руководитель: кандидат биологических наук, доцент кафедры ботаники Лаврский Алексей Юрьевич ____________________ (подпись) |
ПЕРМЬ
2018
| Оглавление ВВЕДЕНИЕ……………………………………………………………………. |
4 |
| Глава 1. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ОБЪЕКТА ИССЛЕДОВАНИЙ……………………………..……………………..….... |
11 |
| 1.1 Систематика орхидей……………………………………………... | 12 |
| 1.2 Особенности строения вегетативных органов орхидных (Orchidáceae)…………………………………………………………… |
13 |
| 1.3 Особенности строения генеративных органов орхидных (Orchidáceae)…………………………………………………………… |
15 |
| 1.4 Характеристика основных мест произрастания………………… | 17 |
| 1.5 Биологические особенности рода фаленопсис – Phalaenopsis… | 20 |
| 1.6 История открытия представителей рода фаленопсис – Phalaenopsis ……………………………………………………………. |
20 |
| 1.7 Проблема охраны исчезающих видов рода фаленопсис – Phalaenopsis ……………………………………………………………. |
21 |
| Глава 2. КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ ОРХИДНЫХ (ORCHIDACEAE)…………………………………………………………… |
22 |
| 2.1 Общие сведения о клональном микроразмножении растений………………………………………………………………… |
23 |
| 2.1.1 Типы клонального микроразмножения……………………... | 24 |
| 2.1.2 Преимущества клонального микроразмножения…………... | 25 |
| 2.1.3 Этапы клонального микроразмножения…………………….. | 26 |
| 2.1.4 Проблемы и перспективы клонального микроразмножения. | 27 |
| 2.2 Введение в культуру использованием различных типов эксплантов………………………………………………………………. |
28 |
| 2.2.1 Основные типы питательных сред для культивирования орхидных (Orchidáceae) in vitro………………………………....... |
30 |
| 2.2.1.1 Модификация питательной среды Мурасиге - Скуга для культивирования листовых эксплантов и цветочных почек фаленопсиса (Phalaenopsis)…………………………….. |
30 |
| 2.2.1.2 Среды Т.М. Черевченко и Г.П. Кушнир……….......... | 32 |
| 2.2.2 Влияние факторов питательной среды на эффективность прорастания семян………………………………………................. |
34 |
| 2.2.3 Начальные этапы роста и развития в культуре in vitro…… | 39 |
| 2.2.4 Особенности адаптации регенерантов условиям ex vitro………………………………………………………………... |
41 |
| Глава 3. МЕТОДИКА ПРОВЕДЕНИЯ РАБОТЫ…………….……….…. | 44 |
| 3.1 Введение растений в культуру…………………………..……..…. | 44 |
| 3.2 Приготовление и использование пасты содержащей цитокинин...…………………………………………………………….. |
46 |
| Глава 4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ………………………………. | 48 |
| 4.1 Выбор дезинфектантов для стерилизации эксплантов при введении в культуру in vitro …..……………………………………… |
48 |
| 4.2 Оценка жизнеспособности эксплантов…………………………… | 52 |
| 4.3 Влияние питательной среды на жизнеспособность эксплантов… | 53 |
| Глава 5. ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В РАБОТЕ С УЧАЩИМИСЯ ШКОЛ………………………………………. |
56 |
| ЗАКЛЮЧЕНИЕ……………………………….……………………………… | 59 |
| Библиографический список…………………………………..……….…..… | 61 |
| Приложение 1………………….…………………………………………….. | 67 |
| Приложение 2………………………………………………………………... | 69 |
| Приложение 3………………………………………………………………... | 70 |
| Приложение 4………………………………………………………………... | 73 |
| Приложение 5………………………………………………………………... | 74 |
ВВЕДЕНИЕ
Наиболее острыми проблемами во всех странах мира были и остаются проблемы охраны окружающей среды. Исходя из понимания того, что человек является лишь одним из множества биологических видов, в конце 20-го века была реализована зависимость благосостояния человеческого общества от устойчивости и сохранения биологического и ландшафтного разнообразия на планете Земля. Принятие Конвенции о биологическом разнообразии в 1993 году в Рио-де-Жанейро является ярким подтверждением вышеизложенного. К настоящей Конвенции Российская Федерация присоединилась к 1995 году.
Важной формой сохранения ландшафта и биологического разнообразия является организация особо охраняемых природных территорий (далее именуемых ООПТ). В разных странах формы ООПТ очень разнообразны, но их задачи близки. Важнейшей задачей является сохранение ландшафтного и биологического разнообразия, а также поддержание природных комплексов и объектов в естественном состоянии.
В 1911 году с публикацией П.В.Сюзева в «Записках уральского общества натуралистов» в статье «Сохранение естественных памятников» началось формирование сети охраняемых территорий в Пермском крае. Он сформулировал ботанико-географическую основу распределения природных памятников в 1923 году. На последующих этапах несомненны заслуги в формировании сети ООПТ: Аникиной Э.Э., Баньковского Л.В., Белковской Т.П., Горбуновой К.А., Маковского В.И., Максимовича Г.А., Мамаева С.А., Шарца А.К. и других.
Современная система ООПТ края начала формироваться с 80-х годов XX века. Научный компонент был подготовлен учеными Пермского государственного и Пермского гуманитарных и педагогических университетов. Правовые основы существующих ООПТ были подготовлены региональными природоохранными органами, которые в течение многих лет были направлены В.В. Казанцев.
В настоящее время ООПТ на территории Пермского края представлены федеральными, региональными и местными объектами. Федеральные охраняемые территории - государственные заповедники «Басеги» и «Вишерский». 282 существующих охраняемых территорий регионального значения представлены государственными природными заповедниками (20 штук), памятниками природы (114), историческими и природными комплексами и объектами (5), заповедниками (46) и охраняемыми ландшафтами (97). На территории региона также имеется 51 ООПТ местного значения [47].
В дополнение к особо охраняемым территориям создаются специализированные сады, которые поддерживают климат, подобный тому, где растут растения. Всего в России насчитывается 76 ботанических садов и других вводных центров, работа которых координируется Советом ботанических садов России. Среди крупнейших ботанических садов, внесших наибольший вклад в сохранение исчезающих растений ex situ, находящихся под угрозой исчезновения:
Главный ботанический сад им. Н. В. Цицина, Москва. Общая площадь 361 га. Коллекции растений - более 21 000 наименований (в том числе около 10 тысяч садовых сортов и форм). Коллекция редких и исчезающих растений насчитывает 320 видов.
Ботанический сад Ботанического института им. В.Л. Комаров РАН, в Санкт-Петербурге, общей площадью 22,6 га. Коллекции собрали 11 664 таксона, в том числе более 300 видов редких и находящихся под угрозой исчезновения растений в России и соседних странах.
Ботанический сад научно-производственного объединения «Нива Ставрополья», РАСХН, в Ставрополе, общей площадью 207 гектаров. В коллекциях более 5000 таксонов. Редкие и исчезающие растения представлены 291 видом.
Ботанический сад МГУ. им. М.В. Ломоносова, в Москве, общей площадью 36 гектаров. В саду насчитывается 6500 видов, сортов и растительных культур, в том числе 74 редких и находящихся под угрозой исчезновения видов России и 92 в Московской области.
Ботанический сад Уральского отделения Российской академии наук, в Екатеринбурге, общей площадью 50 гектаров. Коллекции собрали около 3 тыс. таксонов, в том числе 130 редких видов Урала.
Ботанический сад-институт Дальневосточного отделения Российской академии наук, во Владивостоке, общей площадью 170 гектаров. В коллекциях насчитывается более 4тыс. таксонов. Количество редких и находящихся под угрозой исчезновения видов составляет 120. Из них 100 являются видами местной флоры.
Полярно-альпийский ботанический сад-институт Российской академии наук, в Кировске. Общая площадь составляет 350 гектаров. Количество видов в коллекциях составляет более 2тыс. видов, 120 из которых являются редкими и находятся под угрозой исчезновения.
Центральный сибирский ботанический сад Сибирского отделения Российской академии наук, в Новосибирске, общей площадью 1062 га. В ботанических коллекциях насчитывается около 5 тыс. таксонов, в том числе редких и находящихся под угрозой исчезновения видов - 92.
Основные направления работ по сохранению ex situ растений в России:
Разведение редких видов в неволе с целью реинтродукции в естественную среду для поддержания существующих, восстановления утраченных и создания новых популяций in situ;
Разведение экономически ценных видов для увеличения ресурсов эксплуатируемых популяций;
Содержание и разведение в культурно-образовательных целях.
Выращивание объектов на искусственных средах, таких как Мурасиге–Скуга, Кнудсона, и др. в стерильных условиях (in vitro).
Данная работа посвящена последнему направлению, а именно, микроклональному размножению.
Термином «клональное микроразмножение» называют массовое бесполое размножение растений в культуре клеток и тканей, при котором полученные регенеранты генетически идентичны исходному образцу.
Этот метод позволяет на короткое время получить большое количество однородного посадочного материала растений. Коэффициенты клонального микроразмножения достигают 105 –107 растений в год, что в несколько тысяч раз больше, чем при использовании традиционных методов вегетативного размножения.
Клональное микроразмножение значительно ускоряет процесс отбора, сокращая время получения коммерческих продуктов новых сортов до 2–3 лет вместо 10–12. И важно отметить, что когда растения размножаются в культуре тканей, они высвобождаются от патогенных микроорганизмов и, во многих случаях, и от вирусов. В процессе размножения нет риска повторного заражения растений. Также возможно оздоровить посадочный материал, что значительно улучшает качество продукции.
Кроме того, этот метод позволяет сэкономить площади. Тысячи размножаемых растений (регенерантов) легко размещаются на небольших участках климатических камер. В культуре тканей рост растений может поддерживаться в течение всего года, что важно для растений, которые имеют периоды отдыха в своем цикле развития. При выращивании растений с длительной ювенильной фазой может быть достигнут ускоренный переход от молодняка к репродуктивной фазе развития, и, наконец, методом тканевой культуры можно размножать растения, которые не размножаются вегетативно или вообще.
В качестве объекта исследований автором выбраны представители семейства Орхидных (Orchidaceae).
Орхидеи - самое большое семейство однодольных растений. Известно около 30 тыс. видов дикорастущих орхидей, почти 10% всех растений в мире. Около 17 тыс. видов находятся под угрозой исчезновения.
Многие орхидеи опыляются только некоторыми видами животных – когда эти животные вымирают, орхидеи также умирают. Каждый год ученые описывают новые виды орхидей.
Когда при слове «орхидея» обычно представляется экзотический цветок, растущий в тропических джунглях. Однако орхидеи распространены, в том числе на территориях России, но эти северные виды выглядят более скромными.
Из 136 видов орхидей, растущих в России, 44 занесены в Красную книгу.
Характеристика таксонов растений Пермского края, состояние которых в природной среде требует особого внимания по данным Красной книги Пермского края [52]:
Венерин башмачок пятнистый – Cypripedium guttatum Sw.;
Хаммарбия болотная – Hammarbya paludosa (L.) O. Kuntze (Malaxispaludosa (L.) Sw.);
Тайник сердцевидный – Listera cordata (L.) R. Br.;
Тайник яйцевидный – Listera ovata (L.) R. Br.;
Любка двулистная – Platanthera bifolia (L.) Rich.;
Ладьян трехнадрезной – Corallorhiza trifida Chatel.;
Дремлик широколистный – Epipactis helleborine (L.) Crantz;
Дремлик темно-красный – Epipactis atrorubens (Hoffm. ex Bernh.) Bess.;
Гудайера ползучая – Goodyera repens (L.) R. Br.;
Пололепестник зеленый – Coeloglossum viride (L.) C. Hartm.;
Кокушник длиннорогий – Gymnadenia conopsea (L.) R. Br. ;
Пальчатокоренник мясо-красный – Dactylorhiza incarnatа (L.) Soo;
Пальчатокоренник кровавый – Dactylorhiza cruenta (O. F. Muell.) Soo;
Пальчатокоренник болотолюбивый – Dactylorhiza elodes (Griseb.) Aver.;
Пальчатокоренник Руссова – Dactylorhiza russowii (Klinge) Holub;
По данным сайта Красной книги Пермского края [52].
Также значительный интерес представляют и орхидеи, культивируемые в декоративных целях. Они достаточно доступны в качестве исходного материала, и не менее востребованы на рынке.
Вегетирующие горшечные растения сем. орхидных (Orchidaceae) рода фаленопсис (Phaleanopsis) достаточно дороги, по сравнению с другими растениями, стоимость маленького отводка посаженного в субстрат может составлять от 800 рублей, но чаще в магазинах встречается цена: 1700 или 2500 рублей.
Высокая стоимость свидетельствует о некоторой трудоемкости культивирования, но в то же время, значительном спросе на рынке декоративных растений.
Данная работа посвящена изучению клонального микроразмножения орхидных на примере орхидей рода фаленопсис (Phalaenopsis)
Цель: освоить методику клонального микроразмножения орхидеи фаленопсис (Phalaenopsis), оценить перспективность использования различных типов эксплантов и ювенильного материала.
Задачи:
Изучить биологические особенности орхидеи рода Phalaenopsis и материалы по микроклональному размножению орхидных;
Освоить изготовление агаризованных питательных сред различного состава и осуществить введение растений в культуру in vitro.
Сформировать наиболее эффективные протоколы стерилизации листовых и стеблевых эксплантов, а также ювенильного материала Phalaenopsis;
Оценить эффективность использования питательных сред с разными соотношениями фитогормонов.
Выявить типы эксплантов, с наибольшим выходом жизнеспособных регенерантов и каллуса.
Глава 1. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ОБЪЕКТА ИССЛЕДОВАНИЙ
Орхидеи являются многолетними микотрофными, иногда лишённые хлорофилла, травами с клубневыми корнями или корневищами.
Орхидеи очень разнообразны по внешнему виду, размеру и образу жизни. Среди них есть наземные растения, лианы, эпифиты. Есть более 100 тысяч видов и сортов орхидей, но не все можно выращивать в комнатных условиях. Большинство орхидей, пригодных для выращивания в домашних условиях, являются эпифитными растениями. Это растения, которые живут на других растениях, в основном на ветвях и стволах (иногда на листьях).
Листья очередные (но отсутствуют у сапрофитов), простые и цельные, с параллельным жилкованием, обычно с влагалищным основанием.
Искусственно, орхидеи распространяются путем разделения псевдобульб и корневищ.
Псевдобульбы – это утолщенные стебли, служащие для запаса воды и питательных веществ. И во взрослом состоянии некоторые виды орхидей питаются только с помощью грибов – сапрофитов. Отдельные виды живут под землей совместно с грибами.
Орхидеи имеют два способа распространения: семенами и «детками». Воспроизведение семенами и «детками» требует времени. Существует вероятность того, что растение может погибнуть, поскольку это очень трудноразводимое растение, и оно имеет много болезней и вредителей.
Факторы, негативно сказывающиеся на росте орхидей:
| Вирусная инфекция, | фомопсис; |
| солнечный или тепловой ожог, | альтернариоз, |
| избыточное освещение, | филлостиклоз, |
| фузариозное увядание, | стангоспороз, |
| химический ожог, | естественный процесс старения, |
| длительное нахождение воды, | «сухая» гниль, |
| бактериальная пятнистость, | недостаточное освящение, |
| септориоз, | грибковая инфекция, |
| бактериоз или мокрая бактериальная гниль. | |
Вредители, чьё влияние негативно сказывается на рост и развитие орхидей фаленопсис:
| Бабочки (мотыльки), | Панцирный клещ, |
| Белокрылка, | Прозрачный клещ, |
| Долгоносик, | Тля, |
| Клопы, | Трипсы, |
| Мучнистый червец, | Щитовка |
| Мыши, | Ложнощитовка |
| Нематоды, | и т.д. |
1.1 Систематика орхидей
Царство: Plantae – Растения
Отдел: Magnoliophyta – Цветковые
Класс: Liliopsida – Однодольные
Порядок: Asparagales – Спаржецветные (Орхидные)
Семейство: Orchidáceae – Орхидные
Группа: Spiranthinae – Спирантовые:
Группа: Cypripedioideae – Циприпедиевые:
Группа: Bletinae – Блетиевые:
Группа: Dendrobiinae – Дендробиумные:
Группа: Catasetinae – Катазетумные:
Группа: Maxillariinae – Максилляриевые:
Группа: Cymbididiinae – Цимбидиумные:
Группа: Epidendrinae – Эпидендриновые:
Род: Brassavola – Брассавола
Род: Cattleya – Каттлея
Род: Laelia – Лелия
Род: Epidendrum – Эпидендрум
Род: Leptotes – Лептотес
Род: Sophronitis – Софронитис
Род: Phalaenopsis – Фаленопсис
1.2 Особенности строения вегетативных органов орхидных (Orchidáceae)
Стебель. Внешний вид орхидей чрезвычайно разнообразен, в специальной литературе рассматриваются различные типы побеговых систем этих растений. Молодой побег орхидеи называется ростом. Существует два основных типа роста орхидей, названия которых несколько подробно описательны ниже.
Первый тип называется симподиальным, он формирует новый сезонный рост каждый год с основания предыдущего роста, и этот новый рост формирует собственные корни, цветы, а затем дает начало новому росту следующего сезона. Это растение состоит из нескольких стеблей, поднимающихся от ползучего наземного стебля или ризомы, которое также называют корневищем. Корневище расположено горизонтально и не имеет больших настоящих листьев. Оно является стеблевым, а не корневым образованием, и несет несколько чешуевидных листьев. У симподиальных орхидей апикальная почка отмирает или приводит к росту цветоноса (генеративного побега), и новый побег начинает развиваться у основания вегетативного побега.
Второй тип называется моноподиальным, он дает один главный вертикальный стебель, который растет каждый год и формирует новые листья на вершине, но не обеспечивает нового роста от основания. Он не имеет псевдобульб, и не образует ризомы. У растений этой группы апикальный почка сохраняется на протяжении всей жизни побега, и поэтому она имеет неограниченный рост в длину. Цветоносы и воздушные корни выходят из промежутков между листьями. Со временем рост стебля замедляется и полностью останавливается, когда растение стареет и умирает. Примерами таких растений являются ванда, аэроиды, фаленопсис и другие.
Листья. Различие формы, окраски и текстуры листьев зависит от условий окружающей среды. Листья орхидей из мест обитания с ярко выраженным сухим периодом, обычно мясистые, выполняют функцию хранения. В таких растениях иногда псевдобульбы уменьшаются или отсутствуют. Это, например, некоторые онцидиумы (Oncidium luridum, O. carthagenense, O. lanceanum и т. д.), трихоцентрумы, множество лелий. Орхидеи, подвергнутые прямому солнечному свету, в некоторых случаях оставляют цилиндрическую форму или близкую к ней (Vanda teres, V. hooke-riana).
Растения, которые требуют обилие света, которые периодически подвергаются воздействию прямых солнечных лучей, обычно имеют плотные кожистые листья. Они часто живут на верхних ветвях высоких деревьев и в других местах, доступных для солнца. Это многие лелии, ванды с ремневидными листьями, множество каттлей, аскоцентрумы, аэридесы, и многие другие. На листьях растений, испытывающих действие прямого солнца, как и на псевдобульбах, часто бывает пурпурное покрытие.
Корни. Корни орхидей как эпифитных растений имеют ряд специфических особенностей.
Многочисленные тонкие корни образуются в растениях, обитающих на ветвях, покрытых слоем мха или населяющих ветви с накопленным там гумусом. Такие корни иногда образуют «щетку», которая ловит падающие листья и другие органические остатки. Они чаще встречаются у листопадных растений (катазетум) или обладая большими луковицами (бульбами).
Несколько толстых мясистых корней характерны для растений, которые оседают на стволах деревьев (фаленопсис, ванда, аэридес). Они плотно прилегают к коре. В тропиках многие эпифиты образуют дополнительные воздушные корни, поглощая воду из атмосферных осадков через многослойную поверхностную ткань (так называемый «веламен»).
Веламен — особый слой омертвевших полых клеток. Им покрыты все корни эпифитных орхидей. Особое строение этого слоя позволяет впитывать влагу — дождевую воду или росу.
Благодаря своей гигроскопичности веламен также может поглощать влагу непосредственно из воздуха. Именно это его свойство позволяет корням эпифитных орхидей переживать длительные засушливые периоды.
1.3 Особенности жизненного цикла и строения генеративных органов орхидных (Orchidáceae)
Цветки зигоморфные, обоеполые, в соцветии колоса или кисти, редко одиночные.
Околоцветник. Околоцветник окрашеный, состоит из шести листьев в два круга. Наружные лепестки – сепалии – покрывают остальную часть цветка в бутоне. Внутри есть три лепестка – петалии, один из которых настолько модифицирован, что он сильно отличается от двух других, и поэтому он имеет свое собственное имя – губа, или лабеллум. Губа отличается от других лепестков не только по форме, но и окраской; часто трудно украшена гребешками, рогами, разводами, пятнами и т. д. Губа обычно самая сложная часть цветка, но на некоторых растений сепалии и петалии не менее декоративны.
Колонка. Самым характерным для орхидей является наименее заметная часть цветка – колонка, она представляет собой мясистую структуру, расположенную в центре и состоящую из взаимосвязанных генеративных органов. Колонна может иметь очень простую форму – зеленый, белый или розовый цилиндр. Может иметь сложную форму - выглядят как маленькая птица, кукла, голова лебедя или лицо в очках. Часто колонка украшена «крыльями» или «бахромой».
Мужские генеративные органы. Тычинка одна (реже две), сросшаяся нитью со столбиком в колонку (гиностемий), остальные тычинки превращены в стаминодии. Пыльник - двухгнездный; пыльцевые зерна либо склеиваются в массу – поллиний, либо разделяются. В некоторых случаях каждый поллиний оснащен ножкой, с помощью которой он прикрепляется к клейкой железке (прилипальцу), расположенному на конце клювика, который представляет собой модифицированное стерильное рыльце в виде пластины (иногда в виде трёхлопастной пластинки). Поллиний с ножкой и железкой называется поллинарием. Пыльцевое зерно орхидей чрезвычайно мало, почти незаметно для невооруженного глаза, около 0,35 мм в длину и 0,08-0,3 мм в ширину.
Клейкие поллинии необходимы для того, чтобы крепиться к спине опыляющих насекомых или цепляться за лапки насекомых, а у некоторых орхидей поллиний стреляет на расстояние до 2 метров. Насекомое, вползающее в цветок для нектара, переносит поллиний на следующий цветок, в котором он прилипает к специальному выросту – колонке, далее переносится на следующий цветок именно так происходит перекрестное опыление.
Женские генеративные органы. Немного ниже пыльника, отделенного от него перегородкой, имеется рыльце - глянцевая полость, заполненная очень липкой жидкостью.
Три рыльца, более или менее соединяющихся и образующих вогнутый или слегка выступающий диск, или соединяются только два рыльца вместе, а третья превращается в клювик. Завязь нижняя, часто скрученная, одногнездная, с тремя постенными плацентами и многочисленными семяпочками.
Плод. Плод орхидных – коробочка. Семян крайне много (у некоторых видов до 3-4 миллионов штук в коробке), и они очень малы (напоминают пыль), обычно с широкой прозрачной сетчатой кожурой. Зародыш не дифференцируется на органы. Зародыш орхидей еще меньше пыльцы - 0,05-0,26 мм в длину и 0,04-0,19 мм в ширину.
Эндосперма у орхидных нет, т.е. редуцирована ткань, которая обеспечивает питание зародыша, поэтому зародыши не способны развиваться без симбиоза с определенными видами микоризообразующих грибов.
Саженцы развиваются очень медленно – до цветения это занимает около пяти лет. Процесс созревания семян у некоторых видов может длиться пару лет. Не удивительно, что при таком способе размножения орхидеи погибают вместе с вырубкой лесов и перепашкой земель.
При разведении в колбах (in vitro) этот период можно сократить в 2-3 раза.
1.4 Характеристика основных мест произрастания
Орхидеи распространены во всем мире. Однако для культивирования наиболее интересны виды, происходящие из субтропических и тропических областей Земли. Орхидеи там, в основном встречаются в тропических лесах. Характеристику основных мест произрастания орхидей можно найти в таблице 1.
Таблица 1
Характеристика основных мест произрастания орхидей
| Тип леса | Сезонные изменения | Суточные изменения |
| Равнинный дождевой тропический лес. | Практическое отсутствие сезонных климатических колебаний.
| Небольшое понижение температур ночью по сравнению с дневной температурой (на 4—6°С). |
| Горный дождевой тропический лес. | Имеется короткий засушливый период в сезонном цикле.
| Ощутимое снижение ночной температуры (на 10-15°С) при одновременном возрастании влажности воздуха. |
| Туманный тропический лес.
| Слабо выраженные сезонные климатические колебания. | Незначительное понижение ночных температур по сравнению с дневными температурами (на 5—10°С). |
| Сезонный полулистопадный тропический лес. | Ярко выражен в сезонном цикле сухой сезон, длящийся несколько месяцев.
| Температуры ночью на 10-20°С ниже дневных температур. Выпадение обильной росы, измороси и туманов в ночное время во время сухого сезона. |
| Открытое местообитание. | Резко выраженные сезонные климатические колебания. | Температура ночью на 15-35°С ниже дневной. В ночное время выпадают обильные росы. |
Как видно из данных таблицы, условия в разных местах роста орхидей различаются довольно сильно.
Более мягкие переходы характерны для равнинных тропических дождевых лесов. Сезонные и суточные колебания параметров микроклимата почти не наблюдаются. В целом, условия почти «комнатные». Неудивительно, что орхидеи, происходящие из этих районов, являются самыми простыми в культуре и самой природе, как бы «адаптированные» для выращивания в комнатных условиях.
Орхидеи, растущие в других областях, культивировать несколько усложняются, потому что для их успешного роста и развития необходимы повторения природных условий (суточные и сезонные изменения). Это будет негативно сказываться на рост и развитие растения, скорее всего, оно не будет цвести. Вот почему при описании видов и родов орхидей, наиболее интересных для культивирования, обычно указывают их типичную естественную среду обитания. Это очень важная информация, на которую стоит обратить пристальное внимание.
В жизни орхидей есть два основных периода, правильное чередование которых является ключом к успешному культивированию почти всех их видов. Это периоды роста и отдыха.
В течение периода роста новые боковые побеги развиваются у симподиальных орхидей, а листья образуют моноподиальные.
После окончания видимого роста наступает период относительного отдыха. В этот период орхидеи не подвергаются никаким внешним изменениям (за исключением лиственных пород, которые листья отбрасывают), но это не означает, что растения находятся в неактивном состоянии.
Это очень важное время в жизни растения, в течение которого происходит не только «старение» тканей молодых листьев и побегов (они стают наиболее плотными и жесткими), но и другие более сложные физиологические процессы, связанные с распределением питательных веществ и подготовкой к новому росту. Внутри почек обновление симподиальных орхидей в это время происходит работа по заложению почек, стеблей, корней, листьев, а иногда соцветий следующего побега.
Период покоя у разных типов орхидей имеет различную продолжительность. У видов, происходящих из стран с влажным тропическим климатом, период отдыха обычно короткий, и новый рост может начаться почти сразу после завершения роста последнего побега или листа. У растений, растущих в районах с ощутимыми сезонными изменениями погоды, период отдыха может быть очень долгим и длиться до шести месяцев.
Чтобы уверенно выращивать орхидеи, необходимо знать, в каких условиях они нуждаются, и научиться правильно их соблюдать.
1.5 Биологические особенности рода фаленопсис – Phalaenopsis
Фаленопсис является эпифитным (иногда литофитным) травянистым растением семейства орхидеи из Юго-Восточной Азии, Филиппин и северо-восточной Австралии. В естественных условиях они живут во влажных равнинах и горных лесах на деревьях и лианах.
Этот род насчитывает около 70 видов. Моноподиальные растения с широкими 4-6 кожистыми листьями, листья вечнозелёные и имеют длину 5-30 см; и сильно укороченным стеблем. Рост растения происходит только в направлении вверх.
Из пазух между листьями растение выпускает воздушные корни с толстым слоем веламена, и цветоносы. Цветоносы пазушные, длинные, часто ветвящиеся, у многих видов с большим количеством довольно крупных цветков. Цветок напоминает по форме бабочку.
Многие представители рода и гибриды с их участием пользуются популярностью в цветоводстве, а также широко представлены в ботанических садах.
1.6 История открытия представителей рода фаленопсис– Phalaenopsis
На острове Амбон (Молуккас) немецким путешественником и натуралистом Георгом Румфом (1627-1702) был найден первый представитель этого рода.
В 1752 году на небольшом острове в окрестностях острова Тернате шведский пастор Петр Осбек нашел другое растение и отправил образец Карлу Линнею, который описал его в своей знаменитой работе «Виды растений» под названием Epidendrum amabilis – эпидендрум прелестный. Слово «эпидундрем» в переводе с древнегреческого означает «живущее на дереве».
В 1825 году на маленьком острове Малайского архипелага директор Лейденского ботанического сада Карл Блюме нашел еще одно растение. Исследуя джунгли в сумерках с полевым биноклем, он спутал орхидеи с ночными белыми бабочками. В память о своей ошибке Блюм назвал род Phalaenopsis, что означает «мотыльковоподобный» (греч. Phalania — «ночная бабочка», opsis — «сходство») [63].
1.7 Проблема охраны исчезающих видов рода фаленопсис – Phalaenopsis
Места обитания всех видов фаленопсисов находятся под сильным давлением человека. Во всех их средах обитания продолжается разрушение тропических лесов и их превращение в сельскохозяйственные угодья. Чрезмерный сбор растений для экспорта в соответствии с требованием коллекционеров орхидей подрывает число видов, растущих в сохранившихся естественных местообитаниях. Некоторые виды фаленопсиса известны в настоящее время только описаниями, сделанными более 100 лет назад.
Для защиты растений были приняты правила, регулирующие торговлю. Все виды рода Phalaenopsis включены в Приложение II Конвенции СИТЕС [64]. Цель Конвенции - обеспечить, чтобы международная торговля дикими животными и растениями не представляла угрозы для их выживания. Реальная проблема заключается не в торговле растениями, а в разрушении естественной среды обитания в тех местах, где они растут.
Глава 2. КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ ОРХИДНЫХ (ORCHIDACEAE)
В природе существуют два вида размножения: генеративное и вегетативное. Генеративное размножение включает: бесполое; половое размножение и половое воспроизведение; а так же семенное воспроизведение. Сравнительную характеристику типов размножения растений можно изучить в таблице 2.
Таблица 2
Сравнительная характеристика типов размножения растений
| Тип размножения | Генетическая основа | Основополагаю-щие процессы | Типы диаспор (т.е. зачатков новых особей) |
| Вегетативное | Исходная плоидность сохраняется. | Регенерация. | Фрагменты вегетативных органов, выводковые тела и почки. |
| Генеративное: | Двукратное изменение плоидности в ходе жизненного цикла | Мейоз (бесполое) Половой процесс (половое) | Мейоспоры Гаметы Семена и плоды |
Бесполое размножение отличается от вегетативного размножения тем, что в вегетативном размножении дочерняя особь, генетически идентичная материнскому растению (клон), обязательно получает фрагмент материнского организма, поскольку он сформирован из него; а при бесполом воспроизведении – не происходит.
Основой генеративного размножения является чередование двух ядерных фаз - диплоидных и гаплоидных. Это чередование происходит из-за двух альтернативных процессов – оплодотворением и мейозом. В растениях гаплоидная фаза, образующая гаплоидные гаметы, называется гаметофитом, а диплоидная фаза, которая образует гаплоидные споры, из которых развиваются гаметофиты, является спорофитом.
Гаметофит и спорофит могут быть одинакового строения (изоморфный жизненный цикл), так и отличаться друг от друга морфологически (гетероморфный жизненный цикл).
Отличие полового размножения от полового воспроизведения заключается в том, что в первом случае на гаметофите формируется единственный зародыш спорофита, а во втором — два или несколько. У большинства растений происходит половое воспроизведение [62].
2.1 Общие сведения о клональном микроразмножении растений
К вегетативному размножению также относят искусственный путь – клональное микроразмножение, который на сегодняшний день является чрезвычайно актуальным и используется в биотехнологии растений.
Микроклональное размножение (или клональное микроразмножение) представляет собой бесполое размножение растений в культуре клеток и тканей, в которых появляющиеся формы растений генетически идентичны исходному экземпляру (Тимофеева, 1989).
Согласно работе Батыгиной Т.Б. и Васильевой В.Е. «Размножение растений» (2002):
Этот метод включает выделение эксплантов из листовой ткани, высаживание стерильных эксплантов на питательную среду для образования каллуса, перенос каллуса на среду для индукции растений. Каллус – это недифференцированная растительная ткань, образующаяся на поверхности ран побегов или черенков в результате деления ближайших живых клеток.
Основателем микроклонального размножения является французский ученый Жорж Морель, который в 1960 году разработал этот метод для орхидей. Он использовал апикальную почку цимбидиума, одного из представителей этого сем. орхидеи, состоящей из конуса нарастания и двух или трех зародышей листьев, из которых при определенных условиях появились сферические образования называемые протокормами.
2.1.1 Типы клонального микроразмножения
Н. В. Катаева и Р. Г. Бутенко (1983) выделяют два принципиально различных типа клонального микроразмножения:
1. Активация уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля).
2. Индукция возникновения почек или эмбриоидов de novo:
а) образование адвентивных побегов непосредственно тканями экспланта;
б) индукция соматического эмбриогенеза;
в) дифференциация адвентивных почек в первичной и пересадочной каллусной ткани.
Фактически, микроклональное размножение может быть произведено разными способами. Основные типы:
Подавление апикального доминирования и развитие пазушных почек;
Микрочеренкование;
Образование микроклубней, микролуковиц:
Индукция возникновения адвентивных почек непосредственно тканями экспланта;
Получение каллусной ткани с последующей индукцией органогенеза или эмбриоидогенеза.
Массовое производство каллуса с последующим образованием побегов можно считать идеальным методом для крупномасштабного размножения, но в настоящее время существуют два серьезных недостатка, которые ограничивают использование этого подхода. Способность многих каллусов к регенерации побегов уменьшается или даже теряется в процессе культивирования и трансплантации каллусной ткани. В то же время количество полиплоидных, анеуплоидных и других генетически измененных клеток постепенно увеличивается и, следовательно, вероятность образования каллуса растений отличается от исходной родительской формы.
2.1.2 Преимущества клонального микроразмножения
Основные преимущества микроклонального размножения по сравнению с традиционными методами размножения растений:
Производство большого числа клонов;
Улучшение растений, т.е. оздоровление от микроплазменных, вирусных и нематодных инфекций, бактериальных и грибковых патогенов;
Максимальная скорость воспроизведения;
Уменьшение продолжительности процесса размножения;
Возможность доставки и легкость транспортировки;
Воспроизведение растений, трудно размножаемых традиционными методами;
Возможность выполнения работ в течение года;
Сокращение пространства, которое необходимо для выведения и развития эксплантов;
Сохранение гетерозисных гибридов растений;
Разведение и сохранение редких и исчезающих видов.
2.1.3 Этапы клонального микроразмножения
Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры.
2.Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2оС, +10оС).
4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
Стоит отметить, что химический состав питательной среды и ее физические свойства должны соответствовать задачам, которые среда выполняет на каждой стадии микроразмножения.
Добавление активированного угля оказывает благотворное влияние на рост побегов. Активированный уголь адсорбирует токсичные вещества, выделяемые эксплантом. В то же время уголь адсорбируется из окружающей среды и биологически активные вещества, что значительно снижает их первоначальную концентрацию.
Для большинства растений используются смеси почв в качестве субстратов в следующих соотношениях:
| торф: песок (3:1); | торф : песок : перлит (1:1:1). |
| торф : дерновая земля : перлит (1:1:1); | |
Торфяные горшочки или пикировочные ящики, в которых выращивают регенеранты, заполняют субстратом (заранее приготовленным).
При культивировании побегов относительная влажность воздуха в сосуде достигает 100%. Поэтому основная задача акклиматизации регенерированных растений ex vitro - создание относительно высокой влажности в первые дни после трансплантации, поскольку потери воды могут привести к гибели клонов. Создаются условия искусственного тумана для лучшего роста и развития растений.
Индийские ученые предложили несложный метод, который бы защищал от быстрого обезвоживания листовых пластин растений, которые были выращены способом in vitro, при их трансплантации в поле: листовые пластинки в течение периода акклиматизации следует обрабатывать распылением 50%-ным водным раствором глицерина или смесью парафина (жира) и диэтиловый эфир (1:1). Использование этого способа поможет избежать длительных и сложных процессов адаптации растений, привыкшим к условиям in vitro; и обеспечивая 100% выживаемость.
Через месяц после посадки те растения, которые укоренились, поливают солями Мурасиге – Скуга, Кнудсона, Кнопа, Чеснокова (в зависимости от вида растений) или комплексным минеральным удобрением.
По мере роста микроклоны высаживают в объёмные контейнеры со свежим субстратом. Дальнейшее культивирование приспособленных к условиям окружающей среды растений соответствует принятой агротехнике выращивания этого вида растений.
Факторы, которые влияют на эффективность микроклонального размножения растений:
Физиологические факторы.
Генетические особенности вида или случайные мутации.
Факторы гормональной природы.
Физические факторы.
Механические трудности микроклонального размножения.
2.1.4 Проблемы и перспективы клонального микроразмножения
Часто растения, размноженные методами культуры клеток и тканей, не всегда похожи на исходные материнские формы. Это может быть вызвано рядом причин, которые подразделяются на две категории:
1) краткосрочные изменения в развитии, так называемые эпигенетические эффекты;
2) генетические изменения, возникающие в результате генных или хромосомных мутаций.
Таким образом, в настоящее время для получения генетически гомогенных сеянцев предпочтительным методом воспроизведения in vitro является размножение пазушными побегами. Лаборатории, занимающиеся микроразмножением, по возможности, используют этот метод, и поэтому без особых трудностей они получают генетически однородный посадочный материал.
2.2 Введение в культуру использованием различных типов эксплантов
Способы распространения семян и выращивания растений в условиях in vitro рассматриваются как один из перспективных способов сохранения биологического разнообразия представителей семейства Orchidaceae. Работы в этом направлении, в том числе на орхидных умеренных широт, немногочисленны.
В настоящее время имеются данные по различным аспектам эмбриогенеза и постсеменного развития некоторых нетропических видов (Батыгина, 1983; Андронова, 1988), выявлены особенности строения семян, определяющие их всхожесть и жизнеспособность на искусственных питательных средах (Куликов, Филиппов, 1998), показаны асинхронность развития протокормов и растений in vitro (Андронова, 2007) и возможность их использования для реинтродукции и изучения последующего развития в природных условиях (Андронова, Ивасенко, 2007; Андронова,2007).
В ходе экспериментов использовали различные типы эксплантов׃ листья, верхнюю и среднюю части листовой пластинки с центральной жилкой и без нее, ткани стебля, пыльников, листочков околоцветника.
Для получения стерильных эксплантов использовали следующий режим стерилизации в растворе ПАВ, на начальных этапах 70 % этиловым спиртом и 15 % перекисью водорода в течение 25 минут, 1,5 и 2 мин соответственно (Шейко, Мусатенко, 2011), но позднее использовали раствор ПАВ, 2%-ый раствор 3D-септа и 3%-ый раствор перекиси водорода, в течении 25 минут, 12минут и 2минут соответственно.
Для посадки эксплантов Epipactis helleborine (L.) Crantz.C на питательную среду Шейко Е. А. и Мусатенко Л.И. использовали среду, содержащую минеральную основу среды Мурасиге-Скуге (МС) (25-30 мг/л сахарозы, 6,5 г/л агара) с добавлением 2,4-Д, ИМК и 6-БАП.
Перед стерилизацией рН питательной среды доводили до 5,6–5,9. Экспланты из листовых пластинок и из лепестков околоцветника пересаживали в темноте при температуре 24-26 С, участки побегов и пыльники – культивировали на свету при 10 – часовом освещении интенсивностью 1,5–2 кЛк и относительной влажности 60% и 24-26 ºС.
С использованием листовых пластинок и побегов с почками большое количество эксплантов подверглись некрозу и были не жизнеспособны. Выращивание листьев околоцветника Epipactis helleborine не дало положительных результатов. Они получили каллус, когда вводили в культуру пыльники, что было связано с их большим морфогенетическим потенциалом и определенной автономностью от материнского растения. В процессе введения этих растений в культуру программа компетентных клеток генеративных структур переключилась с гаметофитного пути на другой путь - спорофитный, что привело к образованию регенерирующего растения.
Полученный каллус, образовавшегося в культуре изолированных пыльников, называют термином «андроклинный каллус» (Круглова, 2009). Общественно распространенный термин «андрогенный каллус» несколько не приемлем, так как справедливо полагает Тырнов (2005), нужно различать понятия «андрогенез in vitro» и «андрогенез» (Круглова, Дубровная, 2011).
Добытый андроклинный каллус E. helleborine далее может развиваться по следующему пути: непрямой эмбриоидогенез – формирование эмбриоида, гемморизогенез – формирование почки и корня, геммогенез – формирование тканей (Kоniеczny et al., 2003; Rоdriguеs et al., 2004).
Считают, что ситуация осложняется тем фактом, что каллус происходит из одной клетки – микроспоры (или клетки пыльцевого зерна). В зависимости от условий выращивания, а именно от гормонального состава питательной среды; микроспора развивается (Круглова, 2005):
1) по пути формирования каллуса,
2) по пути формирования эмбриоида.
В полученном ими андроклинном каллусе были обнаружены небольшие клетки, находящиеся группами, с большими ядрами, котрые образуют меристематический очаг. Появление этих очагов приводило учёных к знанию того, что в каллусной ткани начинались процессы дедифференциации клеток.
2.2.1 Основные типы питательных сред для культивирования орхидных (Orchidáceae) in vitro
2.2.1.1 Модификация питательной среды Мурасиге-Скуга для культивирования листовых эксплантов и цветочных почек фаленопсиса (Phalaenopsis)
В среде МС для Фаленопсиса (Phalaenopsis Sp.) использовался состав стандартной среды МС на 0,5 л. С добавлением 1г на пол-литра активированного угля. Для изготовления 0.5 литра питательной среды для исследуемого растения, использовали минеральный состав среды МС, представленный в таблице 3.
Таблица 3
Состав стандартной среды Мурасиге – Скуга (МС)
| Компоненты | Среда, мг/л | Маточный раствор | Количество маточного раствора на 1л среды, мл | |
| Макросоли, г/л маточного раствора | ||||
| NH4NO3 | 1650 | 33 |
50 | |
| KN03 | 1900 | 38 | ||
| КН2РО4 | 170 | 3,4 | ||
| MgS04·7H20 | 370 | 7,4 | ||
| Кальций, г/200 мл маточного раствора | ||||
| СаС12 | 440 | 8,8 | 10 | |
| 3. Микросоли, мг/100 мл маточного раствора | ||||
| Na2Mo04·2H20 | 0,25 | 25 | 1 | |
| Н3ВО3 | 6,2 | 620 | ||
| MnS04·4H20 | 22,3 | 2230 | ||
| ZnS04·7H20 | 8,6 | 860 | ||
| KI | 0,83 | 83 | ||
| CuS04•5H20 | 0,025 | 2,5 | ||
| CoCl2•6H20 | 0,025 | 2,5 | ||
| Хелат железа, г/л маточного раствора | ||||
| FeS04•7H20 |
| 5,57 | 5 | |
| Nа2ЭДТА•2Н20 |
| 7,45 |
| |
| Витамины и органические соединения | ||||
| Тиамин | 0,1 |
| Витамины и органические соединения вводить в день приготовления | |
| Пиридоксин | 0,5 |
| ||
| Никотиновая кислота | 0,5 |
| ||
| Мезоинезит | 100 |
| ||
| Глицин | 2 |
| ||
| ИУК | В зависимости от экспланта |
| среды (рН=5,6-5,8) | |
| Кинетин | 0,2 |
| ||
| Сахароза г/л | 30 |
| ||
| Агар г/л | 7 |
| ||
Следует отметить, что ткани фаленопсиса высвобождают фенольные соединения, которые выходят в среду, после чего ткань быстро темнеет и гибнет. Поэтому многие авторы советуют пересаживать ткани каждые 10 дней. Предотвратить частые пересадки помогает добавление мелко измельчённого активированного угля в питательную среду, который адсорбирует токсичные выделения. Кроме того, листовые пластинки советуют не разрезать на отдельные сегменты, а осторожно отрывать для уменьшения раневой поверхности и целые пластинки листа укладывать на среду МС с 0,1 мг/л кинетина и 0,1 мг/л ИУК (Черевченко, 1986). Но при посадке в пробирки это не всегда возможно, кроме того, это очень затратно в плане исходного материала.
2.2.1.2 Среды Т.М. Черевченко и Г.П. Кушнир
В работе Т.М. Черевченко и Г.П. Кушнира (1986) для микроразмножения орхидей представлены следующие среды:
Среда Хеллера:
| KCl – 750 | MgSO4 •7H2O – 250 |
| NaNO3 – 600 | MnSO4•4H2O – 0,1 |
| NaH2PO4•H2O – 125 | FeCl3•6H2O – 1 |
| ZnSO4•7H2O – 1 | H3BO3 – 1 |
| CuSO4•5H2O – 0,03 | NiCl2•6H2O – 0,03 |
| AlCl3 – 0,03 | KI – 0,01 |
| Сахароза - 20000 |
|
рН выравнивают до 5,6-5,8
Рекомендуется для выращивания тканей многих видов орхидей.
Среда Томпсона:
| Мочевина – 540 | (NH4)2HPO4 – 345 |
| Mg SO4•7H2O – 369 | FeSO4 – 25 |
| Уксуснокислый кальций – 79 | Уксуснокислый калий – 392 |
| Na2ЭДТА – 37 | MnCl2 – 2,2 |
| CuSO4 – 0,23 | ZnSO4 – 0,29 |
| H3BO3 – 1,86 | NH4MoO4 – 0,035 |
| Сахароза – 30000 |
|
рН выравнивают до 5,6
Рекомендуется для наземных и эпифитных видов орхидей.
Среда Мореля:
| (NH4)2NO3 –1000 | Ca(NO3)2•4H2O – 500 |
| KCl – 1000 | MgSO4•7H2O – 125 |
| KH2PO4 – 125 | Микроэлементы по Хеллеру – 1 мл |
| Гомогенат банана – 40000 | Сахароза – 20000 |
рН выравнивают до 5,5-5,6
Применяется для протокормов цимбидиума, каттлеи, дендробиума, ванды, мильтонии и других орхидей.
Среда Вацина и Вента:
| KH2PO4 -250 | Ca3(PO4)2 -200 |
| (NH4)2SO4 – 500 | Винокислое железо – 28 |
| Mg SO4•7H2O – 250 | MnSO4•7 H2O – 7,5 |
| KNO3 – 525 | Сахароза – 20 000 |
рН выравнивают до 5,6
Рекомендуется для тканей цимбидиума, каттлеи, фаленопсиса и ванды.
Среда Кнопа:
| Лимоннокислое железо – 10 | L-Изолейцин – 13,2 |
| Транскоричная кислота – 14,8 | Тиамин – HCl – 0,4 |
| KNO3 – 125 | CuSO4 – 0,040 |
| MgSO4• 7 H2O – 125 | ZnSO4•7 H2O – 0,033 |
| Ca(NO3)2•4 H2O –500 | Сахароза – 20000 |
| KH2PO4 – 125 | БАП – 0,2 |
| H3BO4 – 0,056 | Мезоинозит – 100 |
| MoO3 – 0,016 |
|
pH выравнивают до 5,0-5,5
Используется для почек цветоносов фаленопсиса.
2.2.2 Влияние факторов питательной среды на эффективность прорастания семян
Методы in vitro с использованием питательных сред позволяют преодолеть трудности, связанные с подращиванием сеянцев орхидных и проращиванием семян. Однако в условиях оранжерей сеянцы тропических и субтропических орхидей вступают в генеративную фазу лишь через 5 - 8 лет после прорастания семян.
Н. А. Астапенко изучал влияние факторов питательной среды на процесс прорастания семян с целью его оптимизации.
Материалом исследований Н. А. Астапенко служили семена из зрелых плодов Cephalanthera damosonium (Mill.) Druce. Астапенко Н.А. выбрал 3 % перекись водорода, и выдерживал в ней семена в течение 3 суток перед посадкой.
После обработки он промывал семена стерильной дист. водой. В исследованиях он использовал несколько вариантов питательной среды Кнудсона и изменённую среду FN. Изменённые питательные среды Кнудсона содержали активированный уголь (1 г/л), гумат натрия (50 мл/л) и они различались по концентрации сахарозы (Кнудсон С – 20 г/л, Кнудсон С-1 – 10 г/л, Кнудсон С-2 – 50 г/л).
Выращивание семян проводили в специализированных сосудах в термостате с температурой 22,5+2,5 °С, а затем в фитолюминистате ФСЛ-В с освещением 1-3 кЛк при температуре от 22,5+2,5 °С с фотопериодом 16 /8. Компоненты используемых вариантов питательных сред представлены в таблице 4.
Таблица 4
Компоненты используемых вариантов питательных сред
| Компонент среды | Питательная среда | |||
| Кнудсон С | Кнудсон С-1 | Кнудсон С-2 | FN-мод. | |
| Ca(NO3)2•4H2O | 1 000 мг/л | 44 мг/л | ||
| (NH4)2SO4 | 500 мг/л | – | ||
| KH2PO4 | 250 мг/л | 20 мг/л | ||
| MgSO4•7 H2O | 250 мг/л | 20 мг/л | ||
| FeSO4•7 H2O | 27,8 мг/л | 14 мг/л | ||
| MnSO4•4 H2O | 7,5 мг/л | – | ||
| Гумат натрия | – | 50 мг/л | – | |
| Активированный уголь | – |
| ||
| Сахароза | 20 000 мг/л | 10 000 мг/л | 50 000 мг/л | 1 000 мг/л |
| Агар | 8 000 мг/л | |||
| NH4NO3 | – | 40 мг/л | ||
| KCl | – | 20 мг/л | ||
| Трилон «Б» | – | 19 мг/л | ||
| Гидролизат казеина | – | 700 мг/л | ||
| Сухой дрожжевой экстрат | – | 800 мг/л | ||
Чтобы оценить влияние факторов оптимизации питательной среды на скорость прорастания семян, семена отбирали каждый день с первого дня культивирования для подготовки временных препаратов. Статистическая обработка результатов экспериментов проводилась в соответствии с общепринятыми методами.
Данные представленные в таблице 5 были получены в результате эксперимента, и они показывают, что значительное влияние оказывает на скорость прорастания семян концентрация сахарозы в питательной среде, т. е. на время наступления определенного этапа прорастания и его длительность.
Таблица 5
Влияние концентрации сахарозы на скорость прорастания семян (количество набухших семян от общего количества высеянных на среду, в %)
| Вариант питательной среды | Сутки культивирования | |||||
| 2 | 5 | 10 | 15 | 20 | 25 | |
| Кнудсон С | 10% | 25% | 35% | 50% | 70% | 100% |
| Кнудсон С-1 | 10% | 25% | 50% | 100% |
|
|
| Кнудсон С-2 | 2% | 5% | 7% | 10% | 15% | 15% |
| FN-мод. | 10% | 25% | 50% | 70% | 100% |
|
Рассуждая о влиянии различных концентраций сахарозы на прорастание семян, мы приходим к выводу, что среда Кнудсона С-1 обеспечивала высокую скорость прорастания за короткий промежуток времени. Итак, уже на 7-10 день культивирования, 50% семян набухло, и на 15-й день произошло формирование протокормов.
Наимение удобный вариант для выращивания – Кнудсон C-2, поскольку прорастание семян было 30%, а на проращивание требовалось больше времени. Из этого следует, что для изготовления среды наибольший приоритет принадлежит среде Кнудсон С-1, если же не будет такой возможности то, использовать среду FN- мод., и среду Кнудсон С. В редком случае советуют использовать среду Кнудсон С-2.
На онтогенез орхидных так же влияют неорганические компоненты среды МС. Так при варьировании концентрации минеральной основы среды выявлено, что рост побегов был максимальным на полной среде, а корнеобразование и формирование псевдобульб – на 1/2 среды МС (Фатеева, Мокшин, Лукаткин, 2013).
Фатеева Е. В., Мокшин Е. В., Лукаткин А. С. изучали влияние в культуре in vitro концентрации минеральной основы среды Мурасиге-Скуга (МС) и регуляторов роста (РР) – синтетических аналогов цитокининов (кинетина, 6-бензиламинопурина (6-БАП), тидиазурона) и ауксина (индолил-3-уксусной кислоты (ИУК)) на органогенез цимбидиума гибридного.
При варьировании концентрации минеральной основы среды выявлено то, что рост побегов был наибольшим на полной среде, а корнеобразование и формирование псевдобульб – на 1/2 среды МС.
При исследовании влияния различных препаратов цитокининового типа в сочетании с ауксиновым препаратом на органогенез цимбидиума показано лучшее формирование псевдобульб в вариантах с использованием 2,5 мг/л кинетина + 0,5 мг/л ИУК (по количеству) и 0,1 мг/л кинетина + 0,5 мг/л ИУК (по размеру псевдобульб). Количество формирующихся побегов было максимальным на среде с внесением 10-4 моль/л тидиазурона + 0,5 мг/л ИУК, тогда как побеги максимальной длины формировались в варианте с добавлением 6-БАП +ИУК (по 0,5 мг/л каждый).
Однако информация о влиянии регуляторов роста на каллусогенез и органогенез орхидей и выбор оптимальных концентраций довольно противоречивы. Очевидно, что для каждого вида необходимо выбрать индивидуальные параметры для состава питательной среды, регуляторов роста и т. д. В связи с этим можно предположить, что использование регуляторов роста будет интенсивно стимулировать рост и размножение побегов у цимбидиума.
Для клонального микроразмножения использовали псевдобульбы, а также части побегов. Экспланты высаживали на питательную среду МС, содержащую различные концентрации регуляторов роста: 6-БАП (0.1–4.0 мг/л), Рибав-Экстра (10-2–10-7%); для сравнения использовали вариант без регуляторов роста.
Минимальные и максимальные дозы регулятора в среде приводили к ощутимому замедлению процессов роста, в результате длина побегов достоверно не отличалась от варианта без регулятора.
Использование естественного регулятора Рибав-Экстра показало, что препарат не спровоцировал обильного образования псевдобульб по сравнению с вариантом без регулятора, а при концентрациях 10-3–10-4% они образовывались в совсем малых количествах.
Небольшие концентрации в меньшей степени стимулировали рост побегов. Активация ростовых процессов цимбидиума при действии данного регулятора обусловлена тем, что в препарат состоит из смеси аминокислот, которые регулируют процессы роста и развития проростков; а также ряд биологически активных соединений, влияющих на деление клеток и рост органов.
Сравнение показало, что рост побегов был максимальным при использовании препарата Рибав-Экстра, за которым следовали 6-БАП.
В ходе проведенных опытов по влиянию регуляторов роста на органогенез и рост Cymbidium hybridum Hort. «Memoria Amelia Earhart» в культуре in vitro выявлен положительный эффект применения данных препаратов в определенных концентрациях:
1) Рибав-Экстра в концентрации 10-4% способствовало интенсивному росту побегов у цимбидиума;
2) 6-БАП стимулировал рост побегов цимбидиума, особенно при концентрациях 1.0 и 3.0 мг/л.
2.2.3 Начальные этапы роста и развития в культуре in vitro
Для посева использовали незрелые семена пальчатокоренника мясо-красного (Dactylorhiza incarnatа), которые собрали с разных растений. Семена в коробочках слипались друг с другом, имели белый с бежевым оттенком цвет.
Посевы проводили в ламинаре на питательной среде Кнудсона с микроэлементами, гуматом натрия (Черевченко, Кушнир, 1986) и активированным углем. Невскрытые коробочки стерилизовали в течение 15 минут в 20% растворе гипохлорита натрия, с последующей четырехкратной промывкой в стерильной дистиллированной воде. Плоды раскрывали стерильными инструментами над питательной средой и равномерно распределяли семена по ее поверхности.
До появления побега сеянцы находились в темноте, после – их помещали в климатическую камеру с фотопериодом 12 часов. Температура культивирования составляла от 22°С до 24°С. Пересадку сеянцев проводили через 8-15 мес. после посева семян на питательную среду. Морфометрические параметры определяли дважды: через 8 месяцев культивирования (измеряли линейные размеры протокорма), через 15 месяцев – длины побега и корня.
Установлено, что через месяц после посева на питательную среду семена D. Incarnatа меняют окраску с белой на светло-зеленую и набухают, очевидно, вследствие увеличения размеров зародыша.
Появляющиеся всходы на ранних этапах роста практически не различаются по размерам. Их заметный рост наблюдается в течение последующих двух месяцев. Всасывающие волоски становятся хорошо различимы на развивающихся растениях в начале четвертого месяца культивирования.
На восьмом месяце культивирования сеянцы D. incarnata представляли собой бесхлорофилльные образования различной формы. Они были распределены А. В. Сидоровым и О. А. Маракаевым по четырем морфологическим типам – каплевидные, шаровидные, веретеновидные и эллипсовидные, соотношение которых составляло 3:2:2:1.
У крупных сеянцев отмечены большие темпы роста: их длина и ширина более чем в 2 раза выше, чем у мелких экземпляров. Длина - самая вариативная функция, чем ширина. Более того, во второй группе сеянцев коэффициент вариации морфометрических параметров выше по сравнению с первой.
Занимательно, что наибольшие размеры были характерны для образцов каплевидной формы. У них также была почка в виде бугорка на апикальной части, что указывает на более высокую скорость их развития. После того, как рост завершен, саженцы растут в толщину на некоторое время, затем побег начинает растягиваться.
Выявлено, что растения с низкими показателями роста формировались из скученно расположенных на питательной среде мелких сеянцев эллипсовидной, веретеновидной и шаровидной форм. Средняя длина их корня на 35% превышала среднюю длину побега. Растения второй группы формировались из крупных сеянцев, преимущественно каплевидной формы. Соотношение степени развития их побега и корня отличалось от такового для растений первой группы. Наибольшие размеры были характерны для побега этих растений, средняя длина которого на 10% превышала среднюю длину корня.
Это приводит к тому, что семенное потомство одного и того же года репродукции, оказывается способным переходить в следующее возрастное состояние в разные годы вегетации. Это особенно важно для возобновления и поддержания естественных ценопопуляций, поскольку из-за неравномерного роста и развития создается банк проростков. В связи с этим гетерогенность темпов роста молодых растений, вероятно, может рассматриваться как адаптивная характеристика исследуемого вида.
В культуре in vitro разница в размерах проростков частично может быть обусловлена их расположением друг относительно друга, а также степенью контакта между всасывающими волосками и питательной средой.
Было отмечено, что мелкие экземпляры располагаются на питательной среде скученно, их всасывающие волосы переплетаются друг с другом и часто не достигают поверхности среды. Большие саженцы были расположены на питательной среде одиночно, и они были закреплены их всасывающими волосками. Независимо от скорости роста побегов и корней после 15 месяцев культивирования были получены растения с достаточно развитой системой органов.
Таким образом, данные, представленные в этом исследовании, указывают на неравномерный рост и развитие семенного потомства D. incarnata в культуре in vitro. Выявленные различия могут быть связаны с генетической гетерогенностью семян, используемых в работе, и демонстрируют адаптивную способность вида к условиям роста. Показано, что форма рассады на ранних стадиях развития связана с их размером, расположением на питательной среде и степенью контакта с ней. После 15 месяцев культивирования in vitro можно получить развитые образцы D. incarnata, у которых есть корень и побег.
2.2.4 Особенности адаптации регенерантов к условиям ex vitro
Как упоминалось ранее, одним из способов сохранения редких видов является получение большого количества растений в культуре in vitro и выращивание на территории ботанических садов и в естественных растительных сообществах. Но актуальной проблемой остается адаптация регенерантов к условиям ex vitro, как в горшечной культуре, так и в открытом грунте.
Сейчас известны примеры проведения таких работ для некоторых видов орхидных, однако они немногочисленны, и сведения о результатах таких работ очень ограничены (Batygina, Makoveychuk, 1994, Steward, 1998, Ramsay, Steward, 1998, Ramsay, Dixon, 2003, Batygina, Bragina, 2007).
Все исследуемые растения имели моноподиальный тип побега. Начиная со второго года после посадки, у некоторых представителей отметили переход к симподиальному типу побега. Однако это наблюдалось менее чем у половины исследованных растений. Следовательно, у некоторых экспериментальных растений моноподиальный тип нарастания побега сохранялся необычно долго. Условия в резервуарах для культивирования приводят к образованию растений, которые имеют аномалии в анатомической структуре листа и развитии устьичного аппарата, что вызывает нарушение наличия воды и часто приводит к почти 100% смерти растений в тепличных или полевых условиях.
Проростки и клоны выращивали в конических колбах Эрленмейера объемом 250 мл. Ёмкости с растениями размещали в фитотроны – помещения со стеклянными стеллажами при искусственном освещении интенсивностью 2000 Лк, фотопериод 12 ч, температурой 22-260С, влажностью воздуха 70%.
В работе авторы использовали наиболее употребляемые для культивирования орхидных агаризированные питательные среды Мурасиге-Скуга (МС) и Кнудсона (КПГУ) с минимальными количествами регуляторов роста и физиологически активных веществ.
Когда семена посеяли на агаризованные среды, на 45-й день после посева наблюдались первые признаки прорастания (набухание семян). Через 15-20 дней эмбрионы начали приобретать зеленый цвет.
Формирование первых протокормов E. Barbata было зафиксировано на 102 день. В возрасте 150 дней апикальная часть протокориа была отмечена различными апикальными точками роста, которые начали формировать первые листья.
Появление первых корней у саженцев Eryodes barbata происходило почти одновременно с развитием побега. На более развитых образцах при визуальных наблюдениях образование первых корней наблюдалось на 160-й день.
В возрасте 720 дней первая партия растений была переселена для адаптации к тепличным условиям. В то же время у каждого рассады было в среднем два хорошо развитых фотосинтезирующих листа и по паре корней, средняя высота растений составляла около 30 мм.
Т.о., работа Т. М. Черевченко, Л. И. Буюна и Р. В. Иванникова показала, что при переносе из культуры in vitro в тепличные условия листья ювенильных растений E. barbata имеют структуру поверхности, характерную для взрослых растений, что может указывать на применимость технологии размножения и культивирование орхидеи in vitro.
В качестве метода повышения эффективности акклиматизации воспроизводимых in vitro растений в условиях тепличной культуры применялось постепенное снижение влажности воздуха в теплице.
Глава 3. МЕТОДИКА ПРОВЕДЕНИЯ РАБОТЫ
В качестве модельного объекта было выбрано растение рода Фаленопсис (Phalaenopsis spp.)
В in vitro используются апексы верхушечных и боковых почек (точек роста), кончиков корней (особенно проростков). Апикальная меристема — группа меристематических (образовательных) клеток, организованных в ростовой центр, занимающая терминальное положение в побеге или корне и обеспечивающая образование всех органов и первичных тканей. Верхняя часть апикальной меристемы представлена инициалями (единственной клеткой у хвощей и многих папоротников и многоклеточной структурой у семенных растений). Ближайшие производные инициальных клеток часто выделяют в зону протомеристемы. Вслед за ней лежат ткани, уже частично дифференцированные, но всё ещё находящиеся в меристематическом состоянии, которые относят к частично детерминированной первичной меристеме.
3.1 Введение растений в культуру
В качестве эксплантов в данной работе использовались семена, молодые листья, корни, цветоносы и цветочные почки.
Заранее готовили 0,5 л. питательной среды, содержащей минеральную основу среды МС, 1 г. активированного угля, 2 мг/л 6-БАП и 1 мг/л ИУК для листьев, цветоносов и цветочных почек. Для семян использовали 1 мг/л 6-БАП и 0,5 мг/л ИУК. pH выравнивали до 6,5. Среду разливали по пробиркам и колбам, с последующей стерилизацией в автоклаве.
Место среза листьев, стеблей и корней обрабатывали стерильным воском с добавлением порошка цефазолина.
После перемещали исходный материал в специальные кассеты, их промывали под проточной тёплой водой (30о С) 40 минут и периодически перемешивая кассеты. Затем кассеты с исходным материалом помещали в раствор ПАВ (хозяйственного мыла или бытового ПАВ) с встряхиванием в шейкере 25 минут.
После чего кассеты промывали стерильной водой. Затем помещали на 12 минут в стакан с 2% раствором 3D - септа периодически помешивая.
Средство «3D-Септ» представляет собой состав общего стерилизующего действия, сочетает противовирусные и антимикробные свойства. В состав в качестве действующих веществ (ДВ) входит алкилдиметилбензиламмония хлорид (ЧАС) – 8,5%, дидецилдиметиламмония хлорид (ЧАС) – 4%, а также неионогенные поверхностно-активные вещества и натуральные терпеновые масла цитрусовых растений. рН 1% водного раствора средства 7,0.
После чего кассеты с материалами перемещали на 2 минуты в 3% раствор перекиси водорода. Далее кассеты промывали в четырёх порциях стерильной воды время от времени помешивая.
Подробно последовательность и продолжительность этапов обработки представлена в таблице 6.
Таблица 6
Последовательность и продолжительность этапов обработки
| Исходный материал | ПАВ (мин) | 3D–септ 2% (мин) | Н2О2 3% (мин) | Промывка стер. водой *4 |
| Молодые листья | 25 | 12 | 2 | 10 |
| Цветочные почки | 20-25 | 10-15 | 2 | 10 |
| Корни | 20-25 | 12 | 2 | 10 |
| Семена | 25-30 | 15 | 5 | 10 |
Последующие действия проводились в ламинар-боксе. Перед началом работы У.Ф. лампы и вентиляторы включали за 30 минут до начала работ в ламинар-боксе. Далее следовала подготовка рабочего места: обработка рабочего места 75% спиртом, расставили материалы и оборудование на рабочий стол.
Далее следовала посадка стерильного материала в пробирки и колбы со средой с использованием микрошприцов с цитокининовой пастой для листьев и цветовых почек.
После посадки материала, ватно-марлевые пробки колб и пробирок закрывали кусочками целлофана, зафиксировав их серными резинками. Подписали CD – маркером число высадки, инициалы оператора и наименование культуры.
Разместили пробирки в штативы, в шахматном порядке, чтобы свет падал равномерно, и перенесли в светоустановку.
Дальнейшее культивирование производилось с фотопериодом 16/8 и освещенностью около 5 кЛк.
Выбраковку проводили через 3-4 недели.
3.2 Приготовление и использование пасты содержащей цитокинин
Для стимулирования образования адвентивных точек роста часто используют гормональные пасты. Они препятствуют распространению фитогормона по всему объему среды, и действуют локально. Пасты содержащие цитокинин производятся промышленностью, но доступны для приготовления в лаборатории.
Растворяли навеску цитокинина в минимально возможном количестве этилового спирта (96%), до получения однородного раствора или мелкой взвеси, из расчета 10мг на 1мл пасты.
Расплавляли ланолин или вазелин в маленьком бюксе на магнитной мешалке с нагревателем или погружая емкость в горячую воду, при температуре около 45-50оС, вливали концентрат цитокинина и тщательно промешивали.
Автоклавировали стандартным методом в вертикальном бюксе, закрытом ватно-марлевой пробкой, и завернутым в бумагу (необходимо т.к. весь этанол должен испариться). Стеклянную крышку от бюкса автоклавировали в отдельной упаковке (она позже нужна, чтобы закрыть бюкс после стерилизации).
На первых этапах использовали аналог микробиологической петли с диаметром отверстия около 1,5мм. Прокаливали до ручки в пламени спиртовки, остужали о стенку сосуда с пастой, и брали еще теплой петлей, шарик пасты, поворачивая ее.
Позднее использовали цельностеклянные микрошприцы. Наносили на поверхность экспланта шарик пасты, и делали прокол насквозь стерильной медицинской иглой, частично нарушив покровы экспланта.
Эксплант поместили на поверхность среды, чтобы цитокининовая паста осталась на границе сред. Выращивали зеленые экспланты при стандартных условиях.
Глава 4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В литературе встречается множество методик стерилизации эксплантов при введении в культуру in vitro, но очевидно, большинство из них в исходном виде не применимы для объекта исследования по разным причинам. Была предпринята попытка оптимизации методики введения растений в культуру, для выявления максимально эффективных дезинфектантов, типов исходного материала и его экспозиции в тех или иных растворах.
4.1 Выбор дезинфектантов для стерилизации эксплантов при введении в культуру in vitro
Применялись несколько стерилизующих агентов:
гипохлорид натрия,
этиловый спирт,
растворы ПАВ (раствор хозяйственного мыла и раствор жидкого мыла),
3D-септ,
перекись водорода.
Для получения стерильных эксплантов использовали следующий режим стерилизации в растворе ПАВ, на начальных этапах 70 % этиловым спиртом и 15 % перекисью водорода в течение 25 минут, 1,5 и 2 минуты соответственно (Шейко, Мусатенко, 2011) , позднее использовали раствор ПАВ, 2%-ый раствор 3D-септа и 3%-ый раствор перекиси водорода, в течении 25 минут, 12 минут и 3 секунды соответственно. Выбор протоколов стерилизации листовых пластинок фаленопсиса (Phalaenopsis) можно рассмотреть в таблице 7.
Таблица 7
Протоколы стерилизации
| Название дезинфе-ктанта | С р-ра, % | Протокол № | |||
| I | II | III | IV | ||
| ПАВ | - | 25 мин | 25 мин | 25 мин | 25 мин |
| NaOCl | 5% | - | 10 мин | - | - |
| 10% | - | - | 7 мин | - | |
| 3D-септ | 2% | - | - | - | 12 мин |
| C2H5OH
| 70% | 2 мин | 20-30 сек | 20-30 сек | - |
| 15% | 2 мин | - | - | - | |
| H2O2 | 3% | - | 3 сек | 3 сек | 3 сек |
Первый протокол стерилизации (I). На первоначальных этапах при использовании следующего порядка стерилизации (или первый способ стерилизации (I)): раствор ПАВ (25мин)→70% этиловый спирт (2мин) → 15% раствор перекиси (2мин).
В результате стерилизации первым методом (IA) было получено 80,49% выбраковки по нарушению асептики и 90,24% выбраковки по нежизнеспособности. В течение некоторого времени при использовании этого же метода (IБ) в результате получалось 63,16% выбраковки по причине нарушения асептики и 52,63% выбраковки по нежизнеспособности. Данные представлены в таблице 8. В графическом представлении с данными можно ознакомиться на рис. 1.
Второй протокол стерилизации (II). Использовали следующий порядок стерилизации (второй способ стерилизации (II)): раствор ПАВ (25мин)→5% раствор NaOCl (10мин)→70% этиловый спирт (20-30 сек) → 3% раствор перекиси (3 сек).
В результате стерилизации вторым методом было получено 55,88% выбраковки по нарушению асептики и 38,24% выбраковки по нежизнеспособности (см. рис.1 и табл. 8).
Третий протокол стерилизации (III). Использовали следующий порядок стерилизации (третий способ стерилизации (III)): раствор ПАВ (25мин)→10% раствор NaOCl (7мин)→70% этиловый спирт (20-30 сек) → 3% раствор перекиси (3 сек).
В результате стерилизации третим методом было получено 49,02% выбраковки по нарушению асептики и 29,41% выбраковки по нежизнеспособности (см. рис.1 и табл. 8).
Четвёртый протокол стерилизации (IV). Использовали следующий порядок стерилизации (четвёртый способ стерилизации (IV)): раствор ПАВ (25мин)→ 2% раствор 3D-септа (12 мин) → 3% раствор перекиси (3 сек).
На данном этапе при использовании четвёртого метода получили 31,91% по нарушению асептики и 10,64% выбраковки по нежизнеспособности (см. табл. 8 и рис. 1).
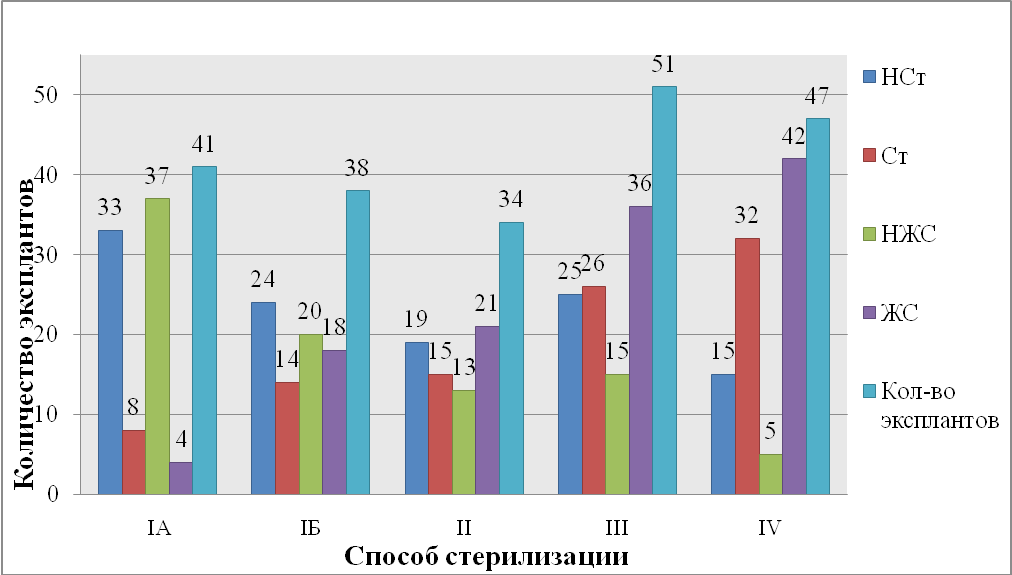
Рис. 1. Стерильность и жизнеспособность в зависимости от способа стерилизации
Где НСт. – нестерильные экспланты,
Ст. – стерильные экспланты,
НЖС – нежизнеспособные экспланты,
ЖС – жизнеспособные экспланты,
Кол-во эксплантов – число эксплантов, вводимое в культуру в данный период.
Таблица 8
Стерильность и жизнеспособность в зависимости от способа стерилизации эксплантов
|
| стерильность нарушена | Стерильные | Нежизне-способные | Жизне-способные | Кол-во эксплантов | ||||
| % | число | % | число | % | число | % | число | ||
| IА | 80,49 | 33 | 19,51 | 8 | 90,24 | 37 | 9,76 | 4 | 41 |
| IБ | 63,16 | 24 | 36,84 | 14 | 52,63 | 20 | 47,37 | 18 | 38 |
| II | 55,88 | 19 | 44,12 | 15 | 38,24 | 13 | 61,76 | 21 | 34 |
| III | 49,02 | 25 | 50,98 | 26 | 29,41 | 15 | 70,59 | 36 | 51 |
| IV | 31,91 | 15 | 68,09 | 32 | 10,64 | 5 | 89,36 | 42 | 47 |
В первом случае при использовании первого способа стерилизации из 41 экспланта жизнеспособными оказались 4 (9,76%), остальные оказались нежизнеспособными (90,24%); среди нежизнеспособных 37 эксплантов, остались стерильными лишь 8 эксплантов (19,51%).
Во втором случае при использовании первого способа стерилизации из 38 эксплантов: жизнеспособные - 18 (47,37%); нежизнеспособные - 20 эксплантов (52,63%), среди них остались стерильными лишь 14 эксплантов (36,84%) это на 17,33% больше, чем при предыдущем случае. Это вероятнее всего ткани исходного материала были более старыми, и причиной стала внутренняя инфекция.
При использовании второго способа стерилизации из 34 эксплантов: жизнеспособные - 21 (61,76%); нежизнеспособные - 13 эксплантов (38,24%), среди них остались стерильными 15 эксплантов (44,12%) это на 7,28% больше, чем при использовании первого метода.
При использовании третьего способа стерилизации из 51 экспланта: жизнеспособные - 36 (70,59%); нежизнеспособные - 15 эксплантов (29,41%), среди них остались стерильными 26 эксплантов (50,98%) это на 6,86% больше, чем при использовании второго метода и на 14,14% больше, чем при использовании первого метода.
При использовании четвёртого способа стерилизации из 47 эксплантов: жизнеспособные - 42 (89,36%); нежизнеспособные - 5 эксплантов (10,64%), среди них остались стерильными 32 экспланта (68,09%) это на 17,11% больше, чем при использовании третьего метода, на 23,97% больше, чем при использовании второго метода и на 31,25% больше, чем при использовании первого метода.
При использовании способа IV выход стерильных и жизнеспособных эксплантов выше.
4.2 Оценка жизнеспособности эксплантов
Были попытки использовать в качестве исходного материала листья, корни, цветочные почки и семена орхидеи фаленопсис (Phalaenopsis). Лучший результат показало введение в культуру с использованием ювенильного материала (семян). Успешное получение стерильной культуры обусловлено вероятнее всего тем, что семена находились внутри коробочки, которая была закрыта, и качественно простерилизована. Лучшую всхожесть показали семена, находящиеся в зеленой, нераскрывшейся коробочке. Семена из вскрывшейся коробочки имели нулевую всхожесть (на момент написания работы они более 3 месяцев находились на питательной среде, которая сохранилась стерильной, и признаков прорастания не наблюдалось).
Чуть худшую жизнеспособность показали молодые цветочные почки, лучшую жизнеспособность имели молодые почки. Листовые экспланты удалось использовать в качестве исходного материала только на среде для получения каллуса, содержащей 2,4-Д и антибиотик.
Корневые экспланты не демонстрировали каллусообразования или органогенеза независимо от состава сред и протоколов стерилизации.
Установленные факты говорят в пользу того, что для введения в культуру орхидеи Phalaenopsis целесообразнее использовать ювенильный материал, в частности семена в невскрытой коробочке. Такой способ избавляет от необходимости глубокой стерилизации живых растительных тканей, и, как следствие, растительные образцы не подвергаются дополнительному стрессу.
4.3 Влияния питательной среды на жизнеспособность эксплантов
В работе применялось пять типов сред представленных в таблице 9.
Таблица 9
Используемые типы сред для введения орхидеи Phalaenopsis в культуру
| № среды | Название среды | Особенности в составе питательной среды |
| среда 1 | МС для бегоний | 0,5 мг/л - ИУК; 1 мг/л - БАП |
| среда 2 | среда для получения каллуса у бегоний | 1 мг/л - 2,4-Д; 0,2 мг/л - БАП |
| среда 3 | МС для органогенеза фаленопсиса | 2 мг/л 6-БАП и 1 мг/л ИУК |
| среда 4 | среда для получения каллуса фаленопсиса | 0,01 мг/л - 2,4-Д; 0,05 мг/л - 6БАП |
| среда 5 | среда с цефазолином, для получения каллуса фаленопсиса | 0,01 мг/л - 2,4-Д; 0,05 мг/л - 6БАП и 20 мг/л цефазолина |
Данные зависимости стерильности и жизнеспособности от состава среды представлены в таблице 10.
Таблица 10
Стерильность и жизнеспособность в зависимости от типа среды
|
| жизнеспособные | стерильные | Всего эксплантов | Ст.,% | Ж.,% |
| среда 1 | 0 | 0 | 6 | 0,00 | 0,00 |
| среда 2 | 0 | 2 | 6 | 33,33 | 0,00 |
| среда 3 | 5 | 11 | 11 | 100,00 | 45,45 |
| среда 4 | 0 | 27 | 51 | 52,94 | 0,00 |
| среда 5 | 3 | 31 | 48 | 64,58 | 6,25 |
На среды 1 и 2 было высажено относительно небольшое количество эксплантов, эти типы сред показали низкую эффективность, поскольку выживаемость была нулевой, была нарушена стерильность, вероятно, из - за внутренних инфекций.
Среда 3 оказалась более эффективна, чем две другие; почти половина эксплантов осталась жизнеспособна (45,45%).
При культивировании листовых эксплантов на среде 4 результат оказался неудовлетворительным. При общем количестве эксплантов (27), жизнеспособных не наблюдалось.
Чуть лучше показала результат среда 5, из 31 стерильного экспланта выжило 6,25% (рис. 2).

Рис. 2. Стерильность и жизнеспособность в зависимости от типа среды
Можно сделать вывод, что для органогенеза фаленопсиса лучше всего подходит среда 3, т.е. модифицированная среда МС для фаленопсиса, а для получения каллусной культуры – среда 5, т.е. среда для получения каллуса с цефазолином.
Глава 5. ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В РАБОТАХ С УЧАЩИМИСЯ ШКОЛ
Результаты исследований могут быть использованы в школьной программе в виде различных микроисследований по биологии и по химии, например «Влияние света на рост и развитие растений», «Влияние сред с различным pH на рост и развитие растений», «Влияние антибиотиков на рост и развитие растений», «Влияние гормонов на рост и развитие растений» и т.д.
Проводились работы со школьниками «Лицей №9» и «СОШ №135» 9-11 классов на базе ПГГПУ, на кафедре ботаники.
Целью работ являлось создание детьми микроисследования «Влияние различных источников света на рост и развитие картофеля сорта Невский» Данное микроисследование осуществлялось совместно с юношами 10 и 11 классов «Лицея №9» и с девушками 9 классов «СОШ №135».
Для них проводилась экскурсия в ботанический музей и на кафедру ботаники, здесь учащихся познакомились с основными помещениями, лабораторным оборудованием и различной химической посудой.
Далее им было предложено пройти вводное тестирование (см. приложение 1 и 2). Первоначальное тестирование дало очень низкий результат, что было ожидаемо, т.к. никто из учащихся не имел четких и структурированных знаний о основах микроклонального размножения растений in vitro.
Позже учеников ознакомили с историей развития биотехнологии, с клональным микроразмножением растений и основными понятиями и этапами МКР.
На следующем занятии с ними были изучены составы основных питательных сред и значение некоторых компонентов на рост и развитие растений, после этого ученики приступили к изготовлению питательной агаризованной среды Мурасиге-Скуга для картофеля.
На дальнейшем этапе учащиеся перешли к отработке техники микрочеренкования картофеля и пересадки его в пробирки со стерильной средой МС. Далее школьники ставили опыт «Влияние различных источников света на рост и развитие картофеля сорта Невский». С учащимися были выделены следующие цель и задачи:
Цель работы: оценить влияние спектральных характеристик различных искусственных источников света на прирост биомассы картофеля сорта «Невский» в культуре in vitro.
Задачи:
1) Получить не менее 60 молодых регенерантов картофеля сорта «Невский» на стерильной среде методами МКР.
2) Поместить в условия стабильных факторов среды, таких как температура, и фотопериод, световой поток, химические факторы питательной среды. Обеспечить облучение каждой группы источником света определённого типа.
3) Выявить прирост сырой и сухой биомассы регенерантов за период 6 недель, оценить отличия и определить наиболее оптимальный источник освещения.
В качестве источников света были выбраны люминисцентная, диодная и лампа накаливания, световой поток был выровнен до 2,2 кЛк. Опыт проводился при температуре: 26° С с фотопериодом 16/8, и временем вегетации: 6 недель.
Учащимися были выявлены следующие результаты:
Наибольший средний прирост сырой биомассы при освещении люминесцентной лампой он составляет (0,537 г.) и достоверно отличается на 36,5% от лампы накаливания, и на 41,8 % от диодной лампы.
Наименьший средний прирост сырой биомассы наблюдается в камере с диодной лампой, он составляет (0,313 г.) и также достоверно отличается от люминесцентной лампы.
Наименьший средний прирост сухой биомассы также при использовании диодной лампы, он составляет (0,027 г.), что на (32,4%) меньше чем, например, в камере с люминесцентной лампой.
Таким образом, им удалось установить, что наиболее эффективным источником света является люминесцентная лампа.
Диодная лампа, показала сравнительно невысокую эффективность по сравнению с остальными источниками.
Этот факт можно объяснить тем, что спектр бытовых осветительных светодиодов не оптимален для процесса фотосинтеза, не смотря на высокую суммарную интенсивность светового потока.
В случае специальных фитоактивных (PAR) осветителей следует ожидать большей эффективности, но они несоизмеримо дороже бытовых диодных ламп.
По этой причине последние потенциально применимы для освещения растений, но их использование может быть оправдано, в основном, экономией электроэнергии.
По завершению данного курса дети прошли итоговое тестирование (см. приложение 3 и 4), которое в этот раз показало хорошие результаты, и написали микроисследования, одно из которых заняло 3 место в XVIII общешкольном конкурсе учебно-исследовательских работ учащихся (см. приложение 5).
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований можно сделать следующие выводы:
Были изучены биологические особенности орхидеи рода Phalaenopsis и материалы по микроклональному размножению орхидных, установлено, что методы МКР применимы для объекта исследований и достаточно востребованы.
Было освоено изготовление агаризованных питательных сред различного состава и осуществлено введение растений в культуру in vitro. На основе полученных данных и поставленных экспериментов была оптимизирована среда для культивирования орхидеи фаленопсис (Phalaenopsis).
В результате проведённой работы был освоен метод клонального микроразмножения растений in vitro, путем микрочеренкования на примере сем. паслёновых (Solanaceae) на картофеле сорта Невский и на представителях рода фаленопсис (Phalaenopsis) сем. орхидные (Orchidaceae) различными типами эксплантов.
Были сформированы наиболее эффективные протоколы стерилизации листовых и стеблевых эксплантов, а также ювенильного материала Phalaenopsis;
Удалось уменьшить процент выбраковки растений, если при использовании исходной методики было зафиксировано 80,49% выбраковки по нарушению асептики и 90,24% по нежизнеспособности, то в результате корректировки протокола стерилизации процент брака был сокращен до 31,91% и 10,64% соответственно.
Проведена оценка эффективности использования питательных сред с разными соотношениями фитогормонов и с добавлением антибиотика. Для листовых эксплантов наиболее применима оказалась среда с цефазолином, для получения каллуса фаленопсиса (0,01 - 2,4-Д; 0,05 - 6БАП и 20мг/л цефазолина); для ювенильного посадочного материала – среда МС для органогенеза фаленопсиса (2 мг/л 6-БАП и 1 мг/л ИУК).
Были выявлены типы эксплантов, с наибольшим выходом жизнеспособных регенерантов и каллуса. Растения рода фаленопсис (Phalaenopsis) удалось ввести в культуру микрочеренкованием цветовых почек и введением в культуру семенами, а также средствами каллусной культуры из фрагментов листьев.
В результате работы с учащимися школы было проведено микроисследование на тему: «Влияние различных источников света на рост и развитие картофеля сорта Невский». В дальнейшем планируется написание факультативного курса для школьников «Биотехнология».
Библиографический список
Андронова Е.В. О биологическом разнообразии, семенном размножении in vitrо и репатриации орхидных // Вестник Тверского государственного университета, 2007. №7 (35). С. 8-11.
Антипина В.А. Размножение редких тропических орхидных in vitro // Матер. II Всерос. науч.-практ. конф. «Биология как инструмент сохранения биоразнообразия растительного мира», Белгород, 19–21 августа 2008. С. 29–33.
Батыгина Т. Б. Размножение растений / Батыгина Т. Б., Васильева В. Е. – СПб.: С.-Петерб. ун-т, 2002. – 232 с.
Буюн Л.И. Микроморфологические особенности листьев Guarianthe bowringiana (Bateman ex Lindl.) Dressler & W.E. Higgins (Orchidaceae Juss.) in vitro и in vivo // Труды VIII Международной конференции по морфологии растений, посвященной памяти Ивана Григорьевича и Татьяны Ивановны Серебряковых/ под общ ред. д.б.н. В.П.Викторова. М.: МПГУ, 2009. Т.1. С. 88-90.
Варлыгина Т.И. Охрана орхидных (Orchidaceae) в России // Вест. Тв. ГУ, серия Биология и Экология. 2007. №7 (35). С.70-74.
Вахрамеева М.Г., Денисова Л.В., Никитина С.В., Самсонов С.К. Орхидеи нашей страны. М.: Наука, 1991. 223 с.
Вельмяйкин И.Н., Мокшин Е.В., Лукаткин А.С. Влияние регуляторов роста на размножение и рост побегов Cymbidium hybridum hort. In vitro. – Вестник Нижегородского университета им. Н.И. Лобачевского, Биология, -2013, №3(1), с. 133-137.
Виноградова Т.Н. Два варианта развития ювенильных растений в естественной популяции Dactylorhiza maculata (L.) Soó (Orchidaceae). // Бюлл. МОИП. Отд. биол. 1999. Т.104, вып.4. С.40-45.
Висящева Л.В., Соколова Т.А. Промышленное цветоводство. М.: Агропромиздат, 1991. 386 с.
Воскресенская Н.П. Принципы фоторегулирования метаболизма растений и регуляторное действие красного и синего света // Фоторегуляция метаболизма и морфогенеза растений / Под ред. Курсанова А.Л. и др. - М.: Наука, 1975. - С. 16-36.
Герасимов С.О., Журавлев И.М. Орхидеи. - М.: Росагропромиздат, 1988. - 208 с. Карначук Р. А., Головацкая И.Ф. Гормональный статус, рост и формирование растений,выращенных на свету разного спектрального состава // Физиология растений. - 1998. - Т. 45, №6. - С. 925 - 934.
Головацкая И.Ф., Карначук РА. Свет и растение. - Томск: Изд-во Томского университета, 1999. - 100с.
Гродзинский A.M. Биология орхидей. Загадки и перспективы // Охрана и культивирование орхидей. Киев: Наукова думка, 1983. С. 3–6.
Захаревич С.Ф. К методике описания эпидермиса листа // Вестн. Ленингр. ун-та. 1954. № 4. С. 65-75.
Иванников, Р. В., Лаврентьева, А. Н. Семенное размножение Psichopsiella limminghei Lindl. (Orchida-ceae Juss.) в условиях асептической культуры [Текст] / Р. В. Иванников, А. Н. Лаврентьева // Ботанические сады как центры сохранения биоразнообразия и ра-ционального использования растительных ресурсов. Материалы междунар. конф., посвящ. 60-летию ГБС РАН. – М., 2005. – С. 190–193.
Калинин Ф. Л. Методы культуры тканей в физиологии и биохимии растений / Калинин Ф. Л., Сарнацкая В. В., Полищук В. Е. – К.: Наук. думка, 1980.488 с.
Карначук РА. Регуляторное влияние зеленого света на рост и фотосинтез листьев //Физиология растений. - 1987. - Т. 34, № 4. - С. 765 - 773.
Катаева Н. В., Бутенко Р. О. Клональное микроразмножение растений//Селекция. -1983.
Клональное микроразмножение растений: Учебно-методическое пособие / О.А. Тимофеева, Ю.Ю. Невмержицкая. – Казань: Казанский университет, 2012. – 56 с.
Козицкий Ю.Н., Борукаева М.Ф., Смирнова Н.С. Регуляторы роста и микроразмножение цветочных культур // Цветоводство. 1980. № 2. С. 13–15.
Красная Книга Российской Федерации (растения и грибы). М. Министерство природных ресурсов и экологии РФ и Росприроднадзора, 2008. С. 352 – 421, 786
Куликов П.В., Филиппов Е.Г. О методах размножения орхидных умеренной зоны в культуре in vitro // Бюл. ГБС. 1998. Вып. 176. С. 125-131.
Куликов П.В., Филиппов Е.Г. Прорастание семян и развитие проростков in vitro у некоторых орхидных умеренной зоны // Экология и интродукция растений на Урале. Екатеринбург, 1991. С. 39-43.
Куликов П.В., Филиппов Е.Г. Семенное и микроклональное размножение in vitro как метод сохранения генофонда орхидных умеренной зоны // Консервация генетических ресурсов. Пущино, 1996. С. 137-139.
Кушнир, Г. П., Будак, В. Е. Опыт клонального микроразмножения орхидей [Текст] / Г. П. Кушнир, В. Е. Будак. – Киев : Изд-во ЦРБС АН УССР, 1983. – С. 84–86.
Охрана и культивирование орхидей. – Киев.- 1983.
Охрана и культивирование орхидей. Материалы IX Международной конференции (26 – 30 сентября 2011г.) - М.: Товарищество научных изданий КМК, 2011, 500 с.
Поддубная-Арнольди В. А. Орхидеи и их культура / В. А. Поддубная-Арнольди, В. А. Селезнева. – М.: АН СССР, 1957. – 174 с.
Процесса прорастания семян cephalanthera damosonium(mill.) Druce (orchidaceae). - Ученые записки Таврического национального университета им. В. И. Вернадского.- Серия «Биология, химия». Том 22 (61). 2009. № 2. С. 3-8.
Р Бутенко Р.Г. Клеточные технологии в сельско-хозяйственной науке и практике // В кн.: Основы сельскохозяйственной биотехнологии. М.: Наука, 1990. С. 154–235.
Родин А.Р., Калашникова Е.А. Получение посадочного материала древесных, цветочных и травянистых растений с использованием методов биотех-нологии. М.: МГУЛ, 2004. 84 с.
Селезнева В.А. Тропические и субтропические орхидеи.М.: Наука,1965. 170с.
Степанюк Г. Я., Хоцкова Л. В. Биологические особенности некоторых видов тропических орхидей, интродуцированных в Сибирском ботаническом саду ТГУ. Ярославский педагогический вестник – 2012 – № 4 – Том III (Естественные науки).
Степанюк, Г. Я. Размножение тропических и субтропических растений in vitro в Сибирском ботаническом саду [Текст] / Г. Я. Степанюк // Проблемы интродукции растений и отдаленной гибридизации. – М., 1998. – С. 196–197.
Фатеева Е. В., Мокшин Е. В., Лукаткин А. С. Влияние концентрации минеральной основы среды и регуляторов роста на органогенез цимбидиума гибридного в культуре in vitro. Труды Карельского научного центра РАН. № 3. 2013. С. 143–148.
Хоцкова Л.В., Степанюк Г.Я., Карначук Р.А. Роль селективного света в морфогенезе и содержании фотосинтетических пигментов проростков cymbidium hybridum на начальных этапах онтогенеза. 93 научные ведомости\\Серия Естественные Науки. 2011 . № 3 (98). Выпуск 14/1
Черевченко Т. М. Орхидеи в культуре / Т. М. Черевченко, Г. П. Кушнир. – К.: Наук. думка, 1986. – 200 с.
Черевченко Т.М. Тропические и субтропические орхидеи / Отв. ред. Д.Н. Доброчаева; НАН Ук-раины, Центр. бот. сад им. Н.Н. Гришко. Киев: Наукова думка, 1993. 254 с.
Черевченко, Т. М. Орхидеи в культуре [Текст] / Т. М. Черевченко, Г. П. Кушнир. – Киев : Наукова думка, 1986. – 200 с.
Шевцова Г. Г. Развитие репродуктивных структур Cymbidium hybridum Hort. и Dactylorhiza maculate L. (Soo) в культуре in vitro: автореф. Дисс…. на соискание учен. степени канд. биол. наук : спец. 03.00.05 «Ботаника» / Г. Г. Шевцова. – Кишинев, 1989. – 25 с.
Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений. - М.: Наука, 1971.
Шосер Г. Орхидеи. Выращивание в домашних условиях. Разведение и уход / Шосер Г. – М.: Интербук-бизнес, 1997. – 132 с.
Arditti J., Ghani A.K.A. Numerical and physical properties of orchid seeds and their biological implications // New Phytologist. 2000. Vol. 145. P. 367-421.
Averyanov L.V., Averyanova A.L. Update checklist of the orchids of Vietnam. Hanoi: Vietnam National University Publishing House, 2003. 102 p.
Chowdhury I., Rahman A.R.M., Islam M.O., Matsui S. Effect of plant growth regulators on callus proliferation, plantlet regeneration and growth of plant-lets of Doritaenopsis orchid // Biotechnology. 2003. V. 2. P. 214–221.
Islam M.O., Matsui S. Effect of plant growth regulators on callus proliferation, plantlet regeneration and growth of plant-lets of Doritaenopsis orchid. 2004. V. 2. P. 203–221.
http://www.permecology.ru/%D0%BE%D0%BE%D0%BF%D1%82/
http://bio.1september.ru/article.php?ID=200501009
http://clubbrain.ru/referatu-botanika/rastenie-iz-probirki/
http://elementy.ru/lib/431454?page_design=print
http://forum.homecitrus.ru/topic/14207-falenopsis-phalaenopsis/
http://info.permecology.ru/redbook/008_haract.html
http://obiclub.ru/articles/garden/landscaping/3255
http://ufabotgarden.ru/?part_id=496,549
http://vinograd.info/knigi/sovremennye-dostizheniya-biotehnologii/biotehnologiya-kriosohraneniya-semyan-i-protokormov-orhidey.html
http://www.orchidee.ws/krankheiten/02.htm
http://www.orxidea.ru/biolog_stroen.php
http://www.sad.ru/?cat=orhidea_biologich_osob
http://www.sevin.ru/bioresrus/classification/secured_animals_pr.html
http://www.unn.ru/pages/issues/vestnik/99999999_West_2010_2(2)/10.pdf
http://www.vokrugsveta.ru/encyclopedia/index.php?title=%D0%9E%D1%80%D1%85%D0%B8%D0%B4%D0%B5%D0%B8
https://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D0%B7%D0%BC%D0%BD%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B5%D0%BD%D0%B8%D0%B9
https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%BB%D0%B5%D0%BD%D0%BE%D0%BF%D1%81%D0%B8%D1%81
http://www.un.org/ru/documents/decl_conv/conventions/cites.shtml
Приложение 1
Вводное тестирование по теме «Основы микроклонального размножения растений»
1) Первые достижения в области клонального микроразмножения были получены в конце 50-х годов XX столетия. Назовите учёного:
| А. Жорж Кювье, | В. Жорж Морель, |
| Б. Луи Пастер, | Г. Эрнест Геккель. |
2) В России первые работы по клональному микроразмножению были проведены в:
| А. 60-х годах XX века, | В. 30-х годах XIX века, |
| Б. 90-х годах XX века, | Г. 40-х годах XVIII века. |
3) К какому типу размножения относят клональное микроразмножение растений. Выберете соответствующий вариант ответа:
| А. Половое, | В. Половое и бесполое, |
| Б. Бесполое, | Г. Нет верного варианта ответа. |
4) Как называется универсальная среда, на которой обычно осуществляют микроклональное размножение растений:
| А. Кноппа, | В. Мурасиге – Скуга, |
| Б. Нича | Г. Кнудсона, |
5).Установите последовательность этапов клонального микроразмножения растений:
| А. собственно микроразмножение, когда происходит получение максимального количества клонов; |
| Б. укоренение размноженных побегов с последующей адаптацией их к почвенным условиям; |
| В. выращивание растений в условиях теплицы и подготовка их к реализации или посадки в поле; |
| Г. выбор растения – донора, изолирование эксплантов и получение хорошо растущей стерильной культуры клеток и тканей; |
6) Выделите верные утверждения:
| А. Средние коэффициенты размножения; |
| Б. Оздоровление растений от вирусов, бактерий и грибов; |
| В. Получение генетически разнородного материала; |
| Г. Экономия территорий для выращивания; |
| Д. Высокие коэффициенты размножения; |
| Е. Ограниченный по времени селекционный процесс; |
| Ж. Большая выбраковка материала; |
| З. Получение генетически однородного материала; |
7) Какие части растения в основном используются при микроклональном размножении растений:
| А. Корень, | Г. Побег с почками, |
| Б. Лист, | Д. Тычинки, |
| В. Лепестки, | Е. Семена, |
Приложение 2
Ответы учащихся на вводное тестирование по теме «Основы микроклонального размножения растений»

Приложение 3
Итоговое тестирование по теме «Основы микроклонального размножения растений»
1) Первые достижения в области клонального микроразмножения были получены в конце 50-х годов XX столетия. Назовите учёного:
| А. Жорж Кювье, | В. Жорж Морель, |
| Б. Луи Пастер, | Г. Эрнест Геккель. |
2) В России первые работы по клональному микроразмножению были проведены в:
| А. 60-х годах XX века, | В. 30-х годах XIX века, |
| Б. 90-х годах XX века, | Г. 40-х годах XVIII века. |
3) К какому типу размножения относят клональное микроразмножение растений. Выберете соответствующий вариант ответа:
| А. Половое, | В. Половое и бесполое, |
| Б. Бесполое, | Г. Нет верного варианта ответа. |
4) Тотипотентность – это…
| А. способность растений синтезировать новые вещества; | Г. особенность культивируемых клеток регенерировать in vitro целое растение; |
| Б. способность регенерировать; | |
| В. все варианты ответа. |
5) Как называется универсальная среда, на которой обычно осуществляют микроклональное размножение растений:
| А. Кноппа, | В. Мурасиге – Скуга, |
| Б. Нича | Г. Кнудсона, |
6) Основоположник метода получения изолированных протопластов:
| А. Э. Коккинг; | Г. Мендель; |
| Б. Уайт; | Д. Мисарович. |
| В. Хеллер; |
|
7) Дедифференциация - это
| А. оздоровление посадочного материала; | Г. подавление роста и развития пазушных почек; |
| Б. фрагмент ткани или органа, помещенный на питательную среду; | Д. возникновение физиологических и структурных различий между клетками и тканями растений. |
| В. утрата специализации; |
8) Дифференциация - это
| А. подавление роста и развития пазушных; | Г. утрата специализации. |
| Б. определение пути развития каждой клетки; | Д. фрагмент ткани или органа, помещенный на питательную среду; |
| В. возникновение физиологических и структурных различий между клетками и тканями растений; | |
9).Установите последовательность этапов клонального микроразмножения растений:
| А. собственно микроразмножение, когда происходит получение максимального количества клонов; |
| Б. укоренение размноженных побегов с последующей адаптацией их к почвенным условиям; |
| В. выращивание растений в условиях теплицы и подготовка их к реализации или посадки в поле; |
| Г. выбор растения – донора, изолирование эксплантов и получение хорошо растущей стерильной культуры клеток и тканей; |
10) Выделите верные утверждения:
| А. Средние коэффициенты размножения; |
| Б. Оздоровление растений от вирусов, бактерий и грибов; |
| В. Получение генетически разнородного материала; |
| Г. Экономия территорий для выращивания; |
| Д. Высокие коэффициенты размножения; |
| Е. Ограниченный по времени селекционный процесс; |
| Ж. Большая выбраковка материала; |
| З. Получение генетически однородного материала; |
11) Какие основные части растения используются при микроклональном размножении растений:
| А. Корень, | Г. Побег с почками, |
| Б. Лист, | Д. Тычинки, |
| В. Лепестки, | Е. Семена, |
Приложение 4
Ответы учащихся на итоговое тестирование по теме «Основы микроклонального размножения растений»

Приложение 5
Награды учащихся

11














