Задачи на константу равновесия.
1. Рассчитать константу химического равновесия Kc для реакции:
NO2(газ) SO2(газ) ⇄ NO(газ) SO3(жидк.) по известным данным:
|
| NO2 | SO2 | NO | SO3 |
| 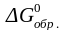 , кДж/моль , кДж/моль
| 52 | –300 | 90 | –370 |
Оценить возможность самопроизвольного протекания реакции в прямом направлении и значение константы равновесия.
Решение.
Рассчитаем стандартную энергию Гиббса реакции по первому следствию из закона Гесса:
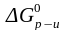
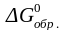 SО3
SО3 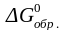 NO
NO 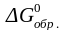 NO2
NO2 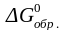 SO2 32 кДж.
SO2 32 кДж.
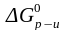 0, следовательно, процесс самопроизвольно протекает в прямом направлении.
0, следовательно, процесс самопроизвольно протекает в прямом направлении.
Величину Kc найдем из уравнения изотермы Вант-Гоффа:
ΔG0р-и = - RTlnKc= - 8,31∙T ∙2,303 lgKc
Отсюда: lgKc = - ΔG0р-и /19,15T = 32000/(19,15∙298) = 5,6. 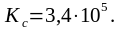
Kc 1, т. е. при данной температуре равновесие данной реакции сильно смещено в сторону образования продуктов реакции.
2. Для равновесной реакции: N2 3H2 ⇄ 2NH3 имеются следующие данные: 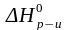 92,4 кДж,
92,4 кДж, 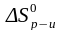 197,8 Дж/К.
197,8 Дж/К.
1) Рассчитать: а) температуру, при которой система находится в равновесии (Kc 1);
б) значение константы равновесия при 298 К.
2) Указать направление смещения равновесия при повышении (понижении) температуры.
Решение.
При Кс 1 стандартная энергия Гиббса равна нулю. Тогда из соотношения: 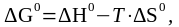 получим:
получим:
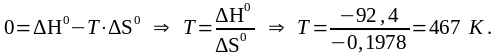
Для данной реакции зависимость энергии Гиббса от температуры выглядит следующим образом:
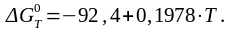
При стандартной температуре (298 К):
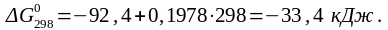
Значение Кс при данной температуре найдем из соотношения:
lgKc 298 = - ΔG0298 /19,15T = 33400/(19,15∙298) = 5,9. 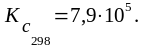
Проведенный расчет показывает, что: 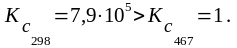
Это означает, что при понижении температуры равновесие смещается в прямом направлении.
Аналогичный вывод можно сделать и исходя из принципа Ле Шателье. Действительно реакция образования аммиака – экзотермическая (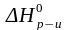 0), следовательно при повышении температуры равновесие смещается в сторону обратной реакции (разложения аммиака), а при понижении температуры – в сторону прямой реакции (синтеза аммиака).
0), следовательно при повышении температуры равновесие смещается в сторону обратной реакции (разложения аммиака), а при понижении температуры – в сторону прямой реакции (синтеза аммиака).
3. Для реакции CO2(газ) H2(газ) ⇄ CO(газ) H2O(пар) константа равновесия равна 1. Исходные концентрации веществ составили: С0(СO2) = 0,2 моль/л; С0(H2) = 0,8 моль/л. Рассчитать, при каких концентрациях всех четырех веществ установилось равновесие.
Решение.
Обозначим концентрации С(СО2) и С(Н2), вступивших в реакцию, через «х», т. е. С(СO2)прореаг. С(H2)прореаг. х моль/л.
Тогда: С(СO2)равн. С0(CO2) С(СO2)прореаг. 0,2 х;
С(H2)равн. С0(H2) С(H2)прореаг. 0,8 х. Из уравнения реакции видно, что: [СO] [H2O] x.
| CO2(газ) H2(газ) ⇄ CO(газ) H2O(пар) |
| Co | 0,2 | 0,8 |
|
|
| Прореаг | х | х | - | - |
| Сравн | 0,2-х | 0,8-х | х | х |
Выражение для константы равновесия имеет вид:
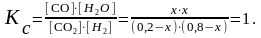
x2 0,16 0,2x 0,8x x2 x 0,16.
Равновесные концентрации всех веществ равны:
[СO2] 0,2 0,16 0,04 моль/л;[H2] 0,8 0,16 0,64 моль/л;
[СO] [H2O] 0,16 моль/л.
4. Реакция образования йодистого водорода протекает по уравнению:
H2(газ) I2(газ) ⇄ 2HI(газ). Исходные концентрации веществ составили: С0(H2) 0,02 моль/л; С0(I2) 0,04 моль/л. Известно, что в реакцию вступило 50% Н2.
1) Вычислить константу химического равновесия.
2) В каком направлении сместится равновесие, если:
а) увеличить концентрацию I2?
б) уменьшить концентрацию HI?
в) увеличить давление?
Решение.
Исходя из уравнения реакции, определяем концентрации веществ, прореагировавших между собой:
С(H2)прореаг. 0,5·0,02 0,01 моль/л; С(I2)прореаг. С(H2)прореаг. 0,01 моль/л.
Находим равновесные концентрации:
[HI] 2c(H2)прореаг. 0,02 моль/л (по уравнению реакции);
[H2] c0(H2) с(H2)прореаг. 0,02 0,01 0,01 моль/л;
[I2] c0(I2) с(I2)прореаг. 0,04 0,01 0,03 моль/л.
|
| H2(газ) I2(газ) ⇄ 2HI(газ) |
| Co | 0,02 | 0,04 | 0 |
| Прореаг | 0,01 | 0,01 | - |
| Сравн | 0,01 | 0,03 | 0,02 |
Подставляем равновесные концентрации в выражение константы равновесия:
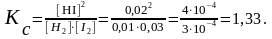
Увеличение концентрации I2 и уменьшение концентрации HI приведет к сдвигу равновесия в сторону прямой реакции. Увеличение давления не вызовет сдвига равновесия.
5. При определенных условиях в системе установилось равновесие:
2NO O2 ⇄ 2NO2. Равновесные концентрации веществ составили:
[NO] 4 моль/л; [O2] 6 моль/л; [NO2] 10 моль/л. Найти исходные концентрации NО и О2.
Решение.
Исходные концентрации равны сумме равновесных концентраций и концентраций вступивших в реакции веществ. Последние можно определить из стехиометрических соотношений:
2NO O2 ⇄ 2NO2
С(NO)прореаг. [NO2] 10 моль/л; С(O2)прореаг. 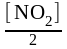 5 моль/л.
5 моль/л.
Отсюда: С0(NO) [NO] С(NO)прореаг. 4 10 14 моль/л;
С0(O2) [O2] С(O2)прореаг. 6 5 11 моль/л.







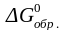 , кДж/моль
, кДж/моль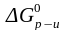
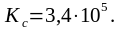
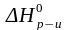 92,4 кДж,
92,4 кДж, 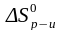 197,8 Дж/К.
197,8 Дж/К.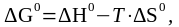 получим:
получим: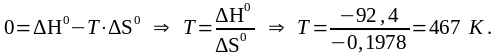
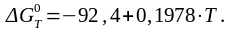
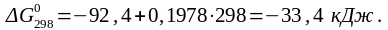
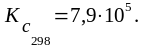
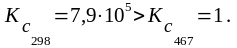
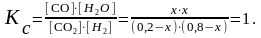
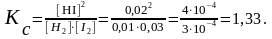
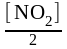 5 моль/л.
5 моль/л.




















