Каратаева Г.Т.
Часть А
Задание № 1
Цель: 7.1.1.3 различать физические и химические явления.
Выпишите примеры физических и химических явлений из предложенных.
| 1.физические | А. Окрашивание волос |
| В. Гниение листьев |
| 2.химические | С. Выпадение осадков |
| D. Кипение воды |
1._________ 2._________
Задание №2
Цель: 7.1.2.6 классифицировать вещества на простые и сложные
Выберите группу веществ, которые относятся к сложным веществам.
Вода,уголь, железо,водород
Кислород,йод,азот,соль
Сахар,белок,соль,вода
Азот,глюкоза,жир,фосфор
Задание №3
Цель:7.3.4.1 знать, что «кислые» и «мылкие» вещества являются природными кислотами и щелочами
Даны несколько веществ ,одни из которых «мылкие» на ощуп, другие «кислые» на вкус, на какие две группы их можно разделить?
1______________________ 2_____________________
Задание № 4 Цель: 7.2.1.1 знать и сравнивать классификации элементов на примере работ
И. Дёберейнера, Дж. Ньюлендса,
Д.И. Менделеева
Кто из ученых предложил систему октав для классификации химических элементов?
И.В.Дёберейнер
Д.А.Ньюлендс
Д.И. Менделеев
М.В Ломоносов
Задание № 5
Цель: 7.4.2.2 понимать, что полезные химические соединения обычно являются рудами
Из данного списка выберите вещества , которые получают из металлических руд.
медь, глина, нефть, природный газ.
серебро, натрий, магний, свинец,медь .
гранит, мрамор, песок, глина, соль.
торф, мрамор, медь, уголь.
Задание №6
Цель: 8.1.1.2 уметь вычислять молярные массы соединений
Определите молярную массу сульфата магния (MgSO4)
100 г/моль
140г/моль
120г/моль
130г/моль
Задание № 7
Цель: 8.1.1.3 -вычислять массу, количество вещества и число структурных частиц.
Выберете формулу, по которой вы рассчитаете число структурных частиц вещества, если известно его количество вещества:
n= 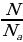
N= Na*n
N= Na*
Na =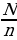
Задание №8
Цель:8.2.1.4 -характеризовать химический элемент по положению в периодической системе
Пользуясь периодической системой химических элементов ,найдите какому элементу соответствует данная характеристика:
Металл серебристо-белого цвета, на внешнем электронном слое имеет 3 электрона ,всего 3 электронные оболочки, образует оксид состава R2O3,который проявляет амфотерные своиства.
Ответ:
Задание№9_
8.1.4.1 объяснять образование ковалентной связи между атомами на основе электроотрицательности
__Какой вид химической связи образуется ,если соединяются между собой атомы с небольшой разницей электроотрицательности?________________
А)__________
Задание №10
Цель:8.4.2.2 знать процентное содержание кислорода в составе воздуха и земной коре;
Показать процентное содержание кислорода в воздухе и в земной коре.
28% и 48%
30% и 70%
21 % и 47%
50% и 50%
12% и 30%
Задание №11 Цель: 9.4.1.8 описывать и проводить реакции окрашивания цвета пламени для определения катионов металлов:Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Cu2+;
Задание№12
9.2.2.3 объяснять смысл понятия степени окисления и определять ее значение по формуле вещества;
Определите степень окисления серы в сернистой кислоте:
А.-2 B +4 C +6 D 0
Задание №13
9.2.1.11 описывать общую характеристику элементов16 (VI) - группы;
Выберите из данного списка характеристику соответствующую элементам
Группы
ns2np4.Валентность 2,4,6 оксиды RO3 ,водородное соединение H2R
ns2np3 валентность3,5; оксидыR2O5; водородное соединение RH3
ns2np1 валентность 3; оксид R2O3; водородное соединение не образует
ns2np5 валентность 1,5,7;оксид R2O7 водородное соединение HR
Задание №14
Цель: 9.1.4.6 объяснять молекулярную, электронную и структурную формулы аммиака;
Напишите молекулярную,электронную и структурную формулу аммиака
| Молекулярная | электронная | структурная |
|
|
|
|
Задание № 15
9.4.3.29 объяснять биологическое значение и функции белков
В состав каких продуктов входят белки , необходимые человеку?
яйца,мясо, сметана, молоко
Творог,рис, молоко, мясо
Сметана,гречка,икра,огурец
Картофель,мука,кефир,вода
Часть В
Задание № 16 а)7.3.1.1 знать состав воздуха;
Напишите процентный состав воздуха.
__________________________________________________________[1]
16 б) 7.3.1.2 знать, что при горении веществ расходуется кислород, входящий в состав воздуха
;Найти объем воздуха необходимый для горения 48 г метана.
_____________________________________________________________
___________________________________________________________________
________________________________________________________________[2]
16 с) 7.3.1.3 понимать значение охраны
Предложите 3-4 варианта способов охраны воздуха и объясните для чего это необходимо.
_________________________________________________________________
_________________________________________________________________
__________________________________________________________________
Задание № 17(а)
8.1.3.4 уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов
Написать схемы строения элементов под № 7 , №14, №19
А) _______________________________________________
Б)_________________________________________________
В)___________________________________________________[3]
Задание №17(б)
8.1.3.6 составлять формулы соединений методом «нулевой суммы»
Составьте формулы оксидов элементов из задания17(а) методом «нулевой суммы»
А)__________________________________________________
Б)____________________________________________________
В)_______________________________________________________
Задание № 17(с)
8.2.3.3 составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции;
Написать уравнения реакции между:
А) магнием и соляной кислотой_______________________________________
Б )кислородом и серой_______________________________________________
В )водородом и хлором_____________________________________________[3]
Задание № 17(д)
8.1.3.5 понимать, что атомы могут принимать или терять электроны, что приводит к образованию ионов;
Ионы это заряженные частицы, в которые превращается атом в результате отдачи или присоединения электрона. Написать схемы строения электронных оболочек следующих ионов: Na+1и Cl-_
А)_____________
Б)____________________________________________________[1]_______________
__________________Задание №18(а)
8.3.4.3 объяснять влияние температуры на растворимость веществ.
Как изменяется растворимость вещества с повышением температуры?
Показать на примере сахара ,как при постепенном повышении температуры
Изменяется растворимость. Объяснить почему?
_________________________________________________________________
_________________________________________________________________
________________________________________________________________
__________________________________________________________________
Задание №18(б)
8.3.4.5 вычислять массу растворенного вещества по известной массе раствора с определенной массовой долей растворенного вещества;
Определите массу соли, содержащуюся в 500 гр 5% раствора.
_______________________________________________________
________________________________________________________
________________________________________________________
_______________________________________________________[2]
Задание №18(с)
8.3.4.6 рассчитывать молярную концентрацию вещества в растворе
18,25 гр поваренной соли растворили в 100гр воды .Определить молярную концентрацию соли.
Решение__________________________ [2]
________________
Задание №19(а)
9.4.1.9 проводить качественные реакции на определение катионов Fe2+, Fe3+, Cu2+
Раствор содержащии неизвестный ион с зарядом +2 при добавлении щелочи образует осадок голубого цвета.Определите ион
А) Ca 2+ B) Ba2+ C) Fe2+ D) Cu2+ [1]
Задание № 19(б)
9.4.1.4 объяснять механизм электролитической диссоциации веществ с ионным и ковалентным полярным видами связи
Каков механизм диссоциации электролита с ковалентной полярной связью,? Напишите последовательно процессы ,происходящие при этом.
_А)
Б)
В)
Г) [2]
Задание №19(с)
9.4.1.6 составлять уравнения электролитической диссоциации кислот, щелочей, средних и кислых солей
Написать уравнения диссоциации следующих веществ:HNO3; KOH; NaHCO3; CaSO4
А)
___________
Б)
В)
Г) [2]
Задание 19(д)
9.4.1.10 проводить качественные реакции на хлорид-, бромид-, йодид-, сульфат-, карбонат-, фосфат-, нитрат-, силикат- ионы и описывать результаты наблюдения реакции ионного обмена
Напишите какие ионы являются определителями для следующих катионов и анионов,
| Катионы и анионы | Ионы, используемые для определения |
| SO42- |
|
| SiO32- |
|
| PO43- |
|
| NO3- |
|
| CL- |
|
[3]
Задание № 20(а)
9.4.3.5 использовать номенклатуру основных классов органических соединений по IUPAC: алканы, алкены, алкины, спирты, альдегиды, карбоновые кислоты, аминокислоты
Дать названия веществам по международной номенклатуре IUPAK
CH3-CH-CH3 CH2=CH-CH-CH3 CH3-C=CH-CH3
│ │ │
CH3 CH3 C2H5
CH3-CH2OH CH3-COH CH3COOH [2]
Задание №20(б)
9.2.3.4 определять молекулярную формулу газообразного вещества по относительной плотности и массовым долям элементов
Найдите молекулярную формулу углеводорода, если его относительная плотность по воздуху равна1,93 и массовая доля углерода 85,7%
_____________________________________________________________
_______________________________________________________________
______________________________________________________________-[2]
Задание №20(с)
9.4.3.7 описывать химические свойства алканов и подтверждать их уравнениями реакций;672
Объясните на примере этана , какие продукты образуются при:
А)хлорировании; В) горении алканов. Напишите уравнения реакции
_________________________________________________________________
________________________________________________________________
__________________________________________________________________
________________________________________________________________[2]
Марк схема:
| № | ответы | пояснения |
|
| 1 | 1с,д 2а,в |
| 1 |
| 2 | С |
| 1 |
| 3 | 1 щелочи 2кислоты |
| 1 |
| 4 | В |
| 1 |
| 5 | 5 |
| 1 |
| 6 | С |
| 1 |
| 7 | В |
| 1 |
| 8 | Al |
| 1 |
| 9 |
|
| 1 |
| 10 | С |
| 1 |
| 11 | В |
| 1 |
| 12 | В |
| 1 |
| 13 |
|
| 1 |
| 14 | NH3.H-N-H H:N:H H H |
| 1 |
| 15 | А
|
| 1 |
| 16а | O-21% N-78% CO2-0.02% инерт газа0,03% |
| 1 |
| 16б | 672л | За решение 2 балла | 2 |
| 16с | 1Уменшить количество вредных веществ 2Использовать пылеуловители и фильтры на производстве 3увеличивать количество зеленых насаждении 4запретить въезд большегрузных машин в большие города | За каждый ответ 1 балл | 4 |
| 17а | N+7)) Si+14))) K+19)))) 25 214 2881 | 1 балл за схему,1 балл за электронную формулу | 2 |
| 17б | N2O5.SiO2.K2O | 1 балл за каждую формулу | 3 |
| 17с | Mg +2HCl=MgCl2+H2 2K+S=K2S H2+Cl2=2HCl | 1 балл за каждое уравнение | 3 |
| 17д | Na+11) 2)8 Cl+17)2)8)8 | 1 балл за схему | 1 |
| 18а | Чем выше температура тем больше сахара растворяется | 1 балл за вывод | 1 |
| 18б | 25 g | 2 балла за решение | 2 |
| 18с | 5 m\l | 2 балла за решение | 2 |
| 19а | Cu2+ | 1 балл за выбор | 1 |
| 19б | Ориентация молекул воды Гидратация молекул электролита Ионизация молекул электролита Диссоциация молекул электролита | За каждые 2 процесса 1 балл | 2 |
| 19с | HNO3=H+ +NO3- KOH=K+ +OH- NaHCO3=Na+ +HCO3- CaSO4=Ca+2 +SO4- | За 2 ур-я диссоциации 1 балл | 2 |
| 19д | Ba2+.H+. Ag+.Cu. Ag+ | За 2 иона 1 балл | 2 |
| 20а | 2метил пропан 2 метил бутен1 2 метил пентен 2 Этанол Этаналь Этановая кислота | За 3 названия 1 балл | 2 |
| 20б | С4Н8 | За решение 2 балла | 2 |
| 20c | С2Н6+Cl2=C2H5Cl+HCl 2C2H6+7O2=4CO2+6H2O | За каждое уравнение 1 балл | 2 |