Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
5-8 класс
Задания
Время на выполнение заданий – 180 минут
Максимальный балл-50
Задача 1 (8 баллов)
Одно из интереснейших простых веществ – белый фосфор, Р4. В молекуле P4 каждый атом фосфора образует три связи с другими атомами фосфора. В образовании каждой связи участвуют два атома.
1. Сколько всего связей в молекуле P4?
2. Какую геометрическую форму может иметь молекула: квадрат, тетраэдр, треугольник, прямоугольник? Дополнительно известно, что длины всех связей одинаковые. Дайте описание этой фигуры или просто нарисуйте структуру молекулы белого фосфора.
Задача 2 (12 баллов)
Полимеры – молекулы, которые содержат большое число одинаковых фрагментов X: (Х)n. n называется степенью полимеризации. Молекулярная масса полимера равна произведению степени полимеризации n на молекулярную массу фрагмента Х.
1. Полиизопрен – полимер с общей формулой (C5H8)n. Определите молекулярную массу полимера, если степень полимеризации равна 550.
2. Какова степень полимеризации (C5H8)n, если по данным измерения молекулярной массы, она лежит в пределах 23750 – 23850.
3. Бор с элементом Х образует полимер (BX)n. Определите элемент Х, если полимер со степенью полимеризации 131 имеет молекулярную массу 3275.
Задача 3 (10 баллов)
Алхимиками было установлено соответствие между семью известными планетами (светилами) и семью известными с древности металлами. Каждому светилу соответствовал определённый металл, которым оно «управляло».
1. Перед вами 3 планеты и 3 металла из списка алхимиков, соотнесите их:
| 1. Венера | А. Олово |
| 2. Юпитер | Б. Свинец |
| 3. Сатурн | В. Медь |
В химических текстах можно встретить множество терминов, понятных только узким специалистам. Но есть слова, известные каждому грамотному человеку: названия элементов, многих веществ и методов их обработки. Некоторые из этих названий придуманы недавно, другие имеют тысячелетнюю историю.
2. Назовите химические элементы:
a) Название этого элемента в переводе с др. -греч. означает «ленивый»;
b) Название этого элемента в переводе с др. -греч. означает «цвет»;
c) Название этого элемента в переводе с др. -греч. означает «зловоние»;
d) Название этого элемента является сокращение от нем. «медный дьявол»;
e) Этот элемент назван по латинскому названию Франции;
f) Этот элемент назван по цвету индиго;
g) Этот элемент назван в честь Скандинавии.
Задача 4 (6 баллов)
Многие автолюбители задают себе вопрос о том, какая кислота находится в аккумуляторе автомобиля. По незнанию высказываются различные неверные предположения. Кто-то говорит, что там соляная кислота. Некоторые считают, что там вода. Однако неправы ни те, ни другие. В свинцово-кислотном аккумуляторе автомобиля находится раствор серной кислоты в дистиллированной воде с процентным соотношением 30 к 70 по массе.
Какую массу дистиллированной воды нужно добавить к данному раствору объемом 2 литра (плотность – 1,27 г/см3), чтобы массовая доля кислоты в растворе уменьшилась в 3 раза?
Задача 5 (14 баллов)
Минерал X содержит в своем составе следующие элементы: Cu, O, H и C. Массовая доля Cu – 57,658%, O – 36,036%, H – 0,9006% и C – 5,4054%.
Определите формулу минерала X.
Определите степени окисления элементов в данном веществе.
Укажите тривиальноеили систематическое названия данного минерала.
Всероссийская олимпиады школьников по химии
2018-2019учебный год
Школьный этап
9 класс
Задания
Время на выполнение заданий – 180 минут
Максимальный балл-50
Задача 1 – тест (8 баллов)
В тетради нужно указать только номер вопроса и одну букву правильного варианта ответа. Объяснений писать не нужно. На каждый вопрос верен только один вариант ответа, если вы укажете два разных варианта, получите 0 баллов.
При детонационном синтезе наноалмазов получены частицы, содержащие 3.2·1017 атомов. Сколько моль атомов в таком алмазе?
а) 5.3·10−7 моль в) 0.053 моль
б) 3.5·10−7 моль г) 0.035 моль
Какая подгруппа периодической системы элементов Д.И. Менделеева содержит два газа, жидкость, твердое вещество и радиоактивный элемент?
а) VIA в) VIIA
б) IIB г) VIII A
Какой неметалл образует простое вещество с молярной массой больше 250 г/моль?
а) Ртуть в) Сера
б) Фосфор г) Уран
Молекула какого простого вещества содержит двойную связь?
а) Кислород в) Фтор
б) Азот г) Хлор
Атом с каким зарядом ядра будет щелочным металлом?
а) 118 в) 120
б) 119 г) 121
При сгорании 20 г метана СН4выделяется 1000 кДж теплоты. Какое количество теплоты выделится при сгорании 15 г метана?
а) 750 кДж в) 750 Дж
б) 1333 кДж г) 1333 Дж
Какой элемент образует оксиды в пяти различных степенях окисления?
а) Сера в) Хлор
б) Кремний г) Азот
Какая реакция не может служить лабораторным способом получения кислорода?
а) нагревание перманганата калия
б) прокаливания нитрата аммония
в) прокаливание бертолетовой соли в присутствии катализатора
г) разложение перекиси водорода в присутствии катализатора
Задача 2 (12 баллов)
Лаборант разбил градусник в лаборатории в конце прошлого учебного года. Лаборант и Профессор решили попробовать сохранить полученную из градусника каплю ртути и оставили ее на все лето на открытом воздухе в лаборатории. По окончании отпуска Лаборант с Профессором капли уже не обнаружили. Помогите им определить, можно ли работать в этой лаборатории. Для этого выполните следующие задания.
1. Зная размеры лаборатории (6 м × 5 м × 3 м), определите количество моль газов, содержащихся в воздухе в лаборатории при н.у. и количество молекулвсех газов в воздухе, содержащихся в лаборатории. Молярный объем при н.у. равен 22.4 л/моль.
2. Из массы капли ртути (0.0020 г) определите количество атомов ртути в воздухе лаборатории. Число Авогадро NA = 6.02 · 1023.
3. Определите сколько атомов ртути приходится на миллиард молекул воздуха в лаборатории с точностью до десятых? Можно ли работать в лаборатории, если предельно допустимое значение – 1.1 атом ртути на 109 молекул воздуха?
Примечание: на самом деле в лаборатории сразу включили тягу, поэтому ни один Лаборант и Профессор не пострадали.
Задача 3 (10 баллов)
Тринитроглицерин С3Н5N3O9 – лекарство и взрывчатое вещество. Этот забавный факт, пожалуй, лучшим образом иллюстрирует зависимость применения и свойств вещества от количества и концентрации. При детонации тринитроглицерина без доступа воздуха образуется азот, углекислый газ, вода и кислород.
1. Напишите уравнение реакции взрыва тринитроглицерина.
2. Каковы объем и плотность газовой смеси, полученной при взрыве 1 г тринитроглицерина при 200 ℃? Молярный объем газов при этой температуре и давлении 1 атм равен 39 л/моль.
3. Теплота, выделяющаяся при взрыве 1 кг тринитроглицерина, равна 6535 кДж. При детонации порции тринитроглицерина образовалось 1,44 г воды. Каково количество выделившейся при этом теплоты?
Задача 4 (8 баллов)
Древнерусское название элемента X употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения.
1. Определите вещества X, X1-X4 (X1-X4 содержат X). Если первый абзац задачи Вам не помог, то дополнительно известно, что массовая доля X в бинарном соединении X1 равна 50%.
2. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения (4 реакции).
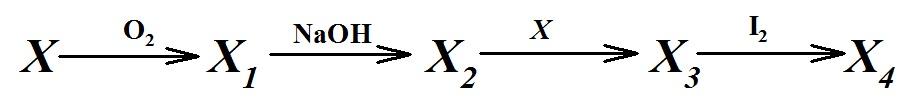
3. Нарисуйте структурную формулу соединения X4.
Задача 5 (12 баллов)
Одно из простых веществ, образованных элементомX, растворяется в концентрированной азотной кислоте с образованием газа A (объемная доля газа А в воздухе составляет 0,0314%) и «лисьего хвоста» - B (реакция 1).
При прокаливании X с ядовитым бинарным веществом Y оранжевого цвета (массовая доля кислорода равна 44%) образуется бинарный газ C (массовая доля кислорода равна 57,14%) и черное вещество D (реакция 2). При этом известно, что на 1,31 г Y требуется 0,605 г X.
Также вещество A можно получить в результате гидролиза F, удушливого газа с запахом прелого сена (использовался как боевое отравляющее вещество) (реакция 3). Сам же F получают при взаимодействии вещества E (массовая доля хлора равна 92,21%, атомное соотношение X:Cl=1:4) с оксидом алюминия. (реакция 4).
Определите вещества X, Y, A-F(A-F содержат X) и напишите уравнения реакций.
Назовите наиболее инертную форму элемента X.
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
10 класс
Времяна выполнение заданий - 180 минут
Максимальный балл - 50
Задача №1 (10 баллов)
Сера с кислородом и хлором образует ряд соединений в различных степенях окисления: +2, +2/n, +4, +6.
1. Напишите формулы двух бинарных соединений серы с кислородом.
Хлорид серы А представляет собой тяжелую жидкость, которая при реакции с водой дает оксид серы (IV) и серу в мольном соотношении 1:1. Кроме того, образуется соляная кислота.
2. Определите формулу А. Напишите уравнение реакции гидролиза.
3. Напишите уравнение реакции гидролиза S3Cl2, если продуктами реакции являются те же вещества.
4. Трехэлементное соединение Б при нагревании обратимо разлагается на хлор и оксид серы(IV), причем объем продуктов в два раза больше объема исходного газа Б. Определите формулу Б и напишите уравнение реакции Б со щелочью (NaOH).
Задача №2 (10 баллов)
В лабораторной практике для очистки посуды от особенно инертных загрязнений используют так называемую хромовую смесь. Для приготовления можно воспользоваться следующим рецептом: 15 г дихромата калия K2Cr2O7 растворяют в небольшом количестве воды (около 10 мл) и добавляют порциями концентрированную серную кислоту. Сначала выпадает ярко-красный осадок, содержащий 48.0 % кислорода по массе. В большом избытке концентрированной серной кислоты он растворяется с образованием темно-красного раствора, который и используют для мытья посуды. Объем итоговой смеси по такому рецепту составляет 200 мл.
1. Определите формулу соединения, выпадающего в осадок. Напишите уравнение реакции его образования.
2. Определите молярную концентрацию хрома в полученной хромовой смеси.
3. Как вы думаете, плотность полученной хромовой смеси больше или меньше плотности воды? Кратко обоснуйте.
4. Однажды незадачливый лаборант Василий решил промыть хлоркальциевые трубки (содержащие CaCl2) хромовой смесью. Однако началась помывка неожиданным для Василия образом: при контакте с хромовой смесью из трубок бурно повалили едкие тяжелые пары вещества, плотность которого по воздуху составляет 5.34. Оправившись от первых ощущений, Василий быстро поглотил пары раствором гидроксида калия, при этом в растворе образовался хромат и хлорид калия.
Помогите Василию: определите формулу едких паров и напишите уравнение реакции их со щелочью. И никогда не повторяйте Васиных ошибок!
Задание №3 (10 баллов)
Пентан образует три различных изомера.
1. Приведите структурные всех изомеров пентана.
2. Какой изомер содержит и первичные, и вторичные, и третичные атомы углерода?
3. Какой изомер образует только одно монохлорпроизводное при хлорировании?
4. При хлорировании какого изомера можно получить только 2 изомерных дихлорпентана? Приведите структурные формулы этих дихлорпентанов и назовите их по ИЮПАК.
Задача №4 (10 баллов)
1.5 моль азота смешали с 5.0 моль водорода и нагрели в присутствии катализатора. В результате реакции количество полученного аммиака составило 1.8 моль, часть азота и водорода не прореагировало.
1. Запишите уравнение реакции. Почему не прореагировал весь азот?
2. Определите количество (моль) водорода и азота в смеси после реакции.
3. Чему равен объем смеси веществ после реакции при н.у.?
4. Во сколько раз уменьшится объем, если смесь пропустить через раствор соляной кислоты?
Задача №5 (10 баллов)
При сжигании топлива окисление не всегда идет до конца, поэтому примесью к углекислому газу всегда выступает угарный газ (СО). Его постоянный фоновый уровень в воздухе равен примерно 0.5 мг в 1 м3.
1. Напишите уравнения реакций сгорания метана с образованием углекислого газа и угарного газа.
2. Сколько молекул СО в среднем находится в 1 мл воздуха? Число Авогадро NA = 6.02 · 1023.
3. Предельно допустимое содержание СО при вдыхании в течении рабочего дня (8 часов) составляет 0.02 г/м3. Известно, что средний объем вдыхаемого воздуха за 1 вдох составляет 0.45 л, за минуту человек делает в среднем 20 вдохов. Какую массу СО вдохнет рабочий, если будет работать 8 ч в зоне с концентрацией СО, равной предельно допустимой?
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
11 класс
Задания
Время на выполнение заданий - 180 минут
Максимальный балл -50
Задача №1 (8 баллов)
Отгадайте пять химических загадок о газах. В пунктах 3, 4, 5 напишите по одному уравнению реакции.
1. Газ А – оксид углерода легче воздуха.
2. Газ Б – газообразный галоген, более чем в два раза тяжелее воздуха.
3. Газ В – продукт реакции А с Б, боевое отравляющее вещество.
4. Газ Д при реакции с А образует серию продуктов, в зависимости от катализатора, например, воду и газ Е – основной компонент болотного газа.
5. Газ Ж тоже содержится в болотном газе, при окислении хлором дает соляную кислоту и хлорид, содержащий 77.5 % хлора по массе.
Задача №2 (8 баллов)
Для следующих опытов приведите структурные формулы исходного соединения и продукта реакции.
1. 2-метил-пентанол-2 нагрели с серной кислотой.
2. Транс-гексен-3 вступил в реакцию с холодным раствором перманганата калия.
3. Пропин пропустили через подкисленный раствор соли ртути(II).
4. Этилбензол нагрели с подкисленным раствором перманганата калия.
Задача №3 (10 баллов)
Углеводород А при хлорировании образует только 2 монохлорпроизводных. Радикальное бромированиеА преимущественно дает монобромпроизводноеБ, которое в свою очередь при обработке спиртовым раствором щёлочи дает симметричный алкенВ. При пропускании 5.0 г. В через бромную воду образуется 14.52 г дибромпроизводногоГ.
Определите структуру соединений А - Г.
Дайте название соединений Б и В по номенклатуре.
Задача №4 (12 баллов)
Имеется навеска простого вещества А массой 5.00 г. При растворении навески в разбавленной соляной кислоте  образуется соединение Б. Количества выделившегося при растворении А водорода достаточно для полного гидрирования 1.160 г ацетилена. Окислением соединения Б хлором можно получить соединение В. При добавлении разбавленной щелочи к раствору В выпадает бурый студенистый осадок Г. При прокаливании Г при температуре 600°С образуется соединение Д массой 7.14 г.
образуется соединение Б. Количества выделившегося при растворении А водорода достаточно для полного гидрирования 1.160 г ацетилена. Окислением соединения Б хлором можно получить соединение В. При добавлении разбавленной щелочи к раствору В выпадает бурый студенистый осадок Г. При прокаливании Г при температуре 600°С образуется соединение Д массой 7.14 г.
Определите соединения А-Д.
Напишите уравнения реакций образования соединений А-Д (4 реакции).
Укажите названия 3 сплавов, содержащих металл А.
Задача №5(12 баллов)
В каждой химической реакции энергия либо выделяется, либо поглощается. Так при сливании растворов HCl и KOH выделяется теплота, количество которой прямо пропорционально количеству образовавшейся воды. Сливают 4% (по массе) раствор HCl объемом 15 мл (ρ = 1.018 г/мл) и 5% (по массе) раствор KOH объемом 20 мл (ρ = 1.044 г/мл).
Запишите сокращенное ионное уравнение происходящей реакции.
Рассчитайте концентрацию хлорида калия в образовавшемся растворе. Считайте, что объем полученного раствора равен сумме объемов исходных.
Во сколько раз изменится количество выделившейся теплоты, если:
а) раствор HCl заменить на 4% раствор H2SO4 (ρ = 1.025) такого же объема;
б) взять 20 мл раствора HCl вместо 15 мл.
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
5-8 класс
Решения
Максимальный балл - 50
Решение задачи 1
1. 4 атома фосфора образуют по три связи, каждая связь образована одновременно двумя атомами. Значит, связей 4 · 3 : 2 = 6.
2. 4 атома могут образовывать прямоугольник, тетраэдр, либо квадрат. В прямоугольнике и квадрате не все связи имели бы одинаковую длину. Значит, Р4 – это тетраэдр.
Система оценивания:
Расчет количества связей 4 балла
Верное описание геометрической формы молекулы или рисунок 4 балла
ИТОГО 8 баллов
Решение задачи 2
1. M = 550 · (5 · 12 + 8 · 1) = 37400.
2. Найдем интервал, в котором находится n.
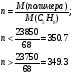
То есть n равно 350.
3. 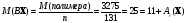 ⇒Ar(X) = 14.
⇒Ar(X) = 14.
Значит, Х – это азот, N.
Система оценивания:
Расчет молекулярной массы полимера 4 балла
Расчет степени полимеризации 4 балла
Верное определение элемента X 4 балла
ИТОГО 12 баллов
Решение задачи 3
1. В
2. А
3. Б
a. – Аргон
b. – Хром
c. – Бром
d. – Никель
e. – Галлий
f. – Индий
g. – Скандий
Система оценивания:
По 1 баллу за каждую пару планета - металл 3 балла
По 1 баллу за каждое верное название химических элементов 7 балла
ИТОГО 10 баллов
Решение задачи 4
Рассчитаем массу исходного раствора и массу вещества в нем.
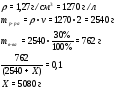
Масса вещества в исходном растворе равна 762 г
То есть необходимая масса воды равна 5080 г
Система оценивания:
Расчет массы вещества в исходном растворе 3 балла
Расчет необходимой массы воды 3 балла
ИТОГО 6 баллов
Решение задачи 5
Определим атомное отношение элементов в составе X.
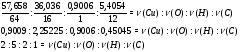
Эмпирическая формула – Cu2O5H2C.
Рациональная формула – (CuOH)2CO3.
Степень окисления кислорода (-2), водорода (+1) и углерода (+4) можно назвать сразу.
Определим степень окисления Cu.
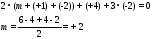
Cu+2
Систематическое название – дигидроксокарбонат меди(II)
Тривиальное название – малахит.
Система оценивания:
Эмпирическая или рациональная формула 5 баллов
Верное определение степени окисления – 1,5*4=6 баллов 6 баллов
Систематическое или тривиальное название 3 балла
ИТОГО 14 баллов
ИТОГО 50 баллов
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
9 класс
Решения
Решение задачи 1
1. а 2. в 3. в 4. а 5. б 6. а 7. г 8. б
Система оценивания:
По 1 баллу за каждый верный ответ 8 баллов
ИТОГО 8 баллов
Решение задачи 2
1. V = abc = 6 · 5 · 3 = 90 м3 = 90000 л.
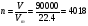 моль воздуха.
моль воздуха.
N = NA · n = 6.02 · 1023 · 4018 = 2.4 · 1027 молекул.
2. 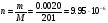 моль.
моль.
N = NA · n = 6.02 · 1023 · 9.95 · 10−6 = 6.0 · 1018 атомов Hg.
3. На 2.4 · 1027 молекул воздуха приходится 6.0 · 1018 атомов Hg, пусть на 109 приходится х. Тогда х можно найти из пропорции.
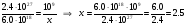
Предельно допустимое значение – 1.1 атом на миллиард – превышено, в лаборатории работать нельзя.
Система оценивания:
Расчет количества частиц ртути в воздухе лаборатории 3 балла
Количество моль газов в лаборатории при н.у. – 2 балла 4 балла
Количество частиц в газе – 2 балла
Количества атомов ртути на миллиард молекул воздуха – 3 балла 5 баллов
Верный ответ, учитывая ПДК – 2 балла
ИТОГО 12 баллов
Решение задачи 3
4 С3Н5N3O9 → 6 N2 + 12 CO2 + 10 H2O + O2
Рассчитаем количество вещества тринитроглицерина, газов и их объем.
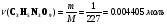
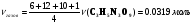
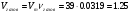 л.
л.
Общая масса смеси равна массе исходного тринитроглицерина (1.00 г), поскольку других реагентов не участвует, а все продукты – газы. Значит, плотность равна 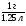 = 0.80 г/л.
= 0.80 г/л.
Объем равен 1,25 л, плотность равна 0,80 г/л.
Рассчитаем массу порции тринитроглицерина.
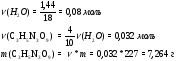
Для расчета количества теплоты составим пропорцию
1000 г – 6535 кДж
7,264 г – x кДж
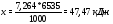
Выделилось 47,47 кДж теплоты.
Система оценивания:
Уравнение реакции 3 балла
Объем газовой смеси – 2 балла 4 баллов
Плотность газовой смеси – 2 балла
Количество выделившейся при взрыве теплоты 3 балла
ИТОГО 10 баллов
Решение задачи 4
Исходя из цепочки, соединение X1 – оксид, проведем расчеты и определим его формулу:
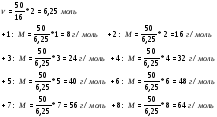
По расчетам видно, что элемент X – S.
X – S X1 – SO2 X2 – Na2SO3 X3 - Na2S2O3 X4 - Na2S4O6
1 – S + O2→SO2
2 – SO2 + 2NaOH →Na2SO3 + H2O
3 – Na2SO3 + S →Na2S2O3
4 – 2Na2S2O3 + I2→Na2S4O6 + 2NaI
Структурная формула соединения X4
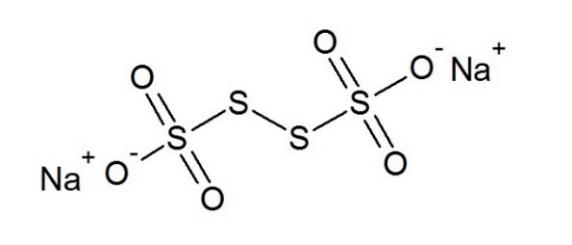
Система оценивания:
Вещество X – 2 балла 4 балла
Вещества X1-X4 – 0,5*4 = 2 балла
Уравнения реакций 1-4 – 0,5*4=2 балла 2 балла
Структурная формула соединения X5 2 балла
ИТОГО 8 баллов
Решение задачи 5
Проще всего начать “распутывать” задачу со второго абзаца. Проведем расчеты и определим вещества Y и C:
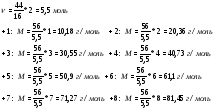
Из расчетов можно предположить, что подходит P+3(P2O3), однако известен цвет соединения Y, поэтому можно спокойно говорить, что Y – V2O5.
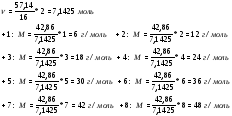
По расчетам видно, что помимо кислорода в соединении C находится C+2, C – CO и X – C.
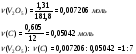
Реакция 2: V2O5 + 7C → 5CO + 2VC
D – VC.
Вернемся к первому абзацу:
«лисий хвост» - NO2, B - NO2, учитывая информацию о веществе Aи X – C, A– CO2
Реакция 1: Cгр + 4HNO3(конц)→ CO2 + 4NO2 + 2H2O
Удушливый газ с запахом прелого сена – фосген, F – COCl2
Реакция 3: COCl2 +H2O→ CO2 + HCl
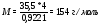 M = (154 – 35,5*4)/1 = 12 г/моль
M = (154 – 35,5*4)/1 = 12 г/моль
E – CCl4
Реакция 4: 3CCl4 + Al2O3→ 3COCl2 + 2AlCl3
Алмаз
Система оценивания:
ВеществaX, Y, A-F – 1*8=8 баллов 10 баллов
Уравнения реакций 1-4 – 0,5*4=2 балла
Название наиболее инертной формы 2 балла
ИТОГО 12 баллов
ИТОГО 50 баллов
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
10 класс
Решения
Решение №1 (10 баллов)
1. SO2, SO3.
(За каждое правильное соединение по 1.5 балла)
2. A – SCl2, уравнение реакции гидролиза:
2SCl2 + 2H2O → S + SO2 + 4HCl
(За правильное соединение А 2 балла, за правильное уравнение реакции 1 балл)
3. Уравнение реакции гидролиза:
2S3Cl2 + 2H2O → 5S + SO2 + 4HCl
(За правильное уравнение реакции 1 балл)
4. Б – SO2Cl2. Уравнение реакции со щелочью:
SO2Cl2 + 4NaOH → Na2SO4 + 2NaCl + 2H2O
(За правильное соединение Б 2 балла, за правильное уравнение реакции 1 балл)
Решение №2 (10 баллов)
1. Это оксид хрома (VI) – CrO3. Он образуется по реакции:
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
(За формулу соединения 2 балла, за правильное уравнение реакции 1.5 балла)
2. 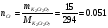 моль.
моль.
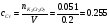 моль/л.
моль/л.
(За правильную молярную концентрацию 2 балла)
3. Основная часть хромовой смеси – концентрированная серная кислота, плотность которой значительно больше плотности воды. Поэтому плотность хромовой смеси тоже больше плотности воды.
(За правильный ответ и обоснование 1 балл, без обоснования 0 баллов)
4. Молярная масса «едких паров»: M = Dвозд· 29 = 5.34 · 29 = 155 г/моль.
Судя по продуктам реакции со щелочью, пары содержат хром, хлор и, возможно, кислород. Тогда для формулы CrxOyClz по молярной массе подходит единственный вариант: CrO2Cl2.
Уравнение реакции со щелочью:
CrO2Cl2 + 4KOH → K2CrO4 + 2KCl + 2H2O.
(За правильную форму соединения 2 балла, за уравнение реакции 1.5 балла)
Решение №3 (10 баллов)
1. Структуры 3 изомеров пентана.

(За каждый правильный изомер по 1 баллу)
2. Первичные, вторичные и третичные атомы углерода содержит второй изомер.

(За правильный изомер 1 балл)
3. Только одно монохлорпроизводное образует неопентан.

(За правильный изомер 1 балл)
4. Два дихлорпроизводных образует также неопентан: 1,1-дихлор-2,2-диметилпропан и 1,3-дихлор-2,2-диметилпропан.

(За правильный изомер 1 балл, за каждое правильную структурную формулу дихлорпентана по 1 баллу, за каждое правильное название по 1 баллу)
Решение №4 (10 баллов)
1. N2 + 3H2 → 2NH3
Весь азот не прореагировал, потому что реакция обратима.
(За правильное уравнение 1 балл, за обоснование обратимости 1 балл)
2. Получилось 1.8 моль NH3, значит, прореагировало 0.9 моль азота и 2.7 моль водорода. Тогда оставшиеся количества азота и водорода равны:
n(N2) = 1.5 − 0.9 = 0.6 моль, n(Н2) = 5 − 2.7 = 2.3 моль.
(За каждое верное количество по 2 балла)
3. л.
(За правильный расчет объема 2 балла)
4. Соляной кислотой поглощается аммиак.
 л.
л.
Объем уменьшится в  =1.62 раз.
=1.62 раз.
(За правильный расчет 2 балла)
Решение №5 (10 баллов)
СН4 + 2О2 → СО2 + 2Н2О и 2СН4 + 3О2 → 2СО + 4Н2О
(За каждое правильное уравнение реакции по 1.5 балла)
2. 1 мл = 10−6 м3, значит, в 1 мл содержится 0.5·10−6 мг = 5·10−10 г угарного газа. Найдем, скольким молекулам это соответствует.
 моль.
моль.
N = NA · n = 6.02 · 1023 ·  = 1.1 · 1013 молекул СО.
= 1.1 · 1013 молекул СО.
(За правильный расчет количества молекул 3 балла)
3. За 8 ч (то есть 480 мин) рабочий совершит 480 · 20 = 9600 вдохов. Объем каждого вдоха – 0.45 л, значит, суммарный объем, прошедший через легкие рабочего, равен 0.45 · 9600 = 4320 л = 4.32 м3. ПДК составляет 0.02 мг/м3, масса СО составит
m = 0.02 мг/м3 · 4.32 м3 = 0.086 мг = 8.6 · 10−5 г.
(За правильный расчет массы 4 балла)
Всероссийская олимпиада школьников по химии
2018-2019 учебный год
Школьный этап
11 класс
Решения
Решение №1 (8 баллов)
А – СО.
Б – Cl2.
В – COCl2: СО + Cl2 → COCl2
Д – Н2, Е – СН4: 3H2 + CO → CH4 + H2O
Ж – РН3: PH3 + 3Cl2 → PCl3 + 3HCl.
(за каждое правильное соединение и уравнение по 1 баллу)
Решение №2 (8 баллов)
Реагенты и продукты реакций:

(За каждое правильную структурную формулу по 1 баллу)
Решение №3 (10 баллов)
Алкены реагируют с бромом в мольном соотношении 1:1.
Составим уравнение, по которому можно вычислить брутто – формулу алкена по массам образовавшегося Г и затраченного В:
 ;
;
 ;
;
Отсюда, x = 6, тогда брутто – формула алкена C6H12, выбор состоит из следующих изомеров:
1 2 3
Очевидно, что нам подходит только 1 изомер, так как только образующий его алкан будет давать при хлоривании 2 монохлорпроизводных.
Следовательно, можно записать вещества и реакции:
(За каждую правильную структуру по 2 балла)
Б – 2 бром- 2,3 диметилбутан В – 2,3 диметилбутен-3
(За каждое правильное название по 1 баллу)
Решение №4 (12 баллов)
1) Рассчитаем количество водорода, пошедшего на гидрирование ацетилена.
C2H2 + 2 H2 → C2H6

 n(H2) = 2n(C2H2) = моль.
n(H2) = 2n(C2H2) = моль.
Далее рассчитаем эквивалент молярной массы для металла А:

 M(A) =
M(A) =  = 28.0·n
= 28.0·n
| n = 1 | 28 г/моль Si |
| n = 2 | 56 г/моль Fe |
| n = 3 | 84 г/моль Kr |
При переборе видно, что лучше всего условиям задачи удовлетворяет железо.
Тогда: А = Fe Г = Fe(OH)3
Б = FeCl2 Д= Fe2O3
В= FeCl3
(За металл А 2.5 балла, за каждое правильное соединение по 1 баллу)
Также для проверки элемента можно посчитать массу Г при прокаливании:
2Fe(OH)3 → Fe2O3 + 3H2O
г.
2)Fe + 2HCl → FeCl2 + H2(1)
2FeCl2 + Cl2 → 2FeCl3 (2)
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl (3)
2Fe(OH)3 → Fe2O3 + 3H2O(4)
(За каждое уравнение реакции по 1 баллу)
3) Сталь, чугун, ферротитан, фехраль и др.
(За каждый верно указанный сплав по 0.5 балла, максимум 1.5 балла)
Решение №5 (12 баллов)
H+р-р + OHр-р→H2Oж
(За правильное уравнение 2 балла)
При сливании двух растворов проходит реакция:
HCl + KOH → KCl + H2O
Но необходимо узнать, какое вещество находится в недостатке:

 моль;
моль;

 моль.
моль.
Видно, что HCl в недостатке, тогда:

 моль/л.
моль/л.
(За правильную концентрацию 4 балла)
а) Сначала необходимо найти количество ионов H+ в растворе серной кислоты:
моль.
Тогда количество образовавшейся воды и теплоты будет в  раза меньше.
раза меньше.
(За правильное отношение 3 балла)
б) Если взять 20 мл, то количество H+ пропорционально возрастет:
 моль.
моль.
Теперь уже KOH в недостатке, и количество образовавшейся воды и энергии будет в раза больше.
раза больше.
(За правильное отношение 3 балла)







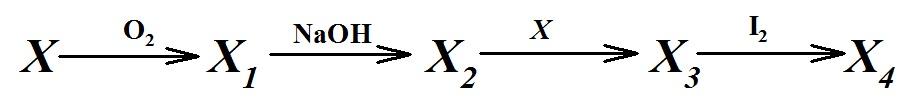
 образуется соединение Б. Количества выделившегося при растворении А водорода достаточно для полного гидрирования 1.160 г ацетилена. Окислением соединения Б хлором можно получить соединение В. При добавлении разбавленной щелочи к раствору В выпадает бурый студенистый осадок Г. При прокаливании Г при температуре 600°С образуется соединение Д массой 7.14 г.
образуется соединение Б. Количества выделившегося при растворении А водорода достаточно для полного гидрирования 1.160 г ацетилена. Окислением соединения Б хлором можно получить соединение В. При добавлении разбавленной щелочи к раствору В выпадает бурый студенистый осадок Г. При прокаливании Г при температуре 600°С образуется соединение Д массой 7.14 г.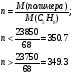
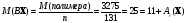 ⇒Ar(X) = 14.
⇒Ar(X) = 14.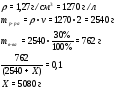
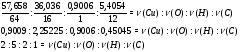
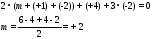
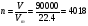 моль воздуха.
моль воздуха.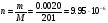 моль.
моль.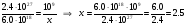
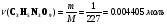
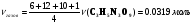
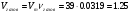 л.
л.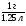 = 0.80 г/л.
= 0.80 г/л.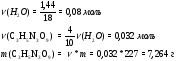
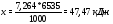
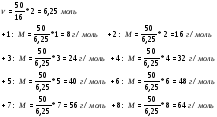

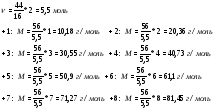
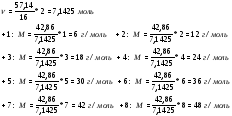
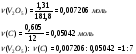
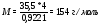 M = (154 – 35,5*4)/1 = 12 г/моль
M = (154 – 35,5*4)/1 = 12 г/моль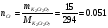 моль.
моль.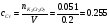 моль/л.
моль/л.










