Урок № Тема: Закон сохранении внутренней энергии и уравнение теплового баланса.
Цель урока: выяснить физическое содержание закона сохранения энергии для тепловых процессов; вывести уравнение теплового баланса.
Демонстрации: смешивание холодной и горячей воды в термосе.
Ход урока
План изложения нового материала:
Закон сохранения энергии в тепловых процессах.
Уравнение теплового баланса.
Калориметр.
Изучение нового материала
Закон сохранения энергии в тепловых процессах
Приступая к изложению нового материала, можно заметить, что среди законов физики есть такие, которые очень широко применяются в описании поведения тех или иных систем. Закон сохранения энергии в тепловых процессах принадлежит к таким законам.
Ранее уже было получено выражение вида:  U = Q + А
U = Q + А
Чтобы понять смысл этого выражения, важно прежде всего определить рамки его применения. Данное соотношение справедливо для изолированных систем.
Опр. Система называется изолированной, если теплообмен и совершаемая работа происходят только между телами данной системы.
Для такой системы изменение внутренней энергии всегда равно нулю:  U = 0
U = 0
При этом суммарная работа в системе тоже равна нулю: А = 0.
Равно нулю и суммарное количество отданного и полученного телами тепла: Q = 0.
Закон сохранения энергии в тепловых процессах
Для любой изолированной системы при любых изменениях внутри нее внутренняя энергия остается неизменной.
т. е. U = const, или  U = 0.
U = 0.
Этот закон косвенно подтверждает невозможность остановки теплового движения.
2. Уравнение теплового баланса
Как можно применять этот закон?
Если привести в соприкосновение два тела разной температуры 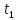
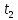 , то, во-первых, теплообмен будет протекать до тех пор, пока температуры тел не сравняются, и, во-вторых, первое тело будет передавать тепла Qomд ровно столько, сколько второе тело получит.
, то, во-первых, теплообмен будет протекать до тех пор, пока температуры тел не сравняются, и, во-вторых, первое тело будет передавать тепла Qomд ровно столько, сколько второе тело получит.
Таким образом, из закона сохранения тепловой энергии получим:
Уравнение теплового баланса:  =
= 
Критерием истинности является практика. Поэтому, используя термос, смешаем фиксированные массы горячей и холодной воды с заданными температурами. Затем, минуты через две, измерим температуру смеси 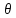 .
.
После этого, используя уравнение теплового баланса, рассчитаем температуру смеси:
Пусть  - масса горячей воды,
- масса горячей воды, 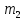 - масса холодной воды, тогда:
- масса холодной воды, тогда:
 = 0,2 кг
= 0,2 кг 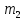 = 0,1 кг
= 0,1 кг
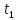 =
= 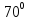 С
С 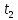 =
= 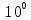 С
С
Используя  =
=  , получим
, получим
с (
(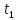 -
- 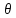 ) = с
) = с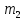 (
(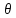 -
- 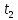 )
)
0,2·70 - 20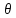 = 0,1
= 0,1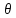 - 0,1·10
- 0,1·10
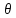 =
=  С
С
Затем сравнивая измеренное значение 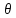 с рассчитанным, мы убеждаемся, что
с рассчитанным, мы убеждаемся, что 

 .
.
3.Калориметр
Обычно при проведении лабораторных работ пользуются более простыми приборами, которые называют калориметрами.
Опр. Калориметр - это два цилиндрических сосуда с разными диаметрами. Между их дном и стенками - воздушный зазор, который уменьшает теплоотдачу в окружающую среду.
Калориметр назван по единице измерения количества теплоты в старой системе измерений.
1 калория - количество теплоты, необходимое для нагревания 1 г воды на 1°С.
Легко найти связь между 1 кал и 1 Дж:
Q = cm t = 4200
t = 4200  · 0,001 кг ·
· 0,001 кг ·  С = 4,2 Дж
С = 4,2 Дж
Таким образом:
1 кал = 4,2 Дж,
1 ккал = 4200 Дж.
Закрепление изученного материала
Докажите, что ветряные мельницы (двигатели) работают за счет энергии солнечных лучей.
Стальной шарик равномерно падает в касторовом масле. Совершается ли при этом работа? Какие превращения энергии при этом происходят?
Изменяется ли потенциальная энергия медного шара, лежащего на горизонтально расположенной поверхности стола, если повысить его температуру?
Со дна водоема всплывает пузырек воздуха. Совершает ли воздух работу?
Домашнее задание: §7 - 9






 U = Q + А
U = Q + А U = Q + А
U = Q + А 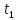
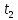 , то, во-первых, теплообмен будет протекать до тех пор, пока температуры тел не сравняются, и, во-вторых, первое тело будет передавать тепла Qomд ровно столько, сколько второе тело получит.
, то, во-первых, теплообмен будет протекать до тех пор, пока температуры тел не сравняются, и, во-вторых, первое тело будет передавать тепла Qomд ровно столько, сколько второе тело получит. =
= 
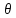 .
. - масса горячей воды,
- масса горячей воды, 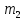 - масса холодной воды, тогда:
- масса холодной воды, тогда: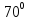 С
С 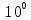 С
С









