МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ШКОЛА № 118 ГОРОДА ДОНЕЦКА»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА БИНАРНОГО УРОКА
ПО ХИМИИ И ГЕОГРАФИИ НА ТЕМУ:
Железо. Строение атома. Нахождение в природе.
Физические и химические свойства.
Значение железа, его соединений и сплавов в природе.
Применение соединений железа.
Состав металлургического комплекса.
Черная, цветная металлургия. Сырьевая база.
Принципы размещения предприятий отрасли.»

Выполнили:
учитель химии
Коморная Е.Л.,
учитель географии
Гавенко Н.В.
Донецк – 2021
Урок № 56
Тема: Железо. Строение атома. Нахождение в природе. Физические и химические свойства. Значение железа, его соединений и сплавов в природе. Применение соединений железа. Состав металлургического комплекса. Черная, цветная металлургия. Сырьевая база. Принципы размещения предприятий отрасли. Типы предприятий.
Цели урока:
Воспитательные:
1. Способствовать развитию положительной мотивации обучения, используя привлечение учащихся к подготовке занимательных опытов, сообщений о роли железа и сплавов на его основе, лабораторной работы, мультимедийного сопровождения;
Воспитывать чувство хозяина своей земли.
Образовательные:
1. На основе уже имеющихся общих знаний о металлах, дать представление о физических и химических свойствах железа как химического элемента побочной подгруппы.
2. Дать представление о технологии производства чугуна и стали.
3. Совершенствовать навыки работы с реактивами при выполнении опытов, соблюдать правила БЖД, раскрыть значение железа и его сплавов в природе и жизни человека.
Развивающие:
1. Развивать мыслительных способностей: умения пользоваться опорными знаниями, умения сравнивать, обобщать, делать выводы, объяснять ход эксперимента; навыки самостоятельности в получении исследовательских навыков, способности к рефлексии, коммуникативные умения.
Тип урока: интегрированный урок изучения нового материала.
Оборудование: мультимедийный проектор, фрагмент фильма о технологии производства чугуна и стали, периодическая таблица Д.И. Менделеева, таблица растворимости веществ, ряд активности металлов, тесты, наборы оборудования для эксперимента, учебники химии и географии, контурные карты коллекция «Металлы и их сплавы».
Ход урока
I. «Вызов»
Актуализация опыта и предыдущих знаний и активизация деятельности учащихся.
Прием «Что это…» Определите, о каком элементе идет речь?
-
Когда люди только научились добывать и обрабатывать его, оно стоило дороже золота.
-
Ещё древние люди иногда находили эти самородки, зачастую метеоритного происхождения, и изготавливали из них орудия труда и оружие.
-
Наша кровь имеет красный цвет именно благодаря этому элементу, которое входит в состав красных кровяных телец, переносящих кислород. У некоторых моллюсков аналогичные процессы основаны не на нем, а на меди, поэтому кровь у них голубого цвета.
Учитель химии: Гвоздем нашего сегодняшнего урока-исследования будет железо. (Определение целей и основных задач-этапов урока.)
Составим дорожную карту наших исследований.
Прием «Знаю – хочу узнать – узнал» - это работа с таблицей.
При изучении темы, на стадии вызова, учащимся можно предложить объединиться в пары, посовещаться и заполнить 1 графу таблицы (что я знаю по теме: это могут быть какие-то ассоциации, конкретные исторические сведения, предположения), после обсуждения полученных результатов в классе учащиеся сами формулируют цели урока: что я хочу узнать? для устранения пробелов в собственных знаниях и заполняют 2 графу.
Учитель географии: вспомним материал 8 класса: Какие полезные ископаемые принадлежат к рудам черных металлов, цветных?
(Ответы учеников.)
II. «Осмысление».
Учитель химии: Определите положение железа в ПСХЭ.
(Ответы учеников.)
1. Прием «Чтение с пометками INSERT».
Идёт работа с текстом и его маркировка, учащимся предлагается по ходу текста ставить следующие знаки:
V - уже известно
+ абсолютно новое, неожиданное;
- противоречит твоим представлениям;
? хочется узнать что-то больше.
На данной стадии идёт соотношение уже известного с тем, “что узнал”. Происходит структурная организация информации в памяти. Можно спросить, у учащихся, какие у них были знаки?
Текст №1 (химический)
Природное железо представляет собой смесь четырех нуклидов с массовыми числами 54 (содержание в природной смеси 5,82% по массе), 56 (91,66%), 57 (2,19%) и 58 (0,33%). Конфигурация двух внешних электронных слоев 3s2p6d64s2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других.
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят, кроме железа, также кобальт (Co) и никель (Ni). Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0,126 нм, радиус иона Fe2+ — 0,080 нм, иона Fe3+ — 0,067 нм. Энергии последовательной ионизации атома железа 7,893, 16,18, 30,65, 57, 79 эВ. Сродство к электрону 0,58 эв. По шкале Полинга электроотрицательность железа около 1,8.
Железо высокой чистоты — это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механичской обработки. Железо – это элемент побочной подгруппы. Строение атомов элементов побочных подгрупп отличается от строения атомов главных подгрупп.
| Запомни! Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня. |
Текст №2 (географический). Нахождение в природе.
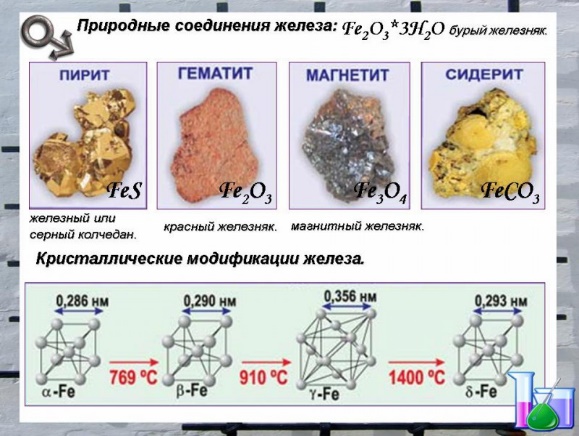
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10–5 — 1·10–8% железа.
Задание от географа: Вспомните, где расположены крупные месторождения железной руды. Обозначьте их на контурной карте.
2. Учитель химии предлагает рассмотреть образцы железа, находящиеся на их столах.
Что вы можете сказать о физических свойствах этого металла.
Ответ: серебристо-серый, тяжелый, ферромагнетик, ковкий, пластичный, тугоплавкий. Учащиеся отвечают на вопросы, учитель дополняет их, используя опорную схему «Железо и его характеристика»
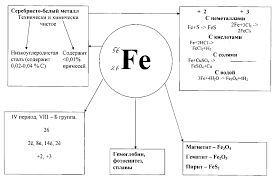
Закончите электронно-буквенную формулу и нарисуйте графическую формулу строения атома железа: 1s22s22p63s23p63d6….
Железо – такой же восстановитель, как и другие металлы, однако, атомы железа при окислении отдают не только электроны последнего уровня, приобретая степень окисления +2, но способны к отдаче 1 электрона с предпоследнего уровня, принимая при этом степень окисления +3.
Учитель географии: Какая отрасль промышленности занимается производством металлов? (Металлургическая)
Это целый комплекс – металлургический комплекс – основа индустрии. Состоит из черной и цветной металлургии.
Производство металлов – сложный процесс.
Черная металлургия – это производство металлов, основу которых составляет железо (чугун, сталь, ферросплавы), а также марганца и хрома. Черная металлургия охватывает добычу и обогащение железной руды, спекание ее в агломерат, производство кокса, огнеупоров, выплавку чугуна, стали, производство проката и изделий дальнейшей переработки.
Особенно велико значение стали, из этого конструкционного материала изготавливают всевозможные виды промышленной продукции. Попробуйте на минуту представить, что из нашего современного мира исчезла сталь. Разрушились бы заводы и трубопроводы, бытовая и сельскохозяйственная техника. Сталь можно сравнить с кальцием в организме человека, без кальция невозможна жизнь человека, без стали – промышленности.
Цветная металлургия – производство более 70 металлов, обладающих ценными свойствами (меди, алюминия, свинца, цинка и т.д.)
Значение металлургии в хозяйстве страны.
1. Продукция металлургического комплекса служит фундаментом для машиностроения.
2. Продукция широко используется в строительстве, на транспорте, в электротехнике, в атомной промышленности и химической промышленности.
3. На долю металлургии приходится 16% общего объема промышленного производства России,10% занятого в промышленности населения.
4. Комплекс потребляет 25% добываемого в стране угля, 25% производимой электроэнергии, 30% грузовых железнодорожных перевозок.
5. Продукция металлургии одна из основных статей экспорта России.
6. По экспорту стали Россия занимает 1-е место в мире, по производству стали 4-е после Китая, Японии, США.
Факторы, влияющие на размещение
1. Трудоемкость – затраты труда на выпуск единицы продукции.
В среднем на металлургическом заводе работают от 20 до 40 тыс.человек, а это население небольшого города.
2. Концентрация – сосредоточение больших объемов производства на одном предприятии.
Более 50% черных металлов и 49% цветных выплавляются на 5% промышленных предприятий. Такая высокая концентрация способствует удешевлению продукции, но усложняет реагирование на изменение рынка.
3. Комбинирование – объединение на одном предприятии кроме основного производства, производств, связанных с основным технологически и экономически.
В составе металлургического комбината кроме металлургического производства бывает производство цемента и строительных материалов, производство азотных удобрений.
4. Экологический фактор – негативное влияние на окружающую среду. Около 20% выбросов в атмосферу и сточных вод. На долю черной металлургии приходится 15% от выбросов промышленности в атмосферу и 22% на долю цветной металлургии
5. Транспортный фактор – современный металлургический комбинат получает и отправляет столько же грузов, сколько крупный город, поэтому он не может работать без железной дороги.
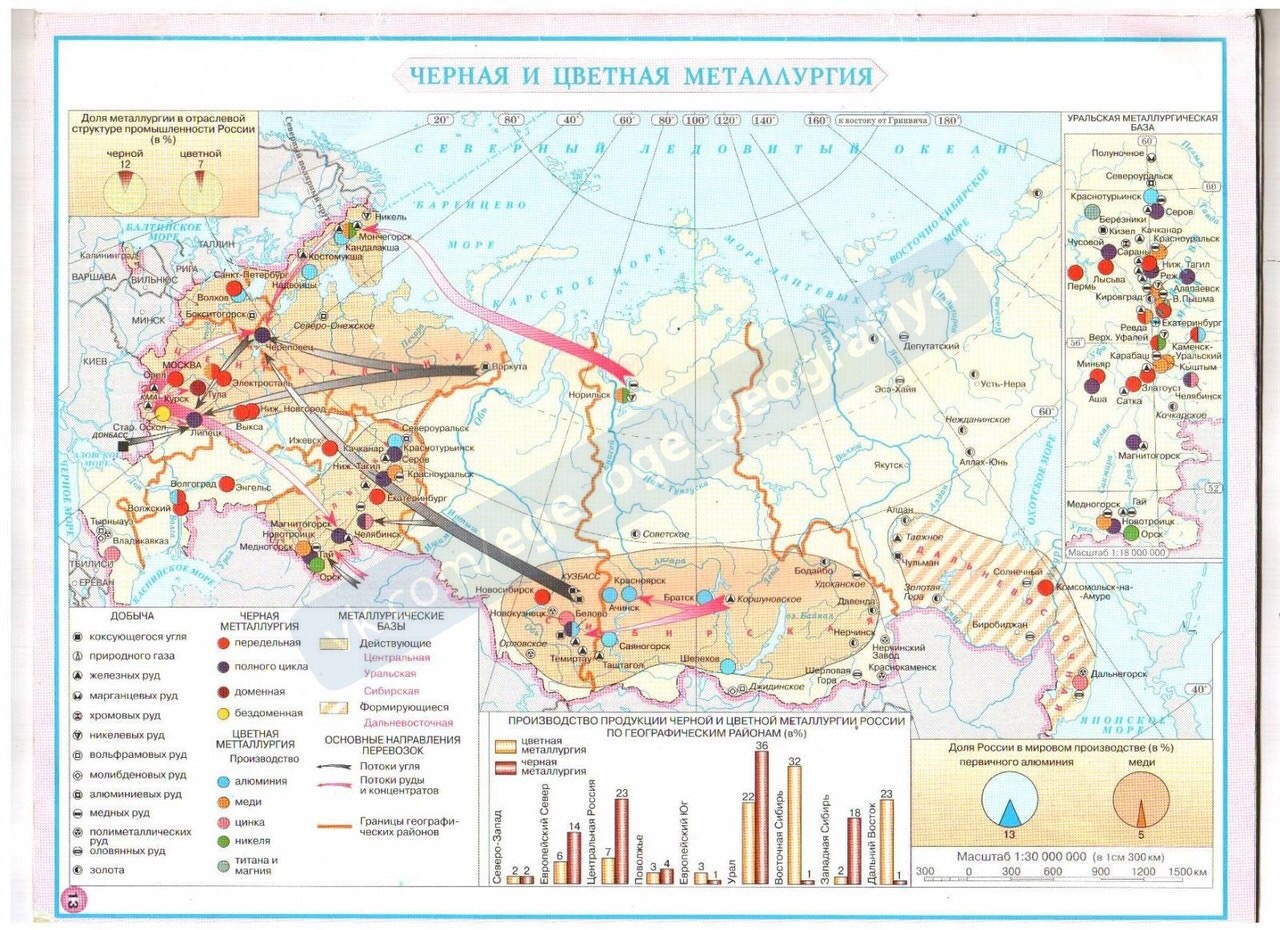 Металлургические предприятия выгодно создавать в районах добычи руд (Урал, Норильск), в районах добычи топлива (Кузбасс) или производства дешевой электроэнергии (Южная Сибирь), на пересечении потоков руды и угля (Череповец), в районах потребления готовой продукции (Санкт-Петербург или Москва).
Металлургические предприятия выгодно создавать в районах добычи руд (Урал, Норильск), в районах добычи топлива (Кузбасс) или производства дешевой электроэнергии (Южная Сибирь), на пересечении потоков руды и угля (Череповец), в районах потребления готовой продукции (Санкт-Петербург или Москва).
III. Стадия “размышления” (рефлексия)
Учащиеся должны попробовать выразить информацию, которую получили своими словами. (Работа с графой №3 таблицы - "Что узнал?").
Работа в группах (дифференцированные задания). Выяснили, какие новые понятия они увидели в тексте. (Эти пояснения записываем в 3-ю колонку).
1. Составить уравнения реакций взаимодействия железа с простыми веществами: серой, кислородом, хлором. Расставить коэффициенты методом электронного баланса.
2. Составить уравнения реакций взаимодействия железа со сложными веществами: соляной кислотой, сульфатом меди. Написать уравнения реакций в ионном виде.
3. Какие из реакций соответствуют схеме Fe+2 ® Fe+3
FeCI2 + CI2 = FeCI3 (верный)
FeCI3 + NaOH = Fe(OH)3 + 3NaCI
Fe(OH)2 + O2 + H2O = Fe(OH)3 (верный)
Найти ошибки в уравнениях. Расставить коэффициенты методом электронного баланса.
Физкультминутка
Железный век остался далеко позади в нашей истории, но именно благодаря железу и умению его обрабатывать люди сумели построить современную цивилизацию. Многие сплавы, широко применяемые в промышленности, также имеют в себе определённый процент железа. Да что там говорить — оно есть даже в нашей крови, и без него мы попросту не смогли бы жить. Этот металл так широко распространён, но при этом так важен, что просто диву даёшься.
Просмотр видеоролика о сплавах на основе железа.
Рассказать о распространенности железа в земной коре. Среди предложенных образцов выбрать важнейшие руды железа и назвать их.
Работа в группах. На этом этапе учащиеся самостоятельно углубляют и расширяют знания по вопросам:
Природные соединения Железа (их названия, состав, важнейшие месторождения).
Применение железа и его соединений.
Биологическая роль железа в человеческом организме (последствия недостатка и профилактика)
Каждая группа получает задания на дорожно-инструктивной карте. Ответ в виде кластера.
Контроль знаний учащихся:
Решение расчетной задачи:
Какую массу железа можно получить из образца железной руды массой 600 грамм, содержащей 90% магнитного железняка?
600:100*90=540г
Выполнение теста по двум вариантам с самопроверкой

Подведение итогов и выставление оценок по картам оценивания.
-
Узнал(а) много нового.
-
Мне это пригодится в жизни.
-
Было над чем подумать.
-
На возникшие вопросы я получил(а) ответ.
-
Поработал(а) добросовестно, цель достигнута.
Домашнее задание.
Изучить параграф учебника.
Составить кроссворд по теме «Сплавы на основе железа».
Отметить на контурной карте центры производства черных и цветных металлов.









 Металлургические предприятия выгодно создавать в районах добычи руд (Урал, Норильск), в районах добычи топлива (Кузбасс) или производства дешевой электроэнергии (Южная Сибирь), на пересечении потоков руды и угля (Череповец), в районах потребления готовой продукции (Санкт-Петербург или Москва).
Металлургические предприятия выгодно создавать в районах добычи руд (Урал, Норильск), в районах добычи топлива (Кузбасс) или производства дешевой электроэнергии (Южная Сибирь), на пересечении потоков руды и угля (Череповец), в районах потребления готовой продукции (Санкт-Петербург или Москва).




















