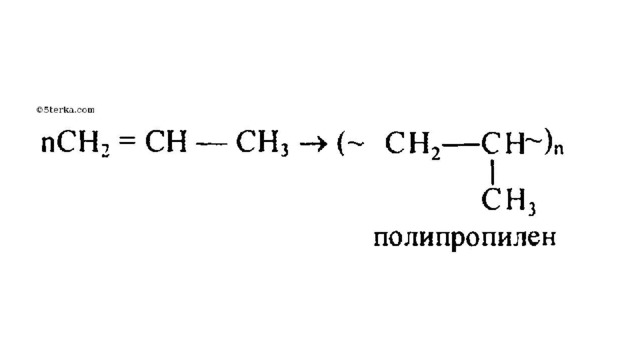Этилен и пропилен — простейшие представители алкенов

ЭТИЛЕН (ЭТЕН) СН 2 = СН 2
- Этилен — это бесцветный горючий газ со слабым сладковатым запахом. Он легче воздуха и частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворятся в диэтиловом эфире и углеводородах
- Этилен применяется в производстве полиэтилена, поливинилхлорида, окиси этилена, этилового спирта, этилбензола, уксусного альдегида и других органических продуктов, а также для холодильных установок. В овощехранилищах для ускорения созревания плодов

ПРОПИЛЕН (ПРОПЕН) СН 2 = СН – СН 3
- Пропилен - это бесцветный газ со слабым неприятным запахом, с низкой температурой кипения (tкип= −47,7 °C) и низкой температурой плавления (tпл= −187,6 °C). Пропилен в больших концентрациях (порядка десятков процентов в воздухе) обладает наркотическим эффектом, возможна потеря сознания или даже летальный исход
- Пропилен используется для производства полипропилена, окиси пропилена, нитрила акриловой кислоты, изопропилового и бутиловых спиртов, изопропилбензола, глицерина и других органических продуктов

Химические свойства
- Отличительной чертой представителей алкенов является способность вступать в реакции присоединения с разрывом двойной связи
1. Гидрирование алкенов
CH₃—СН = СН₂ + Н₂ CH₃—СН₂—СН₃
Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:

Химические свойства
2. Галогенирование (присоединение галогенов).
- Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl₄) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов (качественная реакция на двойную связь):
CH 3 – CH = CH 2 + Br 2 CH 3 – CH –CH 2
Br
Br
1,2-дибромпропан
https://www.youtube.com/watch?v=nbyWphHCfOg
(опыт)

Химические свойства
3. Гидрогалогенирование (присоединение галогеноводорода)
- Подчиняется правилу Марковникова :
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
Марковников Владимир Васильевич
(1837—1904)
CH₂ = CH – CH₃ + HCl CH₃ – CH – CH₃
Cl
2-хлорпропан

Химические свойства
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
CH₂ = CH₂ + H₂O СН₃—СН₂ОН
Первичный спирт (с гидроксигруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты:
OH
H₂SO₄
CH ₂ = CH – CH 3
+ H₂O CH 3 – CH – CH 3
(Эта реакция также протекает в соответствии с правилом Марковникова)

Химические свойства
Реакция полимеризации процесс образования высокомолекулярного соединения (полимера) путем соединения друг с другом молекул исходного низкомолекулярного соединения (мономера)
Особым случаем присоединения является реакция полимеризации алкенов:
n CH₂ = CH₂ (… – CH₂ – CH₂ –…) n
УФ-свет, R
Полиэтилен - полимер
Этилен - мономер

Всем известный полиэтилен был получен был получен в 1933 году Э. Фосеттом и Р. Гибсоном
В 1943 году из полиэтилена стали изготавливать посуду, ящики, бутылки, упаковку, предметы домашнего обихода
Благодаря Его Величеству Случаю в 1938 году американский учёный Р. Планкетт получил тефлон, обладающий исключительной химической устойчивостью .
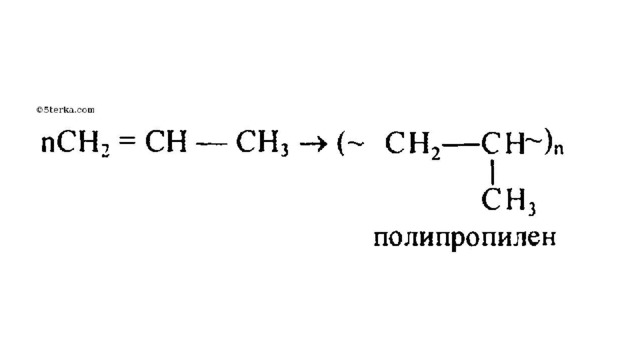
Химические свойства
Реакции окисления
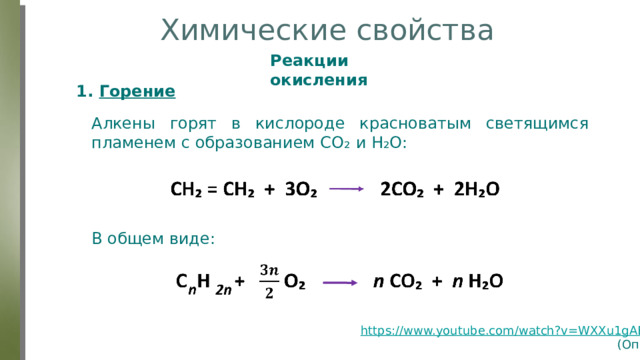
1. Горение
Алкены горят в кислороде красноватым светящимся пламенем с образованием СО ₂ и Н₂О:
В общем виде:
https://www.youtube.com/watch?v=WXXu1gAEtkI
(Опыт)

Химические свойства
2 . Окисление в растворах. В отличие от алканов, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до двухатомных спиртов ( реакция Вагнера ):
3 CH₂ = CH₂ + 2 KMnO₄ + H₂O 3 CH₂ – CH₂ + 2 KOH + 2 MnO₂
OH
OH
Этиленгликоль
https:// www.youtube.com/watch?v=SvVYma6SRpo
(опыт)

Химические свойства
Окисление перманганатом калия в кислой среде:
5 CH 3 – CH = CH – CH 3 + 8 KMnO₄ + H₂SO₄
10 CH₃COOH + 4 K₂SO₄ + 8 MnSO₄ + 22 H₂O
Уксусная кислота
https://www.youtube.com/watch?v=hSTnuHivN0Y
(опыт)

ПРИМЕНЕНИЕ
- В овощехранилищах для ускорения созревания плодов.
- Производство органических соединений:
- полиэтилена , полипропилена, поливинилхлорида (ПВХ);
- растворителей;
- уксусной кислоты;
- спиртов.