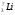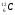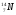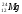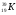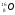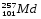Интегрированный урок в 8 классе на тему: «Строение атома»
Тип урока: повторительно-обобщающее учебное занятие путем интеграции двух предметов физики и химии.
Цели для учителей:
образовательная: повторить и обобщить знания о строении атома путем интеграции научных знаний, полученных на уроках физики и химии; установить уровень усвоения учебного материала по теме «Строение атома».
развивающая: развивать умения применять имеющиеся знания на практике; развивать способности анализировать, делать выводы; логически рассуждать, а в конечном итоге – способствовать развитию интеллекта и творческих способностей, развитию внимания, памяти и исследовательских навыков.
воспитательная: формировать познавательный интерес к физике и химии; способствовать формированию у учащихся уважения к научному познанию и убеждения в ценности научных знаний для разных областей человеческой деятельности, для повседневной жизни человека; формировать умение слушать своих товарищей, работать в коллективе; давать самооценку.
Форма организации учебной деятельности: сочетание фронтальной работы и работы в группах.
Оборудование:
Компьютер, мультимедиа
Экран;
Видеопроектор;
Компьютерная презентация;
На столах у детей:
Ход урока
I. Организационный этап
II. Мотивация
Физик.
Химик.
Урок хотелось бы начать с обращения к творчеству И.А. Бунина. (кто-нибудь из детей читает строчки из стиха)
(Слайд 1)
- Как ты таинственна, гроза,
Как я люблю твое молчанье
Твое внезапное блистанье,
Твои безумные глаза!
А вот еще слова:
- Свод радуги – творца благоговенье,
Он сочетает воздух, влагу, свет-
Все без чего для мира жизни нет!
Физик. Летняя гроза, узоры инея на стекле, сияющая в небе радуга – все это настолько близко и знакомо. Но думали вы о том, что такая наука, как физика, тоже заинтересовалась радугой, образованием инея, грозой. Только она придумала для них особое название, какое? (Физическое явление)
А что лежит в основе любого физического явления?(Физическое тело)
А из чего состоят тела?(Из молекул)
А молекулы?(Из атомов)
Физик. А какова же тема сегодняшнего урока? (Состав и важнейшие характеристики атома – с темой надо подумать, чтобы была и химия и физика)
Дети формулируют задачи, и цели урока.
III. Этап повторения и обобщения полученных знаний.
Химик/физик. Ребята давайте с вами вспомним, что такое атом? (здесь нужно провести срез знаний, мини тест, чтобы они проверили сами себя, обменяв тетради с соседом).
Какое строение имеет атом?
Каково строение ядра?
Каково строение электронной оболочки?
Физик. (проводим тест)
Учитель химии: Строение всех атомов зашифровано в периодической системе химических элементов Д. И. Менделеева. Вы, знаете, что каждому химическому элементу присвоен порядковый номер и для каждого элемента подсчитана атомная масса. Но это не просто числа, они имеют физический смысл. В чем он заключается, мы сейчас узнаем. Введем следующие обозначения
Z – порядковый номер химического элемента
A – массовое число, A=Ar
N – число нейтронов
Z – указывает на заряд ядра, а следовательно на число протонов, а так как атом нейтрален, то число протонов равно числу электронов.
А –сумма протонов и нейтронов в ядре атома
А = Z + N
Введем обозначение химического элемента:
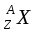
Х - символ химического элемента
Z - заряд ядра
А – массовое число
Например: условное обозначение ядра атома кислорода : 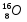
Zp = 8, Ze = 8, р = 16 – 8 = 8
Выполняют самостоятельно задание на карточках. Самопроверка.
Теперь надо объяснить, как происходит заполнение энергетических уровней, а затем на примере одно элемента записать и зарисовать строение атома.
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно 2n², где n— его номер. Значит, на первом уровне может находиться не более 2 электронов, на втором — не более 8, на третьем — не более 18 и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
H1)1.
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
He2)2.
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li3)2)1.
У следующих элементов второго периода электроны добавляются на второй уровень:
Be4)2)2; B5)2)3; C6)2)4; N7)2)5; O8)2)6; F9)2)7; Ne10)2)8.
У неона второй электронный слой завершён, так как содержит 8 электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na11)2)8)1; Mg12)2)8)2; Al13)2)8)3; Si14)2)8)4; P15)2)8)5; S16)2)8)6; Cl17)2)8)7; Ar18)2)8)8.
Максимальное количество электронов на третьем слое равно 18, но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более 8 электронов.
Обрати внимание!
На внешнем электронном слое не может быть более 8 электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
K19)2)8)8)1; Ca20)2)8)8)2.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Приложение № 1.
Задание: определить состав атома и его ядра
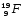 ,
, 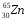 ,
, 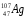 ,
, 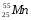 ,
, 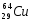 ,
,
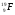 : Zp = 9, N =19 – 9 = 10, Ze = 9
: Zp = 9, N =19 – 9 = 10, Ze = 9
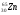 : Zp = 30, N =65 – 30 = 35, Ze = 30
: Zp = 30, N =65 – 30 = 35, Ze = 30
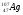 : Zp = 47, N =107 – 47 = 60, Ze = 47
: Zp = 47, N =107 – 47 = 60, Ze = 47
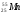 : Zp = 25, N =55 – 25 = 30, Ze = 25
: Zp = 25, N =55 – 25 = 30, Ze = 25
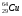 Zp = 29, N =64 – 29 = 35, Ze = 29
Zp = 29, N =64 – 29 = 35, Ze = 29
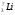
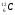
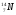
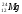
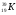
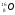
IV. Этап рефлексии.
1. Актуализация знаний.
Учитель химии Сегодня мы поговорим о строении атома. На всех прошедших уроках мы встречались с этим понятием. Наш век не случайно называют атомным ( атомные корабли,. Атомные электростанции, атомные бомбы ). К атомизму мы привыкаем с детства и не удивляемся тому, что все окружающие нас тела состоят из мельчайших частичек. Противоестественно не понимать величия атомистической идеи и не оценивать тех трудностей, которые удалось преодолеть человеческому уму на длительном пути её утверждения. Именно поэтому вы, как современные дети, должны знать об особенностях строения атома, иметь представление об элементарных частицах атома, познакомиться с ядерной моделью атома. Кроме того, сегодня на уроке мы ещё раз постараемся доказать, что именно строение атома является главной характеристикой элемента и вспомним, как определять число протонов, электронов в атоме любого химического элемента. Итак, тема нашего урока – «Строение атома». Тему дети записывают в тетрадь.
Учитель физики: Вопрос «Из чего образуются все вещи в мире?» интересовал ещё древнегреческих философов. В конце |V века до н.э.они первыми выработали понятие об элементе, атоме, химическом соединении. В ||| веке до н.э.в Китае появилось учение, согласно которому материя состоит из двух противоположностей, при соединении которых образуются тела. Последние могут делиться и распадаться на отдельные частицы, и такое деление может продолжаться бесконечно.
Первым, кто наиболее отчётливо высказал мысль об атомистическом строении вещества, принято считать древнегреческого мыслителя Демокрита, жившего в V веке до н.э. демонстрация портрета Демокрита. Демокрит пришёл в к выводу, что материя состоит из мельчайших частиц вещества, которые он назвал атомами, что в переводе с греческого означает «неделимый». Взгляды Демокрита изложены в поэме «О природе вещей», написанной римским философом и поэтом Лукрецием Каром более 2000 лет тому назад. Давайте прослушаем отрывок из этой поэмы. Будьте внимательны.
Выходит ученик, который читает отрывок из поэмы «О природе вещей»
«Выслушай то, что скажу, и ты сам, несомненно, признаешь,
что существуют тела, которых мы видеть не можем…
…Стало быть, ветры – тела, но только незримые нами.
…Далее, запахи мы обоняем различного рода,
хоть и не видим совсем, как в ноздри они проникают…
…Но это всё обладает, однако, телесной природой,
Если оно способно приводить наши чувства в движенье:
Ведь осязать, как и быть осязаемым, тело лишь может,
И, наконец, на морском берегу, разбивающем волны,
Платье сыреет всегда, а на солнце вися, оно сохнет;
Видеть, однако, нельзя, как влага на нём оседает,
Как и не видно того, как она исчезает от зноя.
Значит, дробится вода на такие мельчайшие части,
Что недоступны они совершенно для нашего взгляда.
Нам очевидно, что вещь от стирания становится меньше,
Но отделение тел, из неё каждый миг уходящих,
Нашим глазам усмотреть запретила природа ревниво…».
Учитель физики О каких же явлениях говорится в стихотворении?
Предполагаемый ответ В отрывке говорится об испарении, конденсации, диффузии.
Учитель химии К какому их видов явлений принадлежат те, о которых вы только что прослушали?
Предполагаемый ответ Испарение, конденсация, диффузия – примеры физических явлений.
Учитель физики О каких недоступных для нашего взгляда мельчайших частицах, на которые дробится вода, говорилось в отрывке?
Предполагаемый ответ Речь шла об атомах и молекулах.
2. Изучение нового материала.
Учитель химии Что касается Демокрита, то про подобного рода явления он писал: «Весь окружающий нас мир образован в результате соединения и разъединения атомов, вечно движущихся в бесконечной пустоте».
Позже стали говорить о том, что атомы имеют определённую форму, размеры, обладают маленькими отростками, с помощью которых переплетаются. Также была высказана мысль о «мельчайших частицах», которые всегда существовали в атоме и неотделимы от него. Естественно, атомы не воспринимаются нашими органами чувств, и учение об атомном строении вещества является плодом научной абстракции. Но все мы хорошо знаем, что абстракция и наблюдение у древнегреческих философов взаимно дополняли друг друга. И выводы об атомах были сделаны ими на основе видимых явлений. Например, холст или сукно, намокшие под дождём, высыхали на солнце, при этом глаз не замечал видимого отделения воды от материи (это знакомый вам процесс испарения). Пахучее вещество заполняло комнату своим ароматом, хотя частиц, распространявших запах, не видели. ( это явление диффузии). Воздух, заключённый в закрытый сосуд, оказывал сопротивление давлению, следовательно, невидимый воздух является доказательством реальности существования незримых частиц – атомов.
Учитель физики Исходя из вышесказанного, на основе имеющихся у вас знаний, давайте выстроим логическую цепочку молекулярного строения вещества.
Учитель показывает учащимся рисунки воздушного шара, капли воды, ключа; таблички с надписями «H2 «, «H 2O «, «Fe « и «резина и схемы молекул водорода, воды, железа. Их задача: разобрать их таким образом, чтобы каждому рисунку соответствовала табличка и прикрепить их соответственно на магнитной доске по принципу:
Физические тела ……………………………………………………………………………
Вещества ……………………………………………………………………………
Молекулы ……………………………………………………………………………
Учитель химии Что такое химический элемент?
Предполагаемый ответ Совокупность атомов одного и того же вида называется химическим элементом.
Учитель физики Да, сколько в природе химических элементов, столько и видов атомов – кирпичиков мироздания.
Итак, если все тела можно наэлектризовать, то можно предположить, что электроны (отрицательно заряженные частицы ) существуют во всех телах и «искать»их надо в атоме. В начале 20 века английский учёный Джозеф Джон Томсон предположил, что в атом входят ещё и положительно заряженные частицы, уравновешивающие заряд электрона. Томсон представил себе модель атома вроде булочки с изюмом ( сплошной шарик с положительным зарядом, внутри которого вкраплены отрицательно заряженные электроны.). Опыты по исследованию состава и строения атома были осуществлены английским физиком Резерфордом. Демонстрация портрета учёного Послушайте небольшое сообщение о Резерфорде.Заслушивание сообщения учащегося.
Ученик В конце 19 века учёные обнаружили, что такие химические элементы, как уран, радий, полоний, излучают лучи, подобные рентгеновским. Такое явление назвали радиоактивностью, а элементы – радиоактивными. Для изучения этих лучей был проведён следующий опыт. Соли радия поместили в свинцовую коробку с отверстием и внесли в электромагнитное поле. Оказалось,. Что лучи неоднородны. Поток разделился на три части: впоследствии их стали называть альфа-, бета-, и гамма- лучи. Альфа – лучи – несли положительный заряд; бета- отрицательный, а гамма-лучи заряда не имели. Так было доказано, что в состав атомов входят электроны и положительно заряженные альфа-частицы.
Учитель химии Давайте закрепим материал при помощи кубиков-«матрёшек». Итак, мы теперь точно знаем, что вода состоит из молекул. Предположим, что это одна из них. Учитель физики показывает большой голубой кубик с надписью «Молекула воды». Хотя, по данным науки, настоящие её размеры в миллиард раз меньше. Из чего же состоит молекула воды?
Предполагаемый ответ Молекула воды состоит из 2 атомов водорода и одного атома кислорода. Учитель физики открывает голубой кубик и достаёт оттуда 2 зелёных кубика поменьше с надписью «Атом водорода» каждый и красный кубик с надписью «Атом кислорода».
Учитель химии Значит, молекула воды состоит из 2 Н и 1 О. А из чего состоит каждый из этих атомов. Атом водорода состоит из ядра и одного электрона, заряженного отрицательно. Учитель физики открывает один из зелёных кубиков и достаёт оттуда 2 кубика поменьше: белый с надписью «Ядро» и чёрный с надписью «Электрон» со знаком -. А теперь давайте получим ответ на вопрос: из чего состоит само ядро? Давайте посмотрим. Учитель физики достаёт из белого кубика 2 ещё более маленькие: один жёлтый с надписью «Нейтрон» и синий с надписью «Протон» с большим знаком +.
Учитель физики Как же представить себе электрон? Послушайте разговор восьмиклассников между собой об электроне и постарайтесь рассудить их. Спор между ребятами разыгрывается.
Первый мальчик сказал: «Когда я слышу слово «электрон», у меня возникает ощущение какого-то свечение жёлтого цвета».
Второй: « А я представляю себе электрон в виде маленького шарика с отрицательным зарядом, который вращается всё время вокруг ядра, как Земля вокруг Солнца «.
Первый «Нет, ты не прав! Разве можно сравнить движение электрона и движение планет вокруг Солнца? Электрон движется вокруг ядра с огромной скоростью – нескольеко тысяч километров в секунду, поэтому мы не можем указать положение электрона в каждый момент времени, как положение планеты или её спутника. Можешь ли ты узнать, где находятся шарики центробежного регулятора при большой скорости его вращения?»
Второй Но они же образуют сплошной круг!
Первый «Вот именно. А электрон вокруг ядра вследствие быстрого вращения образует сплошную сферу».
В спор вмешался третий мальчик « Вы оба не правы. Какой «маленький шарик»? электрон надо представлять в виде облака сферической формы, в виде гантели или другой конфигурации»
Учитель физики Электрон нельзя представить себе наглядно, потому что он одновременно обладает свойствами и частицы, и волны. А потому мы можем строить только модели. С моделью Томсона в виде «кекса» вы уже познакомились на этом уроке. Давайте поближе познакомимся с моделью Резерфорда. Учитель химии подходит к модели строения атома, закрытого знаком «?». По ходу рассказа учителя физики, учитель химии «строит» модель атома, прикрепляя на магнитах знаки «+» «-« «0».
Учитель физики Суть опыта Резерфорда заключалась в следующем.
На пути узкого пучка - частиц, испускаемых радиоактивным веществом, помещалась очень тонкая металлическая фольга из золота. Регистрировались - частицы с помощью экрана из светящегося состава ( сернистый цинк), расположенного вокруг мишени.
Чего можно было бы ожидать в результате попадания -частиц в атомы золота, если бы атомы золота были бы сплошными шариками? Станут ли они расталкивать атомы золота, пробиваясь между ними, или же будут отскакивать от них в разные стороны?
Если - частицам нужно будет как-то пробираться через гущу атомов золота, то им придётся претерпевать множество столкновений с ними, сотни и тысячи раз менять своё направление. И тогда -частицы будут рассеиваться, т.е.вылетать по самым различным направлениям из золотого листка. Рисунок 1.
Рис. 1 . так должны были бы рассеиваться -частицы, если бы атомы бомбардируемого ими вещества были бы сплошными шариками.
На деле оказалось совсем не так. Подавляющая часть -частиц проходила сквозь металл, почти не отклоняясь от прямолинейного пути, и лишь немногие отклонялись на большие углы, а иногда даже отскакивали назад. Рисунок 2.
Рис. 2. На самом деле рассеивание -частиц атомами вещества происходило так.
Вспоминая через 20 лет о своих первых опытах, Резерфорд говорил: « Это было, пожалуй, самое невероятное явление, которое когда-либо встречалось в моей жизни. оно было почти таким же невероятным, как если бы обстреливали 15-дюймовым снарядом лист самой тонкой бумаги, а они отскакивали бы обратно и попадали бы в вас. После размышлений над этим обстоятельством я убедился, что это обратное рассеивание могло быть только результатом прямого попадания. Но когда я произвёл нужные расчёты, то увидел, что полученный результат по величине тоже невероятен, за исключением того единственного случая, когда вы имеете дело с системой, в которой большая часть массы атома сконцентрирована в ничтожно малом ядре».
Итак, в центре атома находится ядро с положительным зарядом. На большом расстоянии от ядра в атоме расположены электроны, которые быстро движутся вокруг него. Расстояние между ядром и электронами велики. Если ядро увеличить до 10-ти копеечной монеты, то расстояние между электроном и ядром стало бы равно километру!
В состав ядра входят положительно заряженные частицы – протоны и нейтральные частицы – нейтроны, которые заряда не имеют. Итак, уточняем: заряд электрона – отрицательный, заряд протона – положительный. Эти заряды равны по абсолютному значению, поэтому весь атом в целом не имеет заряда, т.е.электронейтральный. по своему строению атом напоминает нашу Солнечную систему, где в качестве планет выступают электроны, вращаясь вокруг Солнца-ядра, поэтому такую модель, предложенную Резерфордом, называют планетарной моделью атома.
А теперь мы сформулируем основные положения ядерной модели Резерфорда. Учитель проговаривает, а ученики записывают положения в тетрадь ( или учитель просит учащихся самим сформулировать положения, опираясь на предыдущие знания и рассказ учителя):
1) В центре атома находится положительно заряженное ядро, в котором практически сосредоточена вся масса атома;
2) вокруг ядра постоянно движутся электроны;
3) в целом атом электронейтрален.
Учитель химии Зарисуйте планетарную модель атома себе в тетрадь. Ученики зарисовывают.
Учитель химии А теперь на основе рассказанного попытайтесь составить схемы атомов гелия, лития и бериллия.
Учитель вызывает троих учащихся. Они на доске ( а все остальные в тетради ) составляют схемы строения предложенных атомов. Учитель проверяет, корректирует, исправляет.
Атомы разных химических элементов отличаются друг от друга числом электронов и протонов, т.к.имеют разные порядковые номера и атомные массы. Следовательно, это число может являться главной характеристикой данного химического элемента. Напомню, что в целом атом нейтрален, т.е.число протонов равно числу электронов. Если же нейтральный атом теряет один или несколько электронов, то атом будет иметь + заряд и называться положительным ионом-катионом. Если нейтральный атом приобретает лишний электрон, то он превращается в отрицательно заряженную частицу-анион.
Учащиеся записывают определения катиона и аниона в тетрадь.
Учитель химии Итак, главная характеристика химического элемента – заряд ядра. Заряд ядра численно равен порядковому номеру химического элемента. На доске учитель химии по ходу рассказа вычерчивает схему:
АТОМ
Ядро Электроны
= № Х.Э число = № Х.Э.
протоны p нейтроны n
число= № Х.Э. число = Аr - № Х.Э.
Число электронов тоже равно порядковому номеру элемента. Электрон имеет ничтожно малую массу и заряд. Заряд электрона принят за единицу, как наименьший из всех зарядов элементарных частиц. Электрон обозначают –е. Заряд протона равен +1, масса 1. Протон обозначается p , сверху указывается масса, внизу-заряд. Число протонов равно порядковому номеру элемента. В состав ядра входят нейтральные частицы-нейтроны, масса которых совпадает с массой протонов; обозначаются нейтроны n – вверху пишется масса-1, внизу – заряд 0. число нейтронов равно разнице между атомной массой элемента и его порядковым номером.
Прошу занести схему в тетрадь и запомнить её. Учащиеся переносят схему в свои тетради. Число протонов, нейтронов, электронов, указанных для данного химического элемента называется формулой состава атома . Формула состава записывается следующим образом:
Учитель пишет на доске, ученики заносят эту запись в свои тетради.
3. Закрепление ЗУН ( знаний, умений, навыков ).
Учитель физики Давайте повторим и закрепим тот материал. С которым вы познакомились сегодня на уроке. Предлагаю вам с помощью магнитной доски составить схемы строения атомов водорода, гелия, лития .
Учитель по-очереди вызывает трёх учеников, которые на магнитной доске с помощью «+», «-« и «о» составляют схемы строения атомов водорода, гелия, лития. Далее идёт обсуждение правильности выполнения задания.
Учитель химии А сейчас давайте напишем формулы состава атомов водорода, гелия, лития.
Аналогично учитель приглашает трёх учащихся, которые под схемами строения атомов подписывают формулы состава этих же атомов. ( по ходу выполнения задания ещё раз проговаривается, чему равен заряд ядра, почему атом в целом электронейтрален; уделяется внимание правильности написания формулы состава атома ).
Подведение итогов. Выставление отметок. Выводы и обобщения.
Домашнее задание
Карточка № 1.
1. Любой химический элемент может существовать в трёх формах ______________________________________
2. Если вещество состоит из атомов одного вида, оно называется ___________, если вещество состоит из атомов разных химических элементов, оно называется ____________.
3. Идеи о том, что вещества состоят из атомов возникли в ________________.
4. Первым придумал атом ____________. Именно придумал, так как никаких подтверждений у него не было.
5. Атом в переводе с греческого означает _______________
Карточка № 2.
Учитель химии: определить состав атома и его ядра 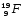 ,
, 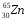 ,
, 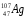
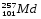
( один ученик на доске, все остальные в тетрадях)
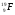 : Zp = 9, N =19 – 9 = 10, Ze = 9
: Zp = 9, N =19 – 9 = 10, Ze = 9
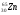 : Zp = 30, N =65 – 30 = 35, Ze = 30
: Zp = 30, N =65 – 30 = 35, Ze = 30
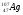 : Zp = 47, N =107 – 47 = 60, Ze = 47
: Zp = 47, N =107 – 47 = 60, Ze = 47
 : Zp = 101, N =257 – 101 = 156, Ze = 101
: Zp = 101, N =257 – 101 = 156, Ze = 101







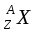
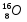

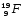 ,
, 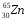 ,
, 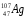 ,
, 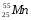 ,
, 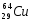 ,
, 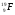 : Zp = 9, N =19 – 9 = 10, Ze = 9
: Zp = 9, N =19 – 9 = 10, Ze = 9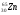 : Zp = 30, N =65 – 30 = 35, Ze = 30
: Zp = 30, N =65 – 30 = 35, Ze = 30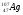 : Zp = 47, N =107 – 47 = 60, Ze = 47
: Zp = 47, N =107 – 47 = 60, Ze = 47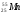 : Zp = 25, N =55 – 25 = 30, Ze = 25
: Zp = 25, N =55 – 25 = 30, Ze = 25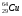 Zp = 29, N =64 – 29 = 35, Ze = 29
Zp = 29, N =64 – 29 = 35, Ze = 29