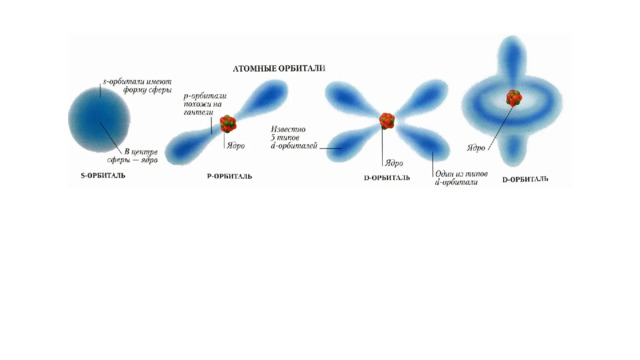

Основные виды
химических связей
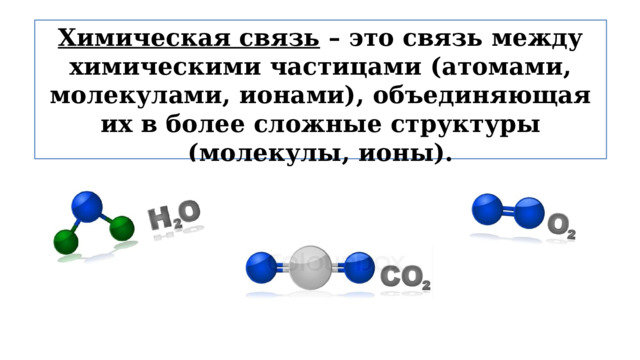
Химическая связь – это связь между химическими частицами (атомами, молекулами, ионами), объединяющая их в более сложные структуры (молекулы, ионы).
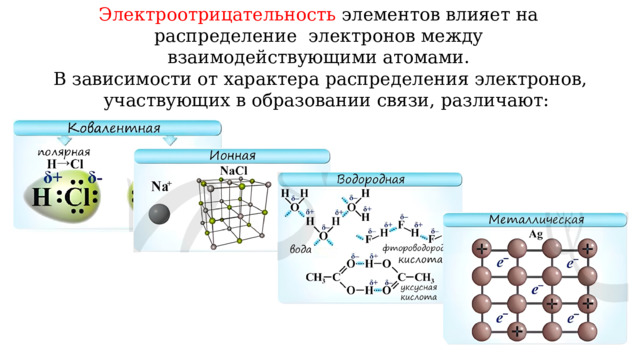
Электроотрицательность элементов влияет на распределение электронов между взаимодействующими атомами.
В зависимости от характера распределения электронов, участвующих в образовании связи, различают:
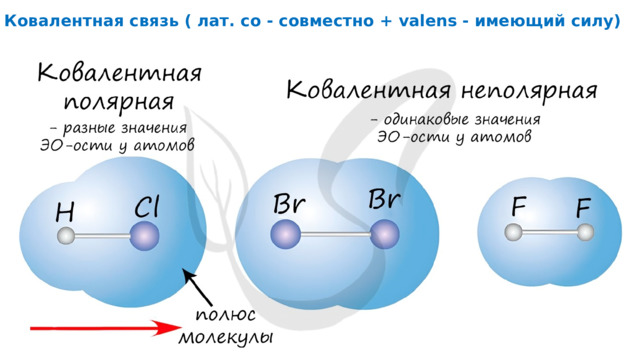
Ковалентная связь ( лат. со - совместно + valens - имеющий силу)


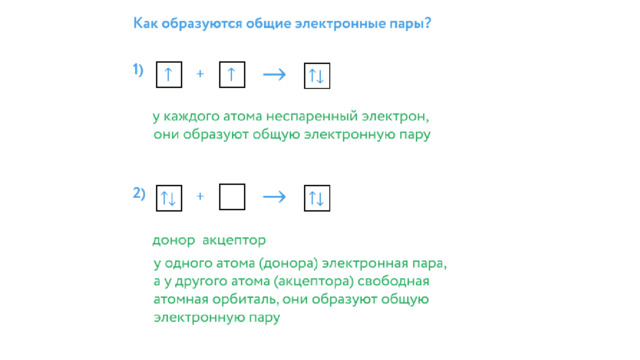
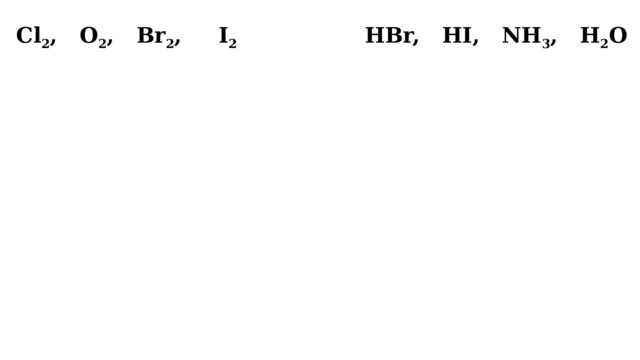
Cl 2 , O 2 , Br 2 , I 2
HBr, HI, NH 3 , H 2 O

Ионная химическая связь
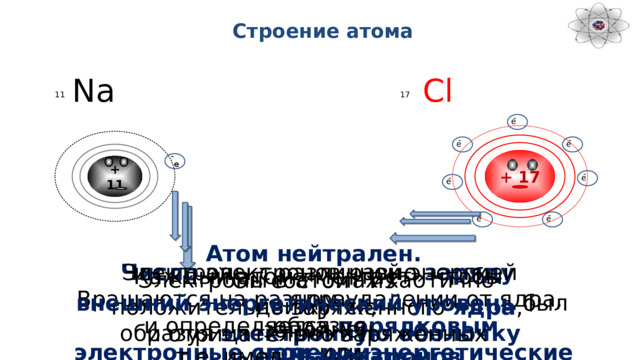
Строение атома
е
-
Na
Cl
11
17
-
е
-
-
е
е
+ 17
+ 11
-
-
е
е
-
-
е
е
Атом нейтрален.
Он состоит из
положительно заряженного ядра ,
и отрицательно заряженных электронов
Электроны с различной энергией
Число электронов равно заряду ядра
Вращаются на разном удалении от ядра, образуя
и определяется порядковым номером
электронные слои или энергетические уровни
химического элемента
Каждый атом «мечтает» чтобы
внешний энергетический уровень был заполнен
т.е. имел 8 электронов
Электроны в атомах хаотично движутся,
образуя электронную оболочку

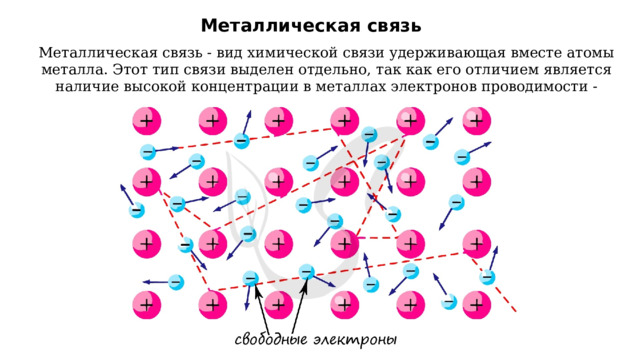
Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа".

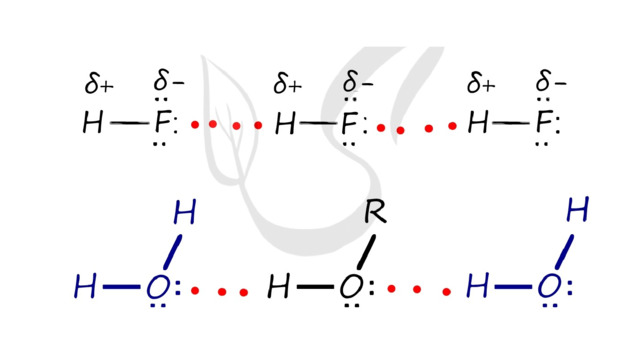
Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
H 2 O
NH 3
HF
Органических спиртов: С 2 H 5 OH, C 3 H 7 OH
Органических кислот: CH 3 COOH, C 2 H 5 COOH