Оксиды: их классификация и свойства


Знакомы с детства мы с водою,
Она есть всюду на Земле -
И в облаках над головою,
И в чайной чашке на столе...
Она повсюду рядом с нами,
И так нас радует порой
Хрустящим снегом под ногами,
И речки быстрою струей...
Всяк зверь стремится к водопою,
Ей рады птица и цветок...
Где есть вода - там все живое,
Где нет - пыль камень и песок.
Н 2 О

Способы получения и химические свойства оксидов


Получение оксидов


Способы получения оксидов
- 1 способ: окисление металлов
где CuO – оксид меди (II)

Способы получения оксидов
- 2 способ: окисление неметаллов
где CO 2 – оксид углерода (IV)

Способы получения оксидов
- 3 способ: разложение кислот
где - сернистая кислота,
SO 2 – оксид серы (IV)

Способы получения оксидов
- 4 способ: разложение солей
где - карбонат кальция
CаO – оксид кальция (II)

Способы получения оксидов
- 5 способ: разложение нерастворимых оснований
где - гидроксид железа (II),
FeO – оксид железа (II)

Способы получения оксидов
- 6 способ: вытеснение из солей другими оксидами
где - карбонат натрия,
SiO 2 – оксид кремния (IV),
Na 2 SiO 3 - силикат натрия

Способы получения оксидов
- 7 способ: горение сложных веществ
где - этанол (этиловый спирт),
СO 2 – оксид углерода (IV)

ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
- Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
- Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
- Амфотерными оксидами , называют оксиды которые проявляют свойства как кислот, так и оснований .
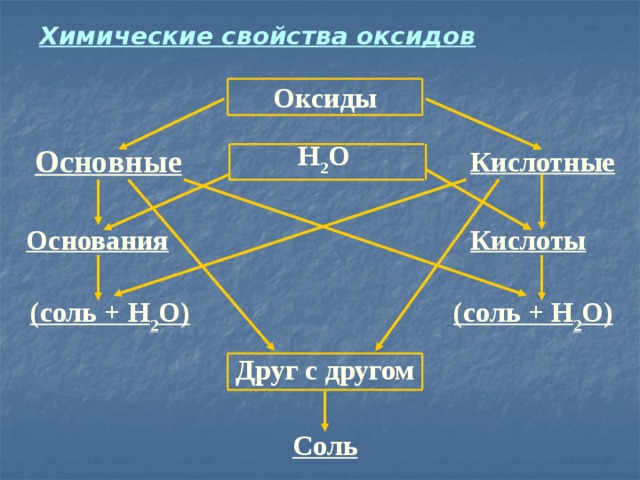
Химические свойства оксидов
Оксиды
Н 2 О
Основные
Кислотные
Основания
Кислоты
(соль + Н 2 О)
(соль + Н 2 О)
Друг с другом
Соль
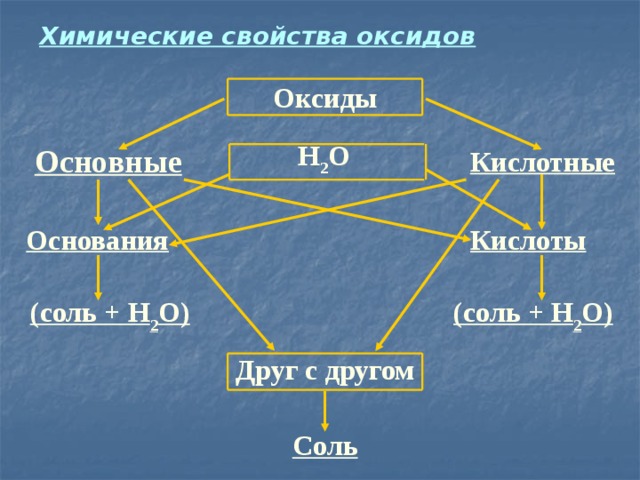
Химические свойства оксидов
Оксиды
Н 2 О
Основные
Кислотные
Основания
Кислоты
(соль + Н 2 О)
(соль + Н 2 О)
Друг с другом
Соль

- Каждому кислотному оксиду соответствует определенная кислота. Например:
- СО 2 → Н 2 СО 3 SО 2 → H 2 SО 3 SО 3 → Н 2 SО 4 N 2 О 5 → HNO 3 P 2 О 5 → H 3 PO 4
- СО 2 → Н 2 СО 3 SО 2 → H 2 SО 3 SО 3 → Н 2 SО 4 N 2 О 5 → HNO 3 P 2 О 5 → H 3 PO 4
- СО 2 → Н 2 СО 3
- SО 2 → H 2 SО 3
- SО 3 → Н 2 SО 4
- N 2 О 5 → HNO 3
- P 2 О 5 → H 3 PO 4

- Каждому основному оксиду соответствует определенное основание. Например:
- Na 2 O → NaOH CaO → Ca(OH) 2 Al 2 O 3 → Al(OH) 3 FeO → Fe(OH) 2 Fe 2 O 3 → Fe(OH) 3
- Na 2 O → NaOH CaO → Ca(OH) 2 Al 2 O 3 → Al(OH) 3 FeO → Fe(OH) 2 Fe 2 O 3 → Fe(OH) 3
- Na 2 O → NaOH
- CaO → Ca(OH) 2
- Al 2 O 3 → Al(OH) 3
- FeO → Fe(OH) 2
- Fe 2 O 3 → Fe(OH) 3

(Осн. оксид + вода = основание)
- СаО + H 2 SO 4 → CaSO 4 + H 2 O
(Осн. оксид + кислота = соль + вода)
(Кисл. оксид + вода = кислота)
- SO 3 + Са(ОН) 2 → CaSO 4 + Н 2 O
(Кисл. оксид + осн-е = соль + вода)
(Осн. оксид + кисл. оксид = соль)

Узнай "загадочный "оксид

Чтоб появиться я сумел,
Прокаливают белый мел.
Меня дает огонь в печи
И пламя маленькой свечи.
И стоит только сделать вдох,
Чтоб я на свет явиться мог.
Я в газированной воде,
Я в хлебе, дыме, я везде!

Применение оксидов
- В литосфере содержится оксид кремния - песок, оксид алюминия - глина. Они незаменимы в строительстве.
- Из глины делают керамическую посуду
- Оксид железа (III) - красный железняк и Fe 3 O 4 - магнетит используют для получения железа.

Применение оксидов
- Оксид кальция необходим для получения гашеной извести, которая используется для побелки.


















































