Контрольная работа по теме «Неметаллы и их соединения»
1 вариант
Часть 1. Выберите один правильный ответ.
1.Укажите распределение электронов по энергетическим уровням, соответствующее атому неметалла:
а)2е,8е,4е б) 2е,8е,1е в) 2е,8е,2е г) 2е,8е,3е
2.Аллотропной модификацией фосфора не является:
а) белый б) синий в) красный г) черный
3.Какой из оксидов азота относится к несолеобразующим:
а) NO б) N2O5 в) N2O3 г) NO2
4.С каким из веществ, формулы которых приведены, соляная кислота не взаимодействует?
а) Fe б) Ca(OH)2 в) MgO г) BaSO4
5. Бесцветная дымящаяся жидкость с резким раздражающим запахом:
а) аммиак б) азотная кислота в) азот г) серная кислота
6. Соотнесите название объекта и признаки, характерные для объекта.
Вещество Свойства
а) Аммиак 1) легче воздуха
б) Хлор 2) растворим в воде
3) резкий, удушливый
4) тяжелее воздуха
5) бесцветный газ
6) желто-зеленый
7. Наибольшую степень окисления азот проявляет в соединении:
1) NН3 2) NО2 3) НNO3 4) НNO2
8. Сокращенному ионному уравнению
Ba2+ + SO42- BaSO4
соответствует взаимодействие между:
а) фосфатом бария и раствором серной кислоты
б) растворами сульфата натрия и нитрата бария
в) растворами гидроксида бария и серной кислоты
г) карбонатом бария и раствором серной кислоты
9. Формула вещества с ковалентной неполярной связью:
а) NaCl б) SO2 в) H2 г) Мg
10. Элемент-неметалл, не имеющий аллотропных модификаций:
а) фосфор б) сера в) углерод г) азот
Часть 2.
11. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HI + H2SO4 = I2 + H2S + H2O
Определите окислитель и восстановитель.
12. Определите массу осадка, образующегося при взаимодействии 200 г 15% раствора иодида натрия с избытком нитрата свинца.
13. Предположите план распознавания растворов: сульфата, хлорида и иодида натрия.
Запишите уравнения использованных реакций.
Контрольная работа по теме «Неметаллы и их соединения»
2 вариант
Часть 1. Выберите один правильный ответ.
1.Укажите распределение электронов по энергетическим уровням, соответствующее атому неметалла:
а)2е,8е,8е,1е б) 2е,8е,1е в) 2е,8е,7е, г) 2е,8е,2е
2. Аллотропной модификацией углерода является:
а) графит б) азот в) озон г) астат
3. Какие из двух оксидов относятся к солеобразующим:
а) N2O и СО2 б) N2O5 и СО в) NO и СО г) N2O3 и CO2
4.С каким из веществ, формулы которых приведены, серная кислота не взаимодействует?
а) Fe б) Ca(OH)2 в) MgO г) NaCl .
5. Газ без цвета, с характерным резким запахом, почти в 2 раза легче воздуха:
а) аммиак б) азотная кислота в) азот г) нитрат калия
6. Соотнесите название объекта и признаки, характерные для объекта.
Вещество Свойства
а) Озон 1) газ светло-синего цвета
б) Бром 2) запах свежести
3) резкий, зловонный
4) сильный окислитель
5) хорошо растворим в органических веществах
6) бурая жидкость
7. Наименьшую степень окисления фосфор проявляет в соединении:
а) НЗРО4 б) Р2О3 в)РНЗ г) Р2О5
8. Сокращенное ионное уравнение реакции
Ag+ + Cl- AgCl
соответствует взаимодействию между растворами:
а) карбоната серебра и соляной кислоты
б) нитрата серебра и серной кислоты
в) нитрата серебра и соляной кислоты
г) сульфата серебра и азотной кислоты
9. Формула вещества с ковалентной полярной связью:
а) КВг б) NН3 в) О2 г) Fе
10. Элемент-неметалл, не имеющий аллотропных модификаций:
а) фосфор б) сера в) углерод г) азот
Часть 2.
11. Используя метод электронного баланса, составьте уравнение реакции по схеме:
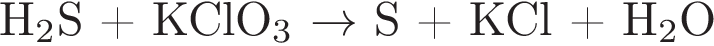
Определите окислитель и восстановитель.
12. Определите массу осадка, образующегося при взаимодействии 400 г 10% раствора сульфида натрия с избытком нитрата свинца.
13. Предположите план распознавания растворов: фосфата, карбоната и гидроксида натрия. Запишите уравнения использованных реакций.

























