Тема урока
«Уравнение состояния идеального газа»
Тип урока: комбинированный.
Дидактическая цель:
Познакомиться с уравнением состояния идеального газа;
записать это уравнение в классическом виде;
сформулировать следствия, вытекающие из уравнения состояния идеального газа;
научиться использовать полученные уравнения при решении задач.
Задачи урока:
Образовательные: установление вида связи между макроскопическими параметрами состояния вещества и знакомство со следствиями, вытекающими из уравнения состояния идеального газа; формирование умений применять полученные знания при решении задач.
Воспитательные: создание условий для самостоятельного поиска решений проблемных ситуаций и проявления инициативы; формирование познавательного интереса к изучаемому материалу;
Развивающие: развитие мышления и мировоззрения обучающихся; осуществление межпредметных связей с математикой при выводе уравнения Менделеева - Клапейрона, развитие навыков самообразования.
Раздаточный материал: карточки для индивидуальной работы; «домино» для закрепления материала.
Оборудование: Прибор для демонстрации газовых законов, компьютер, мультимедийный проектор, презентация к уроку, выполненная в программе Power Point.
Ход урока
1. Орг. момент (3 минуты)
2. Постановка цели и задач урока.(5 минут)
3. Повторение пройденного, работа в группах (8 минут)
4. Объяснение нового материала (15 минут)
3. Выполнение практической работы. 5 минут)
4. Обобщение полученных результатов. (5 минут)
5. Подведение итогов.(5 минут)
6. Рефлексия.(3 минуты)
7. Домашнее задание (2 минуты)
Организационный момент
Друзья мои! Я очень рада
Войти в приветливый ваш класс.
И для меня уже награда
Вниманье ваших умных глаз.
Я знаю: каждый в классе гений.
Но без труда талант не в прок.
Скрестите шпаги ваших мнений,
Мы вместе проведем урок!
Мои соавторы и судьи,
Оценкой Вас не накажу.
За странный слог не обессудьте,
А дальше прозой я скажу.
Постановка цели урока (экспериментальная задача)
Как вы думаете, ребята, можно ли имея термометр и линейку определить атмосферное давление в нашем классе?
Ученик. Термометром можно измерить температуру, линейкой измерить размеры комнаты и вычислить объем.
Хорошо. Две величины мы найдём. А можно ли зная температуру и объём найти третью величину – давление? Это будет целью нашего урока: нам нужно вывести физический закон, устанавливающий зависимость между тремя макроскопическими параметрами - p, V, T и научиться использовать этот закон при решении задач.
Это нам нужно для того, чтобы мы могли объяснять с научной точки зрения явления, происходящие в окружающем мире и с каждым из нас.
Повторение пройденного материала
В общем случае эта задача является очень сложной и до сих пор не решена. И только для идеального газа получено решение этой задачи.
И поэтому мы повторим ранее изученный материал об идеальном газе.
Учитель. Что такое идеальный газ?
Ученик. Идеальным газом называется модель реального разреженного газа. Расстояние, между молекулами намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения.
Учитель. Назовите условия, при которых газ можно считать идеальным?
Ученик. -Расстояния между молекулами во много раз больше размеров самих молекул.
- Взаимодействия молекул газа происходит только при соударениях, и являются упругими.
- Молекулы газа не имеют объема – материальные точки.
Учитель. Что называется концентрацией?
Ученик. Концентрация – это число молекул в единице объема. Измеряется м-3
Учитель. Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории.
Ученик. Давление идеального газа возникает из-за ударов молекул о стенку сосуда. Его можно выразить через концентрацию молекул, массу одной молекулы и средние скорости молекул и. p=⅓nmoυ2.
Основное уравнение МКТ устанавливает связь между микро- и макромиром.
Работа в группах:
Карточки №1
1 группа(задача) – Чему равна средняя кинетическая энергия атомов кислорода при температуре 20° С?
2 группа – Стрелочками установите соответствие между величинами и единицами измерения
Объём К
Кинетическая энергия Па
Температура Кг/моль
Давление м/с
Скорость молекул м3
3 группа - Установите связь между температурой по шкале Кельвина и Цельсия
t=27°С, T =?
t=-30°C? T=?
T=400 К t=?
Представители от каждой группы обосновывают свои ответы.
Объяснение нового материала:
Вот сейчас мы с вами уже готовы решать задачу, поставленную в начале урока.
Итак, как вы представляете себе газ?
Объяснения учеников (молекулы, движутся, очень маленькие массы и размеры…)
Верно, газ характеризуют его микроскопические параметры. Это индивидуальные характеристики молекул: масса молекулы, ее скорость, импульс и кинетическая энергия поступательного движения;
Но, ребята, в физике существует такое понятие, как макроскопические параметры газа.
Макроскопические параметры газа – величины, характеризующие газ, как физическое тело, при этом не учитывается его молекулярное строение: давление, объем и температура газа,.(Р,V,Т)
Одна из важнейших задач МКТ – установление связи между макроскопическими и микроскопическими параметрами газа.
А мы сегодня получим связь между макроскопическими параметрами.
Запись в тетрадях:
Уравнение, связывающее все три макроскопических параметра вещества
(р, V и Т), называется уравнением состояния идеального газа
Вывод уравнения:

p=nkT
Это уравнение называют уравнением Менделеева - Клапейрона
Уравнение Менделеева – Клапейрона - уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем и температуру) газа данной массы.
Историческая справка: Обобщив уравнение Клапейрона и введя понятие универсальной газовой постоянной, русский ученый Д. И. Менделеев в 1874 г. вывел общее уравнение для состояния идеального газа. ( уравнение Менделеева – Клапейрона
С помощью данного уравнения можно описывать процессы сжатия и расширения, нагревания и охлаждения идеального газа.
Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 – параметры относящиеся ко второму состоянию, то получится:
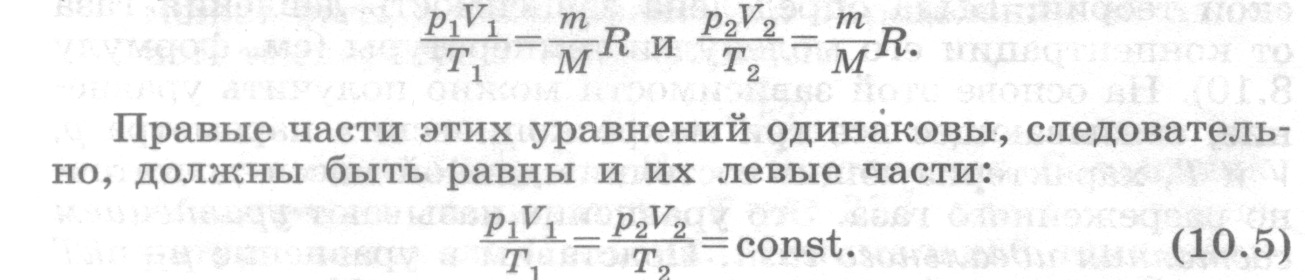
Историческая справка В 1834 г. Французский физик Б. Клапейрон, работавший длительное время в России (Петербурге), вывел уравнение состояние идеального газа при постоянной массе газа (m=const).
Уравнение состояния идеального газа выводить каждый раз не надо. Его надо просто запомнить. А вот значение универсальной газовой постоянной желательно запомнить. Чему она равна? Вспомним ещё раз.
Демонстрация опыта: Демонстрационный прибор – зависимость Р.V, Т
Для чего нужно уравнение состояния?
Знать уравнение состояния необходимо при исследовании тепловых явлений. Уравнение состояния позволяет определить одну из величин, характеризующих состояние, например температуру, если известны две другие величины. Это и используют в термометрах.
Зная уравнение состояния, можно сказать, как протекают в системе различные процессы при определенных внешних условиях, например, как будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т.д. Речь уже идет о газовых законах, которые активно работают в живой природе, широко применяются в медицине, газообмен в легких у животных и у человека происходят тоже в соответствии с газовыми законами. Действие термометра основано на зависимости объёма от температуры и многое другое. Но об этом поговорим на следующих уроках.
Обобщение знаний
А мы должны вернуться к врпросу, поставленному в начале урока: Как определить атмосферное давление в нашем классе. Из уравнения состояния хорошо видно, что зная температуру, объём и молярную массу воздуха найти давление совсем легко. Решением задач займёмся на следующем уроке, а сейчас давайте закрепим полученные на уроке знания.
Интерактивный тест
Ученикам предлагается комплект физического «домино» по теме урока.
Они отыскивают карточку с ответом; найдя, приставляют ее к первой карточке. Получается «цепочка»:
Карточки №2
|
| Что называют молярной массой? |
| Молярной массой называют массу одного моля вещества | Чему равно нормальное атмосферное давление? |
| Нормальное атмосферное давление равно 105 Па | Перечислить макроскопические параметры состояния идеального газа |
| Макроскопические параметры: р – давление, V – объем, Т - температура | Перечислите единицы измерения давления, объема и температуры в СИ |
| Давление измеряют в Па, объем в м 3, температуру в К. | Какое уравнение называют уравнением состояния? |
| Уравнение, выражающее связь между макроскопическими параметрами состояния вещества, называется уравнением состояния этого вещества | В чем заключается основная задача МКТ вещества? |
| Основной задачей МКТ является нахождение уравнения состояния того или иного тел | Какой вид имеет уравнение Менделеева-Клапейрона? |
|
| Чему равна температура таяния льда и кипения воды при нормальном давлении по термодинамической шкале?
|
| Т л = 273 К Т в = 373 К | Какой прибор служит для измерения давления газа? |
| Манометр |
|
Дорога к знанию? Ну что ж, ее легко понять.
Ответить можно сразу:
Вы ошибаетесь, и ошибаетесь, и ошибаетесь опять,
Но меньше, меньше, меньше с каждым разом!
6. Рефлексия: Каждый ученик вытягивает себе бумажку с фразой, которую надо продолжить.
Вы, знаете, что сегодня на уроке я…
Больше всего мне сегодня запомнилось…
Самым интересным было…
Потом каждый учащийся, по желанию говорит классу, как он продолжил фразу
Домашнее задание:
Задача: Оцените число молекул воздуха, находящегося в классе, при нормальном атмосферном давлении и температуре 20 оС
Самостоятельная работа – написать в тетрадях о жизни и деятельности учёных: Д.И.Менделеев, Бенуа Клапейрон,
Использованная литература:
Дополнительные материалы:
Универсальная энциклопедия ВИКИПЕДИЯ( http://ru.wikipedia.org)
Приложения к уроку.
Приложение №1 (сообщение ученика).
КЛАПЕЙРОН, БЕНУА ПОЛЬ ЭМИЛЬ 
(Clapeyron, Benoît Paul Emile) (1799–1864), французский физик и инженер.
Родился 26 января 1799 в Париже.
Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820–1830).
По возвращении во Францию стал профессором Школы мостов и дорог в Париже.
Работы Клапейрона посвящены тепловым процессам. В 1834 он ввел в термодинамику графический метод, представив в геометрической форме рассуждения Карно. В том же году вывел уравнение состояния идеального газа (уравнение Клапейрона), объединяющее закон Бойля – Мариотта, закон Гей-Люссака и закон Авогадро. Это было наиболее простое соотношение, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах (в 1874 оно было обобщено .Менделеевым и теперь известно как уравнение Менделеева – Клапейрона). Получил уравнение, связывающее между собой температуру кипения (или плавления) веществ и давление (уравнение Клапейрона – Клаузиуса; последний обосновал это уравнение в 1851).Умер Клапейрон в Париже 28 января 1864.
Приложение № 2 (сообщение ученика)
Менделеев Дмитрий Иванович
(8.II.1834–2.II.1907) Русский ученый-энциклопедист. Ранние научные работы посвящены изучению изоморфизма и удельным объемам (1854–56). Открыл (1860) «температуру абсолютного кипения жидкостей». Автор фундаментального труда «Основы химии», выдержавшего при жизни Д. И. Менделеева восемь изданий. В ходе работ над первым изданием пришел к идее о периодической зависимости свойств химических элементов от их атомных весов. В 1869–1871 изложил основы учения о периодичности, открыл периодический закон и разработал периодическую систему химических элементов. На основе системы впервые предсказал (1870) существование и свойства нескольких не открытых еще элементов, в том числе «экаалюминия» – галлия (открыт в 1875), «экабора» – скандия (1879), «экасилиция» – германия (1886). Осуществил фундаментальный цикл работ по изучению растворов, разработав гидратную теорию растворов. Создал (1873) новую метрическую систему измерения температуры. Нашел (1874) общее уравнение состояния идеального газа, обобщив уравнение Клапейрона (уравнение Клапейрона–Менделеева).