
Автор : Щенникова Светлана Викторовна.
- учитель химии и биологии.
Место работы. Муниципальное общеобразовательное учреждение
« Осташевская средняя общеобразовательная школа».
Московская область. Волоколамский район. с. Болычево. Улица Центральная д.6.
[email protected]

Номинация 1 – «учебная презентация по теме (8 класс)»

«Основные сведения о строении
атомов».

Содержание:
1. Планетарная модель атома.
2. Атомные частицы и их свойства.
3.Атомная «орбиталь».
4. Строение электронной оболочки атома.
5. Подуровни энергии.
6. Формы «орбиталей».
7. Электронные формулы.
8. Закрепление.
9. Список литературы.
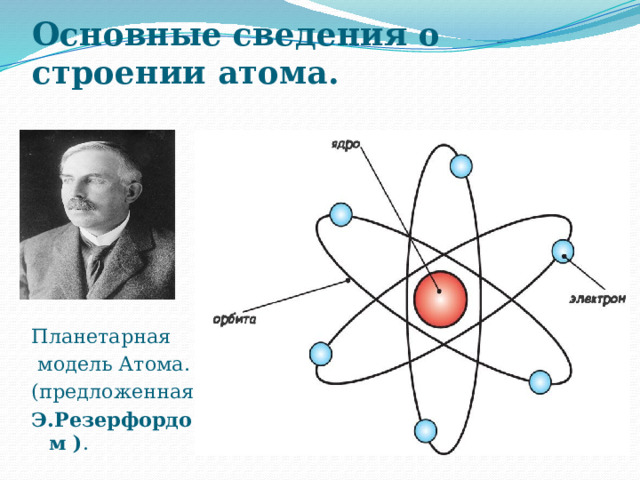
Основные сведения о строении атома.
Планетарная
модель Атома.
(предложенная
Э.Резерфордом ) .
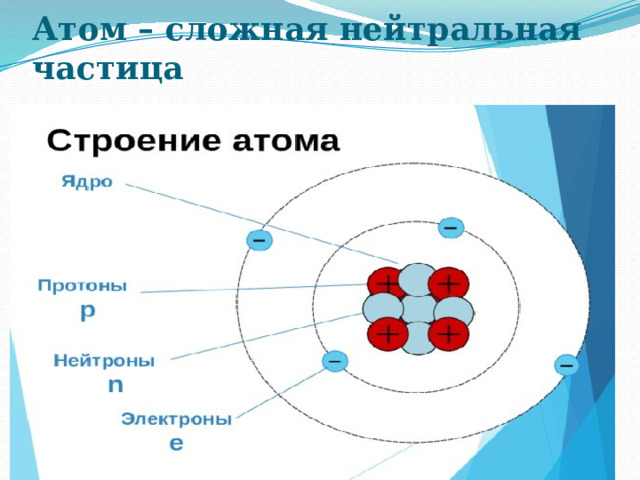
Атом – сложная нейтральная частица

Атомарная структура, абстрактное изображение
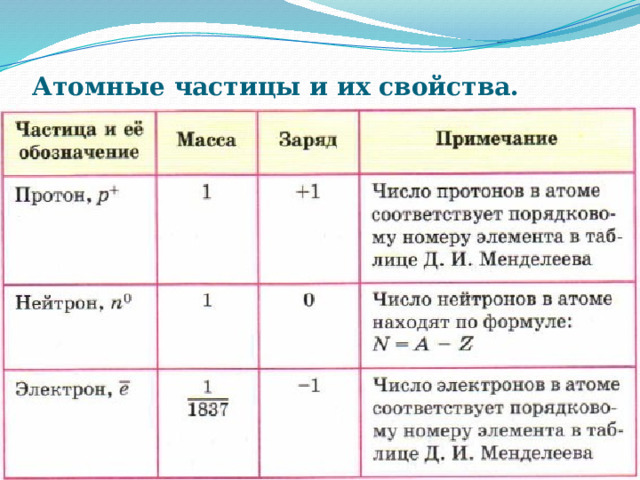
Атомные частицы и их свойства.
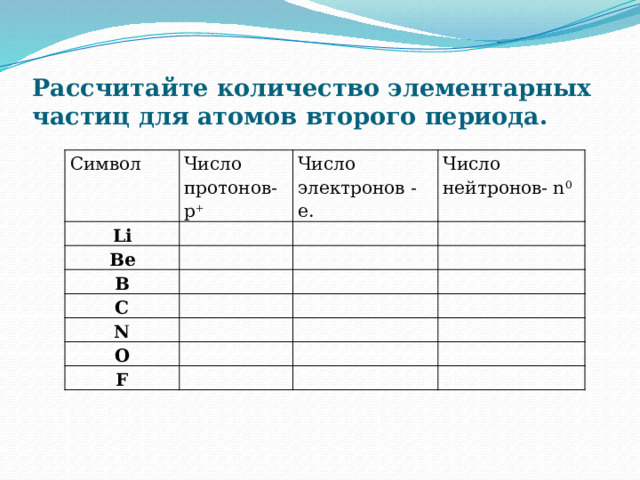
Рассчитайте количество элементарных частиц для атомов второго периода.
Символ
Число протонов- p +
Li
Число электронов - e.
Be
Число
B
нейтронов- n 0
C
N
O
F
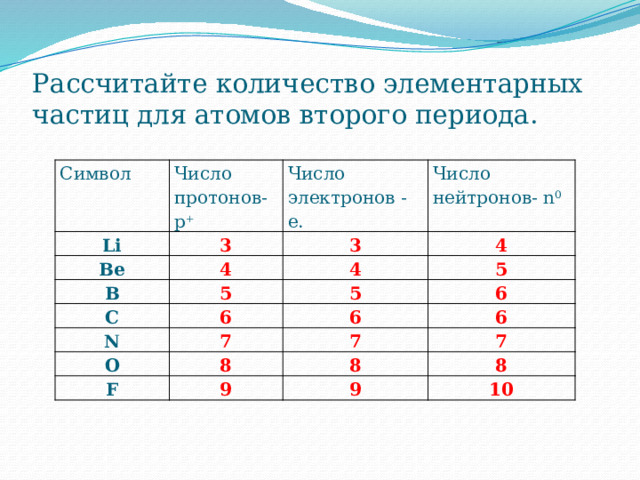
Рассчитайте количество элементарных частиц для атомов второго периода.
Символ
Li
Число протонов- p +
3
Be
Число электронов - e.
Число
3
4
B
нейтронов- n 0
4
5
4
C
N
5
5
6
7
6
6
O
6
7
8
F
7
9
8
8
9
10

Атомная «орбиталь» — это область пространства, в которой вероятность нахождения электрона максимальна.

Строение электронных оболочек атома –это

Электронная оболочка -совокупность электронов двигающих вокруг ядра.
Число электронов в оболочке атома-
Энергетический
уровень-
равно порядковому номеру
Число энергетических уровней -
элемента в таблице Д.И.Менделеева
это совокупность
определяется номером периода ХЭ в ПСХЭ
электронов с близкими значениями эне ргии

Максимальное число электронов
находящихся на Э.У определяем по формуле:
N = 2n 2
Где N - максимальное число электронов на уровне;
n – номер энергетического уровня.
Энергетический уровень
Максимальное число электронов
1
2
2
3
8
4
18
32

Запомните 1. Атом состоит из ядра и электронной оболочки. 2. Электронная оболочка – это совокупность всех электронов в данном атоме. 3. Электроны располагаются на определенных энергетических уровнях (энергетические слои). 4.Электроны обладающие наименьшей энергией находятся на первом энергетическом уровне. 5. Электроны первого уровня могут переходить на второй уровень и т.д.

Алгоритм составления электронных схем . 1. Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента. 2. Определяем количество энергетических уровней ( оно равно номеру периода ) и количество электронов на каждом уровне. 3. Составляем электронную схему.

Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп .

Примеры распределения электронов по энергетическим уровням, элементов II группы(А).

Подуровни энергии
- Согласно современной ( квантовомеханической ) модели атома энергетические уровни состоят из подуровней.
- Число подуровней, которые образуют конкретный уровень, равно его номеру.
- Подуровни обозначают буквами s, p, d, f.
Номер энергетического уровня
1
Подуровни энергии
2
s (один подуровень)
s, p (два подуровня )
3
4
s, p, d (три подуровня )
s, p, d, f (четыре подуровня

Энергетические подуровни
Энергетический подуровень
Число
s-подуровень
атомных орбиталей.
Максимальное
1
p-подуровень
3
число ē
d-подуровень
2
6
на подуровне.
5
f-подуровень
7
10
14
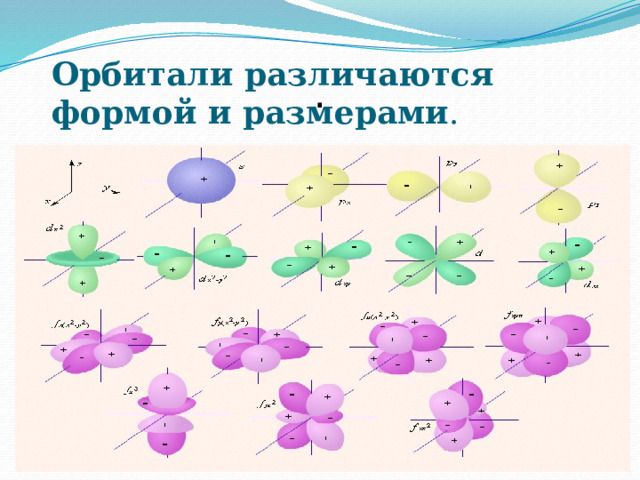
Орбитали различаются формой и размерами .
.
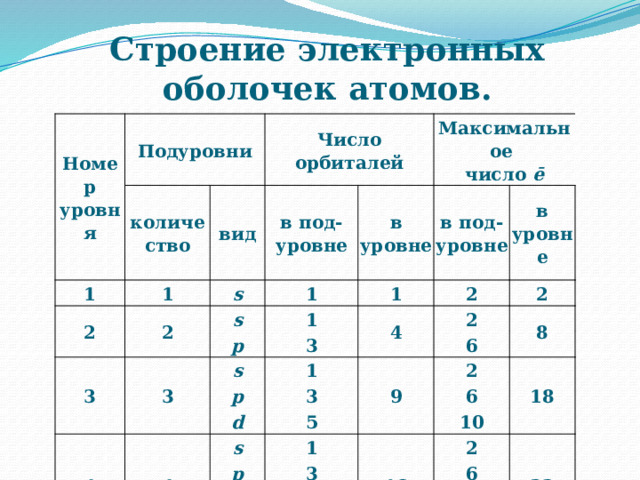
Строение электронных оболочек атомов.
Номер уровня
Подуровни
количество
1
Число орбиталей
1
2
вид
в под-
2
s
Максимальное
уровне
1
s
3
в уровне
число ē
1
1
3
в под-
p
2
3
уровне
s
в уровне
4
4
2
1
p
2
6
3
4
9
8
d
s
5
2
6
1
p
18
d
10
16
3
2
5
f
32
7
6
10
14
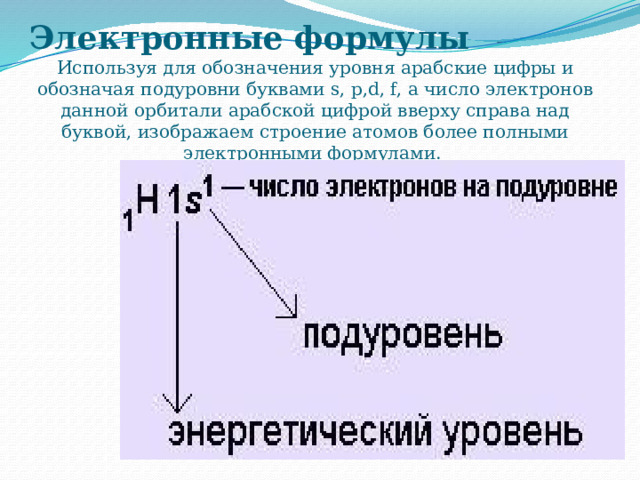
Электронные формулы
Используя для обозначения уровня арабские цифры и обозначая подуровни буквами s, p,d, f, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.

Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой - квадратиком на энергетической диаграмме.
На s -подуровне может находиться одна атомная орбиталь,
а на p - подуровне их может быть уже три.
На d - и f - подуровнях в атоме может быть уже пять и семь.

Пример:
Алюминий имеет порядковый номер 13 , его атом состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов.
Электронная формула алюминия выглядит следующим образом:
+13 Al) 2 ) 8 ) 3 ;
1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 3do.
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня.
3d
3p
3s

Повторение – мать учения

Выберите правильный ответ
1. Предложил название «электрон».
1) Стони 2) Томпсон 3) Беккерель 4) Резерфорд
2. Предложил планетарную модель атома
1) Стони 2) Томпсон 3)Беккерель 4) Резёрфорд
3. Число электронов в атоме натрия равно
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39 К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе
5 протонов, 6 нейтронов, 5 электронов
а) углерода, б) натрия, в) бора, г) неона.
6.Число протонов в атоме кислорода равно:
1)8 2) 9 3)10 4)11
7. Атомы какого химического элемента имеют в своем составе
7 протонов, 7 нейтронов, 7 электронов
а) углерода, б) натрия, в)азот, г) фтор.
8.Число нейтронов, протонов электронов в атоме 39 Ar равно
1)22 18 18 2)21 18 18 3)26 18 17 4)20 19 18

Правильные ответы
Кто предложил название «электрон»:
- 1) Стони 2) Томпсон 3) Беккерель 4) Резерфорд
2. Кто предложил планетарную модель атома
1) Стони 2) Томпсон 3)Беккерель 4) Резерфорд
3. Число электронов в атоме натрия равно:
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39 К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе
5 протонов, 6 нейтронов, 5 электронов
а) углерода, б) натрия, в) бора , г) неона.
6.Число протонов в атоме кислорода равно:
1)8 2) 9 3)10 4)11
7. Атомы какого химического элемента имеют в своем составе
7 протонов, 7 нейтронов, 7 электронов
а) углерода, б) натрия , в)азот , г) фтор.
8.Число нейтронов, протонов электронов в атоме 39 Ar равно
1)22 18 18 2)21 18 18 3)26 18 17 4)20 19 18

Строение атома
- Атом состоит из двух основных частей: __________ и ________________________ .
- В центре атома находится __________ , вокруг которого располагаются ________________ .
- Ядро состоит из _____________и _____________ .
- На электронных слоях располагаются _______________, их заряд - _________________ ,.
- Число протонов в атоме химического элемента равно____________________________________ .
- Число нейтронов можно вычислить по формуле___________________
_______________________________________________.
- Заряд ядра атома химического элемента равен _____________________
_____________________ .
- Общее число электронов в атоме химического элемента равно _______
_____________________ .
- Число заполняемых электронами энергетических уровней в атоме химического элемента равно ___________________________________ .
- Число электронов на внешнем энергетическом уровне равно ________

Строение атома
Атом состоит из двух основных частей: _____ положительно заряженного ядра и отрицательно заряженных
- электронов, образующих электронную оболочку _ .
В центре атома находится ____ ядро , вокруг которого располагаются _____ электроны.
- Ядро состоит из ___ протонов_и __нейтронов ___ .
- На электронных слоях располагаются _____ электроны, их заряд минусовой_____________ ,.
- Число протонов в атоме химического элемента равно___ порядковому номеру элемента____ .
- Число нейтронов можно вычислить по формуле_______ N=A-Z ___
- Заряд ядра атома химического элемента равен _____ порядковому номеру элемента
Общее число электронов в атоме химического элемента равно _ порядковому номеру элемента
- Число заполняемых электронами энергетических уровней в атоме химического элемента равно ___ номеру периода
- Число электронов на внешнем энергетическом уровне равно __ номеру группы.
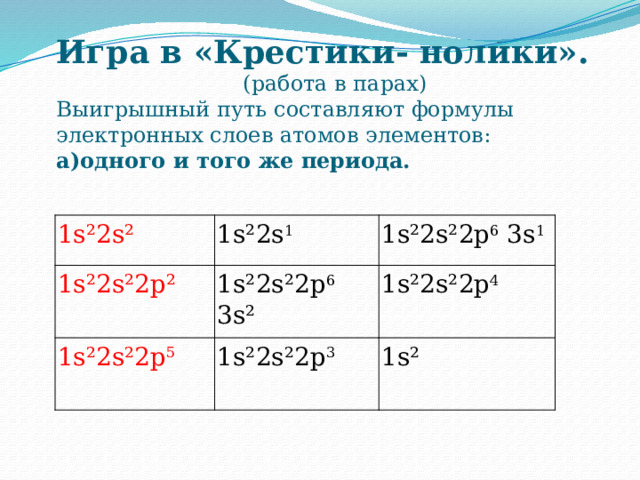
Игра в «Крестики- нолики».
(работа в парах)
Выигрышный путь составляют формулы электронных слоев атомов элементов: а)одного и того же периода.
1s²2s²
1s²2s²2p²
1s²2s 1
1s²2s²2p 6 3s 1
1s²2s²2p 6 3s²
1s²2s²2p 5
1s²2s²2p 4
1s²2s²2p 3
1s²
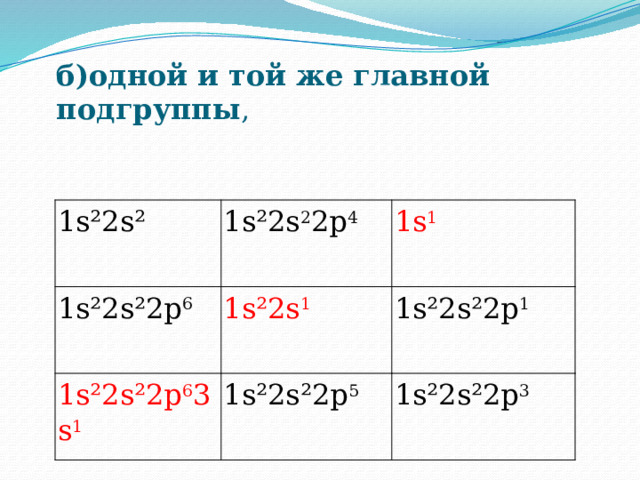
б)одной и той же главной подгруппы ,
1s²2s²
1s²2s 2 2p 4
1s²2s²2p 6
1s 1
1s²2s 1
1s²2s²2p 6 3s 1
1s²2s²2p 5
1s²2s²2p 1
1s²2s²2p 3

ТЕСТ . По данным о распределении валентных электронов найдите элемент:
- б) 2s 2 2p 4 O
- в) 3s 2 3p 6 Ar
- г) 3d 10 4s 1 Cu
- д) 4s 2 4p 3 As
- е) 4s 2 4p 5 Br
- ж) 3s 2 3p 4 S

Дифференцированные карточка
по теме
« Строение электронных оболочек атомов».
Химический элемент - натрий.
Задания.
1.Запишим знак химического элемента, внизу укажем порядковый номер. ________________________________________________________________________________
2.Как произносится химический символ ______________________________________________
3.Определите количество
p+________________________________________________________
e-________________________________________________________
по порядковому номеру элемента .
4. Определите число энергетических уровней в электронной оболочке по номеру периода .
________________________________________________________________________________
5. Нарисовать рядом со знаком химического элемента столько же дуг.
6. Определим по номеру группы число электронов на внешнем энергетическом уровн е, запишем его под последней дугой.
7. Определите число электронов на оставшихся энергетических уровнях,
( на 1-м – не более двух, на 2-м – не больше восьми, на третьем не больше -18.)
Ставим эти числа под соответствующими дугами.
8.Схема строения атома готова.
________________________________________________________________________________

9. Определите количество подуровней на вашем уровне.
Подуровни обозначают буквами s, p, d, f.
10. Далее превращаем схему в формулу: каждая дуга-уровень, обозначается большой цифрой 1,2,3,4; подуровни обозначаются буквами s,p,d,f, а число электронов на них верхними индексами
(см. таблицу).
11.Внешний уровень можно представить электронно-графической формулой, на которой каждая орбиталь показана клеткой, а электроны – стрелками . На одной орбитали не может находиться более двух электронов, так как они отталкиваются друг от друга.
Номер энергетического уровня
1
Подуровни энергии
s (один подуровень)
2
3
s, p (два подуровня)
s, p, d (три подуровня)
4
s, p, d, f (четыре подуровня)


На рисунке отметьте точками, правильные ответы, соедините точки
- .
- 1. заряд ядра атома - натрия равен
- А. 11
- Б. 13
- В. 9
- Г. 21
- 2. количество электронов у атома водорода
- А. 5
- Б. 1
- В. 7
- Г. 2
- 3. сколько электронов у атома хлора на внешнем уровне .
- А. 5
- Б. 7
- В. 8
- Г. 4
- 4. количество энергетических уровней определяем по ;
- А. номеру периода
- Б. номеру группы
- В. Порядковому номеру
Г. произвольно
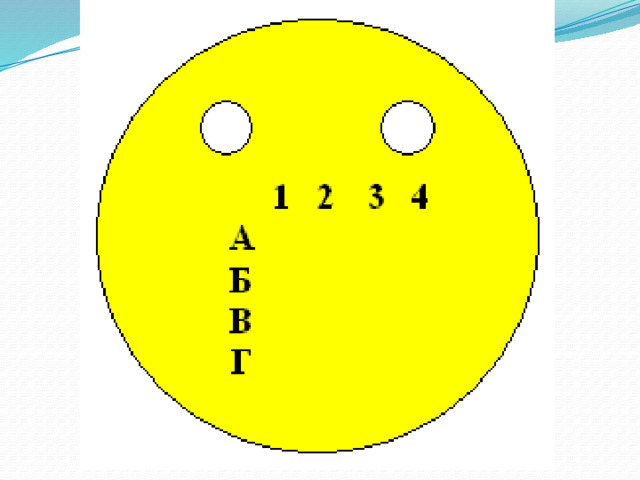

. Если на лице появилась улыбка, значит вы успешно справились с тестом, если улыбка немного исказилась, то у вас есть ошибки, над которыми нужно еще поработать .

Список литературы: 1.https://foxford.ru/wiki/himiya/stroenie-elektronnyh-obolochek. 2.zen.yandex.ru 3.mushared.ru 4. yaklass.ru ›re-9196f3e2-2890-4891-b123-d4dad6d18368 5. u.wikipedia.org › Планетарная модель атома 6. videouroki.net ›…45-stroenie-atoma…rezerforda.html

























































