Практическая работа
Расчетные задачи на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе
Цель: Повторить способы решения расчётных задач на нахождение молекулярной формулы вещества.
АЛГОРИТМЫ РЕШЕНИЯ ТИПОВЫХ РАСЧЁТНЫХ ЗАДАЧ:
Определение молекулярной формулы вещества на основании результатов количественного анализа (массовой доли) и относительной плотности.
Задача. Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
Дано:
1-ый способ
W(С)=80%
W(Н)=20%
D(Н2)=15
Молекулярная формула - ?
Решение:
1. Определяем Mr вещества:
D(Н2)= Mr вещ-ва / Mr (Н2)
Mr вещ-ва = D(Н2)* Mr (Н2);
Mr вещ-ва = 15*2=30
2. Определяем, сколько по массе приходиться на углерод:
30 – 100%
х - 80% ; х= 24 (С).
3. Определяем, сколько по массе приходится на водород:
m(С)= 30 – 24 = 6.
4. Определяем число атомов углерода и водорода в данном веществе:
n (С) = 24 /12 = 2 атома;
n (Н) = 6/1 = 6 атомов.
Формула вещества С2Н6.
2-ой способ
1. Mr вещ-ва =15*2=30.
2. Переходим от массовых долей к мольным долям. Для этого массовые доли надо разделить на относительную атомную массу.
v мольная доля = w%/Аr
Найдем мольные доли углерода и водорода.
Обозначим:
х - число мольных долей углерода;
у –число мольных долей водорода.
х:у = 80/12 : 20/1 = 6,7 : 20
Наименьшее число принимаем за 1, а остальные числа делим на наименьшее. При этом получается:
1 : 3, значит, простейшая формула СН3. Составляем уравнение и определяем истинную формулу:
12n + 3n = 30, 15n = 30, n =2, тогда истинная формула С2Н6.
3-ий способ
Можно сразу определить число атомов элементов, входящих в состав вещества по формуле
n= w*Mr / Аr, но при этом должна быть известна Mr .
1. Mr = 15*2=30
2. n (С)= 0,8*30/12= 2 атома;
n (Н)=0,2*30/1 = 6 атомов.
Значит, формула С2Н6.
II тип задач.
Определение молекулярной формулы вещества на основании продуктов сгорания и относительной плотности.
Задача. При сгорании 1,3 г вещества образуется 4,4 г оксида углерода(IV) и 0,9 г воды. Плотность паров этого вещества по водороду равна 39. Определить молекулярную формулу данного вещества.
Дано:
1-ый способ
m(в-ва) =3,9 г
m(CО2) = 13,2
m(Н2О)= 2,7 г
D(Н2)= 39
Молекулярная формула - ?
Решение:
1. Mr(в-ва) = 39*2 = 78
2. Определяем массу углерода по оксиду углерода (IV).
M(CО2) = 44г/моль, m(CО2)= 44 г.
В 44 г (CО2) содержится 12 г (С),
а в 13,2 г (CО2) – х г (С); х=3,6 г.
Определяем массу водорода по воде
М(Н2О) = 18 г/моль, m(Н2О) = 18 г.
В 18 г (Н2О) – 2 г (Н), а в 2,7 г (Н2О) – у г(Н); у = 0,3 г (Н).
3. Определяем,есть ли в веществе кислород m(С) +m (Н) = 3,6+0,3=3,9 г. Значит, кислорода нет.
4. Определяем отношение атомов.
Пусть х –число атомов углерода, у – число атомов водорода
х : у= 3,6/12 : 0,3/1 = 0,3 : 0,3 = 1: 1.
Простейшая формула СН, но т.к. Mr(вещества )= 78, то составляем уравнение:
12 * 1n + 1n = 78
13n = 78
n = 6
Тогда истинная формула вещества С6Н6.
2-ой способ
1. Mr(в-ва) = 39*2 = 78
2. Массу углерода определяют по массе оксида углерода (IV), а массу водорода – по массе воды.
Для определения количество вещества оксида углерода (IV) и количество вещества воды, а по ним
v(C) и v(Н):
а) М(CО2) = 44 г/моль
M(Н2О) =18 г/моль
v = mМ
v(С) = v(CО2)= 13,2 г/44 г/моль
v(Н) = 2v(Н2О)= 2*2,7 г/18 г/моль;
б)определяем массы углерода и водорода:
m = М* v
m(С) = 12* 0,3 = 3,6 г
m(Н) = 1* 0,3= 0,3 г
3. Определяем, есть ли в веществе кислород:
m(С) + m(Н) = 3,6 + 0,3= 3,9 г.
Значит, кислорода нет.
4. Находим соотношение атомов углерода и водорода
v(С) : v(Н) = 0,3: 0,3= 1:1.
Простейшая формула вещества СН.
5. Определяем истинную формулу вещества:
12* 1 n + 1 n = 78
13 n = 78
n = 6.
Истинная формула С6Н6.
1. Масса 1 л газообразного вещества при н. у. равна 1,875г. Молекулярная формула этого вещества.
2. При сгорании 20 мл горючего газа расходуется 50 мл кислорода и получается 40 мл оксида углерода(4) и 20 мл водяных паров. Найдите формулу газа.
3. Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
4. Определите химическую формулу оксида марганца, если он содержит 63,2% Mn и
36,8% О.
5.Какова массовая доля кальция в карбонате кальция CaCO3?
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: _____2___ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Составление электронных формул атомов элементов и графических схем.
Строение атома элемента:
Цель: Формирование умений обучающихся записывать электронные конфигурации атомов элементов I-IV периодов и определять элемент по электронной конфигурации атома
заряд ядра атома
формула состава атома (количество р; n; е )
количество энергетических уровней и размещение на них электронов
формула электронной конфигурации (1S2S2Р3S3P4S4P5S4D5P6S5D4F6P7S6D5F7P)
квантовые ячейки (графическая формула)
число электронов на последнем слое = металл или неметалл
| ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО, ПОДУРОВНЕЙ, УРОВНЕЙ 1) На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (условно: по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами. |
| 2) В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних |
| 3) Электроны стремятся занять энергетически выгодное положение в электронной оболочке, руководствуясь правилом наименьшей энергии. Расположим АО в порядке возрастания значений их энергии, которая определяется суммой: (№ УРОВНЯ + число, которое соответствует подуровню):
s (0), p (2), d (3), f (4) |
Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Ca, Fe, Zr, Sn, Nb, Hf, Pa.

Инструкция: выберите один правильный ответ
1.Химическому элементу 3-го периода VА-группы соответствует схема распределения электронов по слоям:
1) 2, 8, 5 2) 2, 8, 3 3) 2,5 4) 2, 3
2.Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует:
1) заряду ядра в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего слоя
4) числу электронных слоев в атоме
3. Определите положение элемента в периодической системе (период, группа, подгруппа) по электронной формуле и назовите его:
1S22S22P63S23P4
4. Составьте графическую формулу элемента с электронной формулой 1S22S22P63S23P4 и покажите все валентные состояния данного элемента.
5. Номер группы в Периодической системе Д.И.Менделеева соответствует:
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду (только для главных подгрупп)
3) числу электронов, недостающих для завершения внешнего электронного слоя
4) числу электронных слоев в атоме.
6. Номер периода в Периодической системе Д.И.Менделеева соответствует:
1) электронов в атоме
2) электронов во внешнем слое атомов
3) числу электронов, недостающих до завершения внешнего слоя
4) числу заполняемых электронных слоев
7. В периоде с увеличением порядкового номера химического элемента происходит:
1) уменьшение заряда ядра
2) усиление металлических свойств
3) уменьшение атомного радиуса
4) уменьшение числа валентных электронов
8. Радиус атомов увеличивается в ряду элементов:
1) H-Li-Na
2) K-Na-Li
3) Na-Mg-AI
4) Be-Ca-Mg
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ______2___ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
«Определение: валентности и степени в соединениях неорганических веществ».
Цель: Закрепление умений обучающихся определение степени окисления, типа химической связи, вычисление молекулярной и молярной массы.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот
 — степень окисления,
— степень окисления,
 — заряды.
— заряды.
Степень окисления атома в простом веществе равна нулю, например:

Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:


Задание 1.Определите степень окисления в следующих соединениях:
Cr2O3, NaBr, P2O5, Al, CuCl2 , PH3, Mg3P2, SiO2, Mg, AlCl3.
Задание 2. Определите валентности элементов в соединениях:
CO2, CO, Mn2O7, Cl2O, P2O3, AlP, Na2S, NH3, Mg3N2.
П о д с к а з к а. Сначала укажите валентность атомов, у которых она постоянная. Аналогично определяется валентность атомных групп ОН, РО4, SО4 и др.
Задание 3. Определите валентности атомных групп (в формулах подчеркнуты):
H3PO4, Ca(OH)2, Ca3(PO4)2, H2SO4, CuSO4.
(Обратите внимание! Одинаковые группы атомов имеют одинаковые валентности во всех соединениях.)
Зная валентности атома или группы атомов, можно составить формулу соединения. Для этого пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число атомов одинаково, т.е. индексы не ставим:
• Если валентности кратны (обе делятся на одно и то же число), то число атомов элемента с меньшей валентностью определяем делением:
• В остальных случаях индексы определяют «крест-накрест»:
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: _____1____ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Составить схемы образования химической связи различного типа
Цель: развитие навыков составления электронных схем образования химических связей, соединений с ионным типом связи и определения количества электронов в ионах; развитие умений определения типа связи на основании анализа состава химического соединения.
Ионная связь – это связь между атомами резко отличающимися по электроотрицательности: у одного она очень высокая, у другого – низкая. В этом случае, атом с меньшей электроотрицательностью полностью отдает свои валентные электроны атому с большей электроотрицательностью. Ионная связь образуется между металлами и неметаллами.
Такой тип связи в NaCl, CsBr, NH4Cl и др. При образовании ионной связи образуются заряженные частицы: ионы.
Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных металлов.
Анионы – отрицательно заряженные ионы. Их легче всего образуют галогены. Элементы главной подгруппы 7 группы. До завершения валентного уровня им не хватает всего одного электрона.
Схема образования ионной связи на примере хлорида натрия.

Химическая связь, образующаяся в результате перекрывания атомных орбиталей, при котором пара электронов становится общей для обоих атомов, называется ковалентной связью
Обратите внимание: при ковалентной связи пара электронов становится общей для обоих атомов. Образование молекулы водорода – это пример ковалентной связи. При этом область повышенной электронной плотности находится посередине относительно центров ядер атомов, то есть пара электронов в равной степени принадлежит обоим атомам водорода. Такая связь называется ковалентной неполярной связью.
Химическую связь между атомами элементов, в результате которой электроны в равной степени принадлежат обоим атомам, называют ковалентной неполярной связью.
3. Ковалентная неполярная связь в молекуле хлора
Образование ковалентной неполярной связи в молекуле хлора Cl2,F2


Задание 1. Определите, какая химическая связь осуществляется между атомами в веществах: NаСl, НСl, Сl2, АlСl3, Н2О. Дайте пояснения.
Задание 2. Составьте электронные и графические формулы для тех веществ из задания 4.2, в которых вы определили наличие ковалентной связи. Для ионной связи составьте схемы перехода электронов.
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____1___ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Решение задач: определение массовой доли выхода продукта в % от теоретически возможного.
Цель:
Алгоритм решения и оформление задач.
| 1. Внимательно прочитай условие задачи! | При пропускании 11,2л аммиака через раствор азотной кислоты, получили 15г нитрата аммония. Сколько % это составляет от теоретически возможного выхода. |
| 2. Запиши «Дано:» (масса продукта реакции, данная по условию является его практическим выходом) | ![]() Дано: Дано:
V(NH3) = 11,2л mпракт.вых(NH4NO3) = 15г_ η(NH4NO3) - ? |
| 3. Запиши формулу массовой доли выхода продукта реакции от теоретически возможного |
η =  100% 100% |
| 4. Запиши уравнение реакции. Расставь коэффициенты. Подчеркни формулы тех веществ, с которыми будешь решать задачу. |
NH3+ HNO3 → NH4NO3 |
| 5. Над формулой исходного вещества проставь массу(V), данные по условию, а над формулой продукта реакции поставь – Х, так ты найдешь массу(V) его теоретического выхода |
11,2л Х NH3+ HNO3 → NH4NO3 |
| 6. Под формулами подчеркнутых веществ: проставь число их молей; определи и проставь молярные массы(объемы) этих веществ, не забывая умножать их на число молей. | 11,2л Х NH3+ HNO3 → NH4NO3 1 моль 1 моль ×22,4л/моль ×80г/моль =22,4л = 80г |
| 7. Составь пропорцию, найди значение Х – это и будет масса(объем) теоретического выхода продукта реакции. . | 11,2л Х NH3+ HNO3 → NH4NO3 1 моль 1 моль ×22,4л/моль ×80г/моль =22,4л = 80г  = =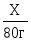  Х = Х =  = 40г – mтеор.вых = 40г – mтеор.вых
|
Образец оформления задачи:
![]() Дано: Решение:
Дано: Решение:
V(NH3) = 11,2л 1) m(V)теоретич. выхода -?
mпракт.вых(NH4NO3) = 15г 11,2л Х
η(NH4NO3) - ? NH3+ HNO3 → NH4NO3
1 моль 1 моль
×22,4л/моль ×80г/моль
=22,4л = 80г
 =
=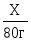
 Х =
Х =  = 40г – mтеор.вых
= 40г – mтеор.вых
2) η(NH4NO3) - ?
η(NH4NO3) =  100% =
100% =  100% = 37,5%
100% = 37,5%
Ответ: η(NH4NO3) = 37,5%
Реши самостоятельно:
1.При пропускании 170г аммиака через раствор соляной кислоты получили 500г хлорида аммония. Сколько % это составляет от теоретически возможного выхода.
2. Для получения осадка сульфата бария был взят раствор серной кислоты массой 490 г. Массовая доля выхода соли от теоретически возможного составила 96%. Какова масса полученного осадка?
3. Вычислите объемную долю выхода оксида азота (2) от теоретически возможного, если в реакции окисления 44,8 л аммиака получили 40 л оксида азота (2).
4. Вычислите объем аммиака, который может быть получен при взаимодействии 30 л азота и водорода, выход аммиака от теоретически возможного составляет 11%
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ___1____ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Составление уравнений реакций в молекулярной и ионной форме
Цель работы: Составление уравнений реакций в молекулярной и ионной форме
Задача № 1. Составьте в молекулярной и ионной форме уравнения реакций гидролиза Iступени СиС12, укажите среду раствора (кислая, щелочная или нейтральная).
Решение: 1. Составим уравнение диссоциации:
CuCl2àСи2+ + 2С1-
2. Проведем анализ соли: СиС12 образована Сu(ОН)2 - слабым основанием и НС1– сильнойкислотой.
3. Исходя из анализа состава соли, вода будет реагировать с ионами Сu2+; гидролиз идет покатиону:
 СuС12 + НОН CuOHCl + HCl
СuС12 + НОН CuOHCl + HCl
4. Записываем полноеионное уравнении реакции

 Cu2+ + 2С1-+ НОН Сu(ОН)+ + Сl- + Н+ + Сl-
Cu2+ + 2С1-+ НОН Сu(ОН)+ + Сl- + Н+ + Сl-
5. Исключаем ионыСl- и получаем краткое уравнениереакции:

 Сu2+ + НОН СuОН+ + Н+
Сu2+ + НОН СuОН+ + Н+
Ионы водорода указывает на кислую среду реакции (рН 7).
Задача № 2. Составьте уравнения реакций совместного гидролиза хлорида хрома (III) исульфата калия.
Решение: При совместном гидролизе образуется кислота и слабое основание:
1. Составляем молекулярное уравнение:
 2СrС13 + 3K2S + 6Н2О = 2Сr(ОН)3+ 3H2S + 6KC1
2СrС13 + 3K2S + 6Н2О = 2Сr(ОН)3+ 3H2S + 6KC1
 2. Записываем полное ионное уравнение
2. Записываем полное ионное уравнение
 2С3+ + 6Сl-+ 6К+ + 3S2- + 6Н2О = 2Сr(ОН)3+ 3H2S + 6К+ + 6Сl-
2С3+ + 6Сl-+ 6К+ + 3S2- + 6Н2О = 2Сr(ОН)3+ 3H2S + 6К+ + 6Сl-
 3.Исключаем одноименные ионы:
3.Исключаем одноименные ионы:
2Cr3+ + 3S2- + 6Н2О = 2Сr(ОН)3 + 3H2S
Задание 1.
1.Составьте уравнения реакций I ступени гидролиза в молекулярной и ионной форме укажите среду раствора:
а)Na2CO3
б)NH4C1
Задание 2 Составьте уравнения реакций совместного гидролиза в молекулярной и ионной форме следующих солей:
а)Fe2(SO4)3 + Na2CO3
б)NH4NO3 + Na2Si03 .
. Задание 2.
1.Составьте уравнения реакций I ступени гидролиза в молекулярной и ионной форме укажите среду раствора:
а)FeCl2
б)Cu(NO3)2
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____2____ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Составление уравнений окислительно- восстановительных реакций.
Цели работы
закрепить знания по теме " Составление уравнений окислительно- восстановительных реакций отработать навыки составления ОРВ.
Краткие теоретические сведения
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией.
Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества с ионной связью: соли, основания и полярные молекулы кислот. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами.
| Классификация электролитов | Степень электролитической диссоциации | Сила электролита | Примеры | | α 30% | сильные | кислоты | H2SO4, HNO3,HCl, HBr, HI | | основания | Ме(OH)n Р., М. в воде | | соли | Р. в воде | | 3% | средние | кислоты | HF , H2SO3, Н3PO4 | | основания | Fe(OH)3 | | α | слабые | кислоты | H2S, H2CO3, H2SiO3, СН3СООH | | основания | Ме(OH)n Н. в воде и NH4OH | | соли | М. в воде |
| Электролитическая диссоциация: I. кислот, II. щелочей, III. солей.
I. 1. HCl D H+ + Cl-,
HCl + H2O D H3O+ + Cl-,
2. H2SO4 =D 2H+ + SO42-.
3. Ступенчатая диссоцация кислот:
H3PO4 D H+ + H2PO4-,
H2PO4- D H+ + HPO42-,
HPO42- D H+ + PO43-.
II. NaOH D Na+ + OH-,
Ca(OH)2 D Ca2+ + 2OH-.
III. BaCl2 D Ba2+ + 2Cl-,
Ca(NO3)2 D Ca2+ + 2NO3-,
Al2(SO4)3 D 2Al3+ + 3SO42-. |
| Реакции обмена между растворами электролитов идут до конца, если образуется малодиссоциирующее вещество, или вещество, практически нерастворимое, выделяющееся из раствора в виде осадка или газа. |
Пример 1. Составьте полные и краткие ионные уравнения реакций:
КОН + СиС12 = Си(ОН)2â+КС1.
Решение:
Расставим коэффициенты в уравнении реакции
2КОН + СuСl2=Сu(ОН)2â +2КСl.
По таблице растворимости проверяем растворимость каждого вещества и указываем над каждой формулой: Н-НЕРАСТВОРИМОЕ, Р-РАСТВОРИМОЕ:
| Р | р | н | р |
| 2КОН | + СuС12 | = Сu(ОН)2â | +2КСl |
3. Растворимые вещества расписываем на катионы и анионы:
2К+ +2ОН- + Сu2+ 2С1- = Сu(ОН)2â+2К+ + 2Сl.
4. Исключаем одинаковые ионы в левой и правой части уравнения:
2K+ + 2ОН- + Сu2+ + 2Сl = Сu (ОН)2â2К+ + 2Сl-.
5. Записываем краткое ионное уравнение:
Cu2+ +2OH- = Сu (ОН)2.
Пример 2.Допишите уравнения химической реакции и составьте полное и сокращенное ионное уравнение:
CuS + HClà
Решение:
Допишем правую часть уравнения:
CuS + HC1àCuCl2 + H2Sá
Расставим коэффициенты в уравнении химической реакции:
CuS + 2HC1 —► CuCl2 + H2Sá
По таблице растворимости проверяем диссоциирует в растворе на ионы веществоили нет
| н | Р | р | н |
| CuS+ | 2HClà | CuCl2 | H2Sá |
Растворимые вещества расписываем на катионы и анионы:
CuS- + 2Н+ + 2Сl- = Cu2+ + 2Cl- + H2Sá
Исключаем одинаковые ионы в левой и правой части уравнения:
CuS + 2Н+ + 2Сl-=Cu2++2Сl- + H2Sá
6. Записываем краткое ионное уравнение:
2H++S2- = H2Sá
Вопросы для выводов
1. Указать: в чём заключается сущность реакций ионного обмена.
2. Условия течения реакций ионного обмена идущей до конца (необратимой реакции).
Контрольные вопросы
Составить молекулярные уравнения для реакций, если краткие ионные уравнения имеют вид:
a) Ca2+ + CO32- → CaCO3↓, б) 2H+ + SO32- → H2O + SO2↑.
Для уравнений реакций составить ионные уравнения:
а) Fe(OH)3$ + 3HCl → FeCl3 + 3H2O,
б) Ca(OН)2 + 2HNO3 → Ca(NO3)2 + 2H2O.
Составьте полные и сокращенные ионные уравнения реакций:
а)K2S + НС1àКСl+H2Sá
б)MgO + H2SO4àMgSO4 + H2O.
Допишите уравнения химических реакций и составьте полные и сокращенные ионные уравнения:
а)CaCl2 + NaCO3à
б)Ва(ОН)2 + H2SO4à
Составьте по два молекулярных уравнения химических реакций по
сокращенным ионным уравнениям:
а)Н++ОН- = Н2О
6)Ag+ + Cl-=AgClâ|
Осуществите цепочку превращений:
Na2OàNaOHàNa2SO4àBaSO4
Составьте полные и сокращенные ионные уравнения реакций:
а)КОН + ZnCl2àКС1 + Zn(OH)2â
б)NaCl +AgNO3àAgClâ+NaNO3.
Допишите уравнения химических реакций и составьте полные и сокращенныеионные уравнения:
а)SO3+NaOHà б)NH4C1 + Са(ОН)2à
Составьте по два молекулярных уравнения химических реакций по
сокращенным ионным уравнениям:
a)Ba2++SO2- = BaSO4â
б) Zn(OH)2â + 2Н+ = Zn2+ + 2Н2О
Осуществите цепочку превращений:
СuО àCuSO4 2àСu (ОН)2àСuС1
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: _____1____ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.
Практическая работа
Составление уравнений реакций химического равновесия.
Цели работы
Краткие теоретические сведения
 Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
С – молярная концентрация, t – время
Задача № 1 Вкакую сторону сместится равновесие химической реакции:
 2SO2 + O2 3SO3 + Q
2SO2 + O2 3SO3 + Q
г г г
при: а) повышении давления в системе;
б) при понижении температуры;
в) при увеличении концентрации О2
Решение: Для обратимых химических реакций с течением времени наступает состояние, когда скорость прямой и обратной реакции становятся равными, т.е. система находиться в равновесии. При любом изменении условий система стремиться ослабить это воздействие по правилу Ле-Шателье:
а) при повышении давления равновесие смещается в сторону уменьшения объема. Рассчитаем
объемы газов в данной реакции, они в соответствии с законом Авогадро равны коэффициентам в
уравнении реакции:
| 2V | 1V | 3V |
| 2SO2 + |  O2 O2
| 3SO3 + Q |
| г | г | г |
Так как объемы в левой и правой части химической реакции равны, следовательно при повышении давления равновесие не смещается.
б) при понижении температуры химическое равновесие смещается в сторону эндотермической реакции. Так как прямая реакция экзотермическая, то равновесие смещается в сторону обратной реакции, т.е. влево.
в) при увеличении концентрации веществ равновесие смещается в сторону ее уменьшения. Так как концентрация реагирующих веществ увеличилась, то равновесие смещается в сторону прямой реакции, т.е. вправо.
Задача 2. Дайте характеристику химической реакции по всем признакам:
О +6 +2 +4
Си + H2SO4àCuS04 + SO2 + Н2О + Q.
Решение: Каждая химическая характеризуется по нескольким признакам:
по числу и составу исходных веществ и продуктов реакции - не классифицируется;
по тепловому эффекту - экзотермическая;
по обратимости процесса - необратимая;
по однородности среды - гетерогенная;
по применению специальных веществ - некаталитическая;
по изменению степени окисления - ОВР (межмолекулярная)
электронный баланс:
Сu- 2 еà Сu - восстановитель, окисляется
+6 +4
S +2е àS - окислитель, восстанавливается
7.Уравнение химической реакции:
О +6 +2 +4
Сu + 2H2SO4àCuSO4+ SO2 + 2H2O+Q
Тв ж ж г ж
Задания
1 .Как измениться скорость химической реакции:
| 2SO2 |  + О2 + О2
| 3SO3 + Q |
| г | г | г |
если концентрация SO, увеличили в 3 раза?
2. В какую сторону сместиться равновесиехимической реакции:
| N2 | + ЗН2à | 2NH3 + Q |
| (г) | (г) | (г) |
при: а) понижении давления;
б) понижении температуры;
в) понижении концентрации NH3
3.Дайте характеристику химической реакции по всем признакам:
| СаО | + НС1 | = СаС12 | + Н2О + Q |
| Тв | ж | ж | ж |
| Задачи на основные термохимические расчеты 1. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль. Решение Ответ. 65,3 кДж/моль. 2. Найти теплоту образования угарного газа, если теплота образования углекислого газа равна +393,8 кДж/моль, а теплота реакции получения углекислого газа из угарного газа и кислорода равна +283,2 кДж/моль. Ответ. +110,6 кДж/моль. 3. Теплота сгорания графита составляет +393,8 кДж/моль, а теплота сгорания алмаза равна
+395,7 кДж/моль. Определить теплоту превращения графита в алмаз. Ответ. –1,9 кДж/моль. 4. Теплота образования бромоводорода равна +36 кДж/моль, теплота образования йодоводорода равна +12,6 кДж/моль. Рассчитать тепловой эффект реакции взаимодействия йодоводорода с бромом. Ответ. +23,4 кДж/моль.
Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: _____1____ ч. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки: Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2».
|
Практическая работа
Решение комбинированных задач
Задачи на примеси в реагенте
Цель: отрабатывать навыки практического применения имеющихся знаний, развивать способность к самостоятельной работе.
В природе, технике и в быту мы не найдем химически чистых веществ: они всегда содержат определенную долю примесей. Очевидно, что эта доля также может быть найдена как отношение соответствующих величин друг к другу. Обозначим массовую долю примесей в веществе W(пр.), а массу примесей – m(пр.), тогда получим уравнение:
W(пр.) = m(пр.) / m
Обычно примеси составляют небольшую по величине долю; основная часть по массе приходится на чистое вещество, поэтому следует ввести понятие о массовой доле чистого вещества – W(ч.в.) , которая равна
W(ч.в.) = 100% - W(пр.);
W(ч.в.) = 1 - W(пр.);
W(ч.в.) = m(ч.в.) / m,
где m(ч.в.) – масса чистого вещества.
Используя алгебраический подход в решении расчетных задач,
m(пр.) = W(пр.) × m(всего вещества);
m(ч.в.) = W(ч.в.) × m(всего вещества);
m = m(пр.) / W(пр.);
m(ч.в.) = m(всего вещества) – m(пр.).
Например:
Задача 1. В какой массе оксида железа (III), содержащего 5 % примесей, содержится 20 г железа?
Решение:
m (всего вещества)=X г и составляет 100%,
W(ч.в.) = 100% - W(пр.); W(ч.в.) = 100% - 5%(пр.) = 95%;
20г железа (Fe) составляет 95%,
X г (Fe2O3) составляет 100%,
X= 20x100/95 =21г
Ответ: m (всего вещества) Fe2O3=21г
Задача 2. Минерал содержит 96 % сульфида меди (II). В каком количестве этого минерала содержится 100 г меди?
Задача 3. Негашеную известь (оксид кальция) получают нагреванием известняка. Зная, что оксид кальция получается при разложении карбоната кальция, рассчитайте, сколько негашеной извести можно получить из 1 т известняка, содержащего 10 % примесей.
Самостоятельно можно решить задачи № 1.71 – 1.73 стр.12 из «Сборника задач и упражнений по химии» И. Г. Хомченко, издательство «Новая волна», для средней школы.
Задачи на практический выход продукта
Очевидно, что на практике продукта реакции образуется меньше, чем следует ожидать по уравнению реакции. Рассматривая схему реакции в общем виде (см. ниже), необходимо указать на то, что исходные вещества могут содержать примеси, не дающие целевого продукта реакции; в ходе процесса могут быть потери, связанные с особенностями применяемых аппаратов, условий и т.п.
Реагенты А и В, (содержащий примеси), дают продукты C и D меньшей массы.
Таким образом, m(р) – это масса реально полученного продукта, а m(т) – теоретическая масса продукта, рассчитанная по уравнению реакции. Отношение m(р) к m(т) и есть массовая доля практического выхода. Ее можно вычислять в долях единицы или в процентах (более привычно).
W(выхода продукта реакции) = m(р) / m(т).
Аналогично выводится понятие об объемной доле практического выхода j
Объемная доля практического выхода продукта есть отношение объема газообразного продукта, полученного реально, к объему продукта, рассчитанному по уравнению реакции:
j = V(р) / V(т).
Например:
Задача 1. Чему равна массовая доля выхода продукта, если из гидроксида кальция массой 370 г получили 500 г хлорида кальция?
Решение:
Составить уравнение реакции:
Ca(OH)2 + 2HCl = CaCl2 + H2O
По условию задачи дано: 370г Ca(OH)2;
500г CaCl2 – это реальная масса продукта.
Надо найти теоретическую массу по уравнению реакции:
М Ca(OH)2 = 74г/моль (рассчитывается по ПСХЭ)
М CaCl2 = 111г/моль (рассчитывается по ПСХЭ)
Из 74 г Ca(OH)2 получили 111г CaCl2 (по уравнению реакции)
Из 370г Ca(OH)2 получили Хг CaCl2 (по условию задачи)
Х= 370х111/74 = 555г - это теоретическая масса продукта
W(выхода продукта реакции) = m(р) / m(т) = 500/555х100% = 90%.
Ответ: W(выхода продукта реакции) = 90%.
Задача 2. Цинк растворили в соляной кислоте массой 300 г с массовой долей HCl 25 %. Чему равна массовая доля практического выхода, если масса полученного хлорида цинка составила 130 г?
Задача 3. Из 20 г оксида кальция, содержащего 2 % примесей, получили 38 г хлорида кальция. Вычислите массовую долю выхода продукта в процентах от теоретически возможного.
Задача 4. На горение фосфора затратили 35 л кислорода. Масса полученного оксида фосфора (V) составила 40 г. Определите массовую долю выхода продукта в процентах от теоретически возможного.
Задачи на избыток одного из реагентов
Вначале нужно определить, какое из реагирующих веществ находится в избытке, а какое расходуется полностью. Именно по нему и ведут расчет массы или объема продукта реакции. Известно, что вещества реагируют друг с другом в стехиометрических соотношениях, которые устанавливаются по коэффициентам в уравнении. Если один из реагентов взят в избытке (больше, чем соответствует стехиометрическому количеству), то избыток его останется неиспользованным после реакции. Понятно, что количество продукта реакции будет зависеть от количества того реагента, который расходуется полностью.
Представьте себе, что на практической работе имеются 10 пробирок и 8 пробок с газоотводными трубками к ним. Сколько приборов для получения газа вы соберете? Очевидно, что таких приборов будет восемь, так как их число ограничено числом пробок. По аналогии рассчитывают соотношения количеств веществ, участвующих в химической реакции.
Далее рассматривается конкретная задача.
Например: сколько молей воды получится при взаимодействии 8 моль водорода и 5 моль кислорода?
Записывается уравнение реакции, в котором над и под формулами реагентов и продукта отмечаются необходимые данные (как и при решении задач предыдущих типов):
8моль 5моль Х моль
2H2 + O2 = 2H2O
2 моль 1 моль 2 моль
I способ .
Далее рассуждаем: на 2 моль водорода расходуется 1 моль кислорода; на 8 моль водорода должно расходоваться 4 моль кислорода, а дано 5 моль. Вывод: кислород дан в избытке, следовательно, расчет массы воды надо вести на основе количества водорода. Так как по уравнению реакции количество водорода равно количеству воды, то n(H2O) = 8 моль, что и требовалось определить.
II способ
Для каждого исходного вещества составляем дробь: в числителе – величина, записанная над формулой, в знаменателе – под формулой этого вещества.
Для нашей задачи:
Далее сравнивают дроби и ставят между ними соответствующий знак: «=», «» или «».
Для нашего случая:

И далее определяется количество воды, как в первом случае.
Если в условии задачи даны массы (объемы) реагентов, то в дробь подставляем соответствующие величины. Все действия закладываются в соответствующий алгоритм.
Например:
Задача 1. Сколько граммов соли получится при нейтрализации 4,9 г серной кислоты гидроксидом натрия массой 5 г?
1. Составим уравнение реакции, в которое вносятся соответствующие условию задачи данные, а также сведения о веществах, вытекающие из коэффициентов:
2. Далее сравниваем отношение массы каждого вещества, заданной по условию задачи, к массе вещества, соответствующей химическому уравнению:
3. Под меньшим отношением записывается «расчет» (это отношение используется при расчете массы продукта реакции), а под большим отношением – «избыток»:
Избыток Расчет
4. Далее составляется другая пропорция, по которой находим массу продукта реакции: 
х = 4,9 г × 142 г / 98 г
х = 7,1 г.
Ответ: получится 8,875 г сульфата натрия.
Задача 2. Водород и кислород объемом по 5,6л каждого (объемы приведены к нормальным условиям) смешали и взорвали. Определите массу воды, которая может образоваться в результате реакции.
Задача 3. Оксид кальция массой 2,8 г растворили в 200г хлороводородной кислоты. Рассчитайте массу полученной соли хлорида кальция.
Задача 4. Водород массой 4г пропустили при нагревании над 20г оксида
меди (II). Какая масса металлической меди может быть получена при этом?
Задачи с использованием массовой доли растворенного вещества в растворе
Химические реакции часто протекают в водных растворах, концентрация которых заранее известна. Как можно рассчитать массу продукта реакции, если исходный реагент дан в виде раствора известной концентрации?
Модель раствора имеет следующий вид:
Рис. Графическая модель раствора
(Р.в. – растворенное вещество)
Основные уравнения связи между этими величинами:
W(р.в.) = m(р.в.) / m (р-ра);
m(р.в.) = W(р.в.) m (р-ра);
m(р-ра) = m (р.в.) / W (р.в.),
где W(р.в.) – массовая доля растворенного вещества; m(р.в.) – масса растворенного вещества, m(р-ра) – масса раствора.
задачи этого типа похожи по решению с задачами на применение массовой доли примесей в основном веществе. В обоих случаях используется одно и то же понятие – массовая доля компонента. Значит, математические действия (алгоритм) при решении будут сходными.
Например:
Задача 1. В 200г воды растворили 50 г хлорида натрия. Вычислите массовую долю NaCl в полученном растворе.
Решение:
W(р.в.) = m(р.в.) / m (р-ра)
m (р-ра) NaCl = m (воды)+ m(р.в.)= 200г + 50г = 250г
W(р.в.) = 50 г (р.в.) / 250 г (р-ра) х 100% = 20%
Ответ: массовую долю NaCl в полученном растворе равна 20%.
Задача 2. Сколько граммов хлорида меди (II) получится при взаимодействии 150 г 10%-ной соляной кислоты с оксидом меди?
Задача 3. Вычислите объем водорода, выделившегося при взаимодействии с цинком 20%-ного раствора серной кислоты массой 20 г.
Задача 4. Взаимодействуют оксид кальция и соляная кислота. Чему равна масса полученной соли, если был взят раствор соляной кислоты массой 100 г, а массовая доля растворенного вещества – 20 %
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: _____1_____ ч.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Аналогично разберите все предложенные в карточке химические элементы.











 СuС12 + НОН CuOHCl + HCl
СuС12 + НОН CuOHCl + HCl
 Cu2+ + 2С1-+ НОН Сu(ОН)+ + Сl- + Н+ + Сl-
Cu2+ + 2С1-+ НОН Сu(ОН)+ + Сl- + Н+ + Сl-
















