Практическая работа
Тема: Приготовление раствора заданной концентрации.
Цель работы: Ознакомится с методами приготовления раствора различных концентраций.
Основные теоретические положения.
Растворами называются однородные (гомогенные) смеси двух или большею числа веществ. Т.к. в растворах все компоненты находятся в виде отдельных атомов, молекул и ионов, химические процессы в них протекаю быстрее. Классификация растворов основана на различных признаках: по агрегатному состоянию, в зависимости от характера природы растворителя, по концентрации растворенного вещества, наконец, растворы электролитов и неэлектролитов. При растворении следует помнить «подобное растворяется в подобном», т.е. полярные вещества хорошо растворяются в полярных средах, а неполярные - в неполярных.
Растворимость различных веществ обычно рассчитывается на 100 г чистого растворители. Концентрацию растворов выражают различными способами:
весовая концентрация с % (w %) - количество безводного вещества в граммах на 100 г раствора; )
молярность (см) - число молей растворенного вещества в 1 литре раствора; )
нормальность (сн) - число грамм - эквивалентов вещества в 1 литре раствора;
моляльность (сm) - число молей растворенного вещества на 1 ООО грамм растворителя;
состав раствора также можно выразить суммой мольных долей растворенного вещества и растворителя (N).
В профессии повара очень широко используются вещества, способные растворить и быть растворителями, это H2O, спирты, сахара, крахмалы, белки, соли и т.д.
Вводимые в пищевые продукты некоторые химические вещества должны препятствовать развитию микроорганизмов, к таким консервантам относят уксусную, бензойную кислоты, поваренную соль. При приготовлении супов, соусов, различных напитков, при мариновании овощей, плодов, мяса, грибов, рыбы мы имеем дело с различными растворами. Алкогольная и молочная продукция - это тоже растворы. Кондитерские товары состоят в основном, из сахара или другого сладкого вещества (медицинский ксилит, сорбит), а также соков различных фруктов и ягод, молока и т.д.. консервантом здесь служит сахар 60-75 %.
Очень часто приходится работать с уксусной эссенцией, концентрация которой высока (70%), а в приготовлении блюд необходима гораздо меньшая концентрация от 7% до 9%, надо уметь готовить растворы менее концентрированные из концентрированных и т.д.
Оборудование и реактивы:
1. Химическая посуда, ареометры, стаканы (100 мл.), колбы, мерные цилиндры.
2. Реактивы (Н28О4 концентрированная, СН3СООН, NaCL).
3. Технические весы, разновесы.
4. Справочники.
Порядок выполнения работы:
Приготовление растворов различной концентрации (15%, 0.1 М, 0,1 Н).
Приготовление раствора заданной концентрации смешиванием растворов более высокой и низкой концентрации.
Решение задач с использованием различных способов выражения концентрации растворов.
Опыт 1.
Между плотностью раствора (р) и концентрацией растворенного вещества существует непосредственная зависимость. Эта зависимость установлена и приводится в справочниках в виде таблиц. Плотность раствора чаще всего определяют с помощью ареометров. Для этого исследуемый раствор наливают в стеклянный цилиндр, погружая в него поочередно ареометры, подбирают такой из них, при котором уровень жидкости находится в пределах его шкалы. Показания ареометра запишите, так как это отвечает плотности этой жидкости. В опыте исследуйте серную кислоту.
Опыт 2.
а) Для приготовления 15% раствора поваренной соли, необходимо по формуле mp вещества
w= * 100%
mр-pа
рассчитать mр в-ва, если масса раствора 100 г. Отметить на весах полученную массу вещества и растворить его в дистиллированной воде (mH20=mрра-mNaCL)-Взвешивать воду, как и другие жидкости не весах нельзя! Мы отмериваем объем воды в миллилитрах, а не ее массу, т.к. число мл воды, равно требуемому числу граммов, т.к. РH20= 1
Чтобы отмерить нужный V воды, возьмите мерный цилиндр, установите цену его деления. В цилиндр наливают столько воды, чтобы её мениск совмещался с нужным делением. Отмеренную воду выливают в стакан, где находится соль, и хорошо размешивают до полного растворения соли. Раствор готов.
I способ. Для приготовления 0,1М или 0,1 Н растворов Н2SO4, сначала определяют плотность ареометром, в справочнике находят концентрацию кислоты. Отмерить мензуркой 10-15 мл Н28О4. В мерную колбу вместимостью 100 мл примерно на 1/4 её объема наливают дистиллированную воду, затем через воронку переливают кислоту. Доводят уровень жидкости в колбе до метки по нижнему мениску. Раствор готов.
Молярные растворы готовят в мерных колбах. У этих колб точно измеренная вместимость, величины которой написаны на стенке колбы, в нашем опыте это 100 мл.
II способ. Задачу можно решать и используя массу вещества.
Дано: Решение:
Урра=100мл v
Ст=0,1 моль/л Сm=----------- = V H2SO4 = 0,1 л*0,1моль/л=0,001 моль
V
Таким образом, для приготовления нужного раствора необходимо взять
0,001 моль Н2S04
По формуле m= М*v = 98 г/моль * 0,001 моль = 0,98 г.
Теперь можно приготовить раствор (см. опыт 2 а). Раствор из мерной колбы необходимо перелить в склянку.
Опыт 3.
1 способ. Приготовить 100 мл. 10% раствора уксусной кислоты, имея в своём распоряжении 70% и 9% растворы СН3СООН.
В справочнике по концентрации растворов найти плотность СН3СООН. Составить схему расчета по «правилу креста» и вычислить массы исходных 70% и 9% растворов. Пользуясь плотностями, найти объемы растворов.
m1=c-c2
m2=c1-c
с1 m1
с
с2 m2
С - концентрация приготовленного раствора, в %
С1С2- высокая и низкая концентрация исходных растворов, в %
m1 и m2- массы исходных растворов более высокой и низкой концентрации.
Отмерить вычисленные объемы исходных растворов, слить в колбу на 100 мл и тщательно перемешать. Часть раствора перелить в цилиндр, измерить ареометром плотность, найти по справочнику концентрацию в %. Расхождения с расчетными данными должны быть незначительные.
II способ. Решение задачи, используя массу, не « правило креста». Какой объем 2% раствора НСL надо приготовить из 20 л 26% раствора её. Сколько литров воды для этого понадобится? Решение
1) Чтобы приготовить 2% раствор необходимо знать, какова масса НСL в 20 л 26% раствора кислоты?
m(HCI) w1*m1
W=--------*100% = mHCI=--------
m1(pp) 100%
Так как неизвестна, а известен V1, кислоты, как и другие жидкости не взвешивают, а измеряют их объем, используя формулу m1= V1*p1 (по таблице находим р1(26%) = 1,132 кг/л)
m1= 20л*1,132 кг/л = 22,64 кг
По уравнению определяем m1= 26*22,64 / 100% = 45,8864 (кг)
По формуле mHCI 45,8864*100%
m2=--------*100%= ----= 294,32 кг
w2 2%
m 294,32
4) V=-------; p2(2%=1,01кг/л); V=-----------=291,4 л
p2 1,01
5) Для приготовления 2% раствора, т.е. для разведения 26% раствора понадобится объем воды = 291,4 л - 20 л = 271,4 л
Контрольные вопросы:
1) Задача.
Плотность 18% водного раствора а - глюкозы (С6Н12О6- виноградный сахар) при 20 градусов С равна 1,0712 г/мл. Выразить состав раствора в мольных долях, найти молярную, нормальную, моляльную концентрации.
Какие применяются способы выражения концентрации растворов?
От чего зависит растворимость веществ?
4) Какую роль играют растворы в профессии повара, продавца?
5) Приведите по несколько примеров твердых веществ, используемых в вашей профессии, которые:
6) Почему при открывании бутылки с газированной водой начинается обильное выделение газа, тогда как в закрытой бутылке этого не наблюдается.
Практическая работа
Тема: Получение, собирание и распознавание газов
Цель: получит экспериментально некоторые газы. Оборудование: гранулы цинка, соляная кислота, раствор пероксида водорода, оксид марганца, кусок мрамора, раствор уксусной кислоты, раствор известковой воды, раствор хлорида аммония, лакмусовая бумажка, спиртовка, пробирки, шпатель, стеклянная трубочка.
Ход работы:
Получение, собирание и распознавание водорода
В пробирку поместите две гранулы цинка и прилейте в нее 1-2 мл соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1—2 ми нуты поднимите большую пробирку вверх и, не перевора чивая ее, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую пробирку?
2. Получение, собирание и распознавание кислорода
В пробирку объемом 20 мл прилейте 5—7 мл раствора пероксида водорода. Подготовьте тлеющую лучинку (подожги те ее и, когда она загорится, взмахами руки погасите). Под несите к пробирке с пероксидом водорода, куда предварительно насыпьте немного (на кончике шпателя) оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции.
3. Получение, собирание и распознавание углекислого газа
В пробирку объемом 20 мл поместите кусочек мрамора и прилейте раствор уксусной кислоты. Что наблюдаете? Через 1—2 минуты внесите в верхнюю часть пробирки горящую лучинку. Что наблюдаете? Запиши те уравнение реакции в молекулярной и ионной формах.
В пробирку налейте 1—2 мл прозрачного раствора известковой воды. Используя чистую стеклянную трубочку, осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение ре акции в молекулярной и ионной формах.
4. Получение, собирание и распознавание аммиака
В пробирку прилейте 1—2 мл раствора хлорида аммония, а затем такой же объем раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах.
Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете? Осторожно понюхайте выделяющийся газ. Что ощущаете?
Практическая работа
Решение экспериментальных задач по неорганической химии
Цель работы: продемонстрировать знание характерных свойств некоторых из изученных веществ и умение распознавать эти вещества с помощью качественных реакций.
Оборудование и реактивы: штатив с пробирками, вода, растворы гидроксида натрия, соляной кислоты, серной кислоты, хлорида бария, нитрата серебра, сульфата калия, пробирки № 1, 2, 3 с растворами хлорида аммония, сульфата калия, хлорида меди (II), пробирки № 1, 2, 3 с растворами карбоната натрия, сульфата аммония, хлорида калия.
Экспериментальная задача I. Уровень I
Используя только алюминий, серную кислоту и гидроксид натрия, проведите не менее трех химических реакций.
Берем сухую чистую пробирку.
Наливаем в нее 2 мл щелочи гидроксида натрия NaOH.
ТБ: со щелочью обращаемся аккуратно!
Добавляем несколько капель фенолфталеина.
Наблюдаем образование малиновой окраски индикатора.
Приливаем в пробирку 2 мл серной кислоты H2SO4.
Наблюдаем обесцвечивание фенолфталеина.
Делаем вывод: при взаимодействии щелочи с кислотой происходит реакция нейтрализации, о чем свидетельствует изменение окраски индикатора вследствие смены среды раствора.
Берем сухую чистую пробирку.
Помещаем в нее гранулу алюминия Al.
Приливаем разбавленный раствор серной кислоты H2SO4.
Наблюдаем выделение газа в виде пузырьков.
Делаем вывод: алюминий реагирует с кислотой, признаком чего является выделение газа.
Берем сухую чистую пробирку.
Помещаем в нее гранулу алюминия.
Приливаем в пробирку раствор щелочи гидроксида натрия NaOH.
ТБ: со щелочью обращаемся аккуратно!
Наблюдаем выделение газа в виде пузырьков.
Делаем вывод: алюминий реагирует с раствором гидроксида натрия, признаком чего является выделение газа.
Приводим рабочее место в порядок.
| Тема: Решение экспериментальных задач по неорганической химии |
| Исполнитель | Экспериментальная задача I | Комментатор |
|
| Берем сухую чистую пробирку. |
|
|
| Наливаем в нее 2 мл щелочи гидроксида натрия NaOH. |
|
|
| ТБ: со щелочью обращаемся аккуратно! |
|
|
| Добавляем несколько капель фенолфталеина. |
|
|
| Наблюдаем образование малиновой окраски индикатора. |
|
|
| Приливаем в пробирку 2 мл разбавленной серной кислоты H2SO4. |
|
|
| Наблюдаем обесцвечивание фенолфталеина. |
|
|
| Делаем вывод: при взаимодействии щелочи с кислотой происходит реакция нейтрализации, о чем свидетельствует изменение окраски индикатора вследствие смены среды раствора. |
|
|
| Берем сухую чистую пробирку. |
|
|
| Помещаем в нее гранулу алюминия Al. |
|
|
| Приливаем раствор серной кислоты H2SO4. |
|
|
| Наблюдаем выделение газа в виде пузырьков. |
|
|
| Делаем вывод: алюминий реагирует с кислотой, признаком чего является выделение газа. |
|
|
| Берем сухую чистую пробирку. |
|
|
| Помещаем в нее гранулу алюминия. |
|
|
| Приливаем в пробирку раствор щелочи гидроксида натрия NaOH. |
|
|
| ТБ: со щелочью обращаемся аккуратно! |
|
|
| Наблюдаем выделение газа в виде пузырьков. |
|
|
| Делаем вывод: алюминий реагирует с раствором гидроксида натрия, признаком чего является выделение газа. |
|
|
| Приводим рабочее место в порядок. |
|
Экспериментальная задача II. Уровень I
Определите, в какой из пронумерованных пробирок находится каждое из перечисленных веществ: хлорид алюминия, сульфат калия, хлорид меди (II).
Во все три пронумерованные пробирки приливаем 1 мл щелочи гидроксида натрия NaOH.
ТБ: со щелочью обращаемся аккуратно!
В одной из пробирок выпадает осадок белого цвета гидроксида алюминия Al(OH)3.
Делаем вывод: в данной пробирке находился хлорид алюминия.
В другой пробирке выпадает осадок сине-голубого цвета гидроксида меди (II) Cu(OH)2.
Делаем вывод: в данной пробирке находился хлорид меди (II).
В оставшейся пробирке никаких визуальных изменений не происходит – в ней сульфат калия, дающий со щелочью в качестве продуктов реакции растворимую в воде серную кислоту H2SO4 и растворимое основание гидроксид калия KOH.
Докажем это, прилив в пробирку 1-2 мл раствора хлорида бария BaCl2.
Наблюдаем выпадение осадка белого цвета сульфата бария BaSO4.
Делаем вывод: в данной пробирке был сульфат калия.
Приводим рабочее место в порядок.
| Тема: Решение экспериментальных задач по неорганической химии |
| Исполнитель | Экспериментальная задача II | Комментатор |
|
| Во все три пронумерованные пробирки приливаем 1 мл щелочи гидроксида натрия NaOH. |
|
|
| ТБ: со щелочью обращаемся аккуратно! |
|
|
| В одной из пробирок выпадает осадок белого цвета гидроксида алюминия Al(OH)3. |
|
|
| Делаем вывод: в данной пробирке находился хлорид алюминия. |
|
|
| В другой пробирке выпадает осадок сине-голубого цвета гидроксида меди (II) Cu(OH)2. |
|
|
| Делаем вывод: в данной пробирке находился хлорид меди (II). |
|
|
| В оставшейся пробирке никаких визуальных изменений не происходит – в ней сульфат калия, дающий со щелочью в качестве продуктов реакции растворимую в воде серную кислоту H2SO4 и растворимое основание гидроксид калия KOH. |
|
|
| Докажем это, прилив в пробирку 1-2 мл раствора хлорида бария BaCl2. |
|
|
| Наблюдаем выпадение осадка белого цвета сульфата бария BaSO4. |
|
|
| Делаем вывод: в данной пробирке был сульфат калия. |
|
|
| Приводим рабочее место в порядок. |
|
Практическая работа
Тема: Идентификация органических соединений.
Цель работы: применение знаний о качественных реакциях важнейших классов органических соединений для их распознавания.
Оборудование и реактивы: газовая горелка,
водный раствор NaOH,
серная кислота разбавленная,
водный раствор Na2CO3 ,
водный раствор перманганата калия,
бромная вода,
водный раствор сульфата меди,
аммиачный раствор оксида серебра,
вода
Порядок выполнения работы:
В двух пробирках содержатся следующие вещества:
1) бензойная кислота , анилин
2) глюкоза , бензойная кислота
3) формалин , этиловый спирт
4) глюкоза , сахароза
5) уксусная кислота , этиловый спирт
6) глюкоза, глицерин
С помощью минимального числа реагентов (указанных в начале работы) определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих рекций.
Идентификация органических соединений.
| Вещества | Реагенты | Результаты реакций |
| алканы, циклоалканы | бромная вода, перманганат калия | не обесцвечивает |
| алкены | бромная вода, перманганат калия | обесцвечивает |
| алкины | бромная вода, перманганат калия | обесцвечивает |
| бензол | бромная вода, перманганат калия | обесцвечивает бромную воду, не обесцвечивает перманганат калия |
| одноатомные спирты | щелочные металлы | выделение водорода |
| многоатомные спирты | гидроксид меди | растворение осадка |
| фенолы | хлорид железа | комплекс фиолетового цвета |
| альдегиды | Аммиачный раствор оксида серебра | выделение серебра
|
| карбоновые кислоты | лакмус | красный цвет |
| глюкоза | гидроксид меди | растворение осадка |
| фруктоза | аммиачный раствор оксида серебра | не вступает в реакцию |
| белки | азотная кислота | желтое окрашивание |
ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Распознавание пластмасс и волокон»
Цель работы: применение знаний о составе, физических и химических свойствах важнейших пластмасс и волокон для их распознавания.
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит сине ватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пла менем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до чер ного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Содержание работы:
Цвет, внешний вид.
Горит или нет. Характер горения. Запах.
Запишите формулы исходных веществ и формулы полимеров образцов (с. 25 – 36. Рудзитис Г.Е. Химия 11 класс). К какому классу относятся данные образцы волокон (с. 34, схема 1).
Практическая работа
Тема: Зависимость скорости реакции от различных факторов.
Цель работы - изучение скорости химической реакции и ее зависимости от различных факторов: концентрации, температуры, катализатора. Изучение влияния концентраций веществ на химическое равновесие и его смещение.
ОПЫТ 1. Влияние концентрации реагирующих веществ на скорость химической реакции.
О скорости реакции можно судить по скорости изменения какого-либо свойства системы, например, окраски, электропроводности, давления, спектра и т.д.
В предлагаемом опыте, преследующем цель убедиться в справедливости закона действия масс, измеряется не скорость реакции, а промежутки времени между началом реакции и видимым результатом ее. Однако этот промежуток времени связан определенным соотношением со скоростью реакции: чем больше скорость, тем меньше промежуток времени.
В основу опыта положено взаимодействие тиосульфата натрия с серной кислотой. Процесс этот, протекая многостадийно (см. выше), приводит к слабой опалесценции и дальнейшему помутнению раствора от выпавшей свободной серы:
Na2S2O3 + H2SO4 = Na2SO4+H2O+SO2+S¯
Ваша задача – зафиксировать время слабого помутнения раствора в трех вариантах, в каждом из которых реагирует равное количество серной кислоты с одним и тем же количеством тиосульфата натрия, при различных начальных концентрациях тиосульфата натрия.
Выполнение опыта. Приготовить три раствора тиосульфата натрия различной концентрации. Для этого в три сухие пробирки внести: в первую – 5 капель 1н раствора тиосульфата натрия и 10 капель воды, во вторую – 10 капель 1н раствора тиосульфата натрия и 5 капель воды, в третью - 15 капель 1н раствора тиосульфата натрия без воды.
Таблица 1: Влияние концентрации на скорость химической реакции.
| № пробирки (наблюдения)
| Число капель раствора Na2S2O3 | Число капель Н2О | Общий объем раствора (число капель) | Концентрация Na2S2O3, (условная) | Время течения реакции по секундомеру, t (с) | Скорость реакции v = 1/t, (усл. ед)
|
| 1 | 5 | 10 | 15 | 1С |
|
|
| 2 | 10 | 5 | 15 | 2С |
|
|
| 3 | 15 | 0 | 15 | 3С |
|
|
Таким образом, начальная концентрация Na2S2O3 будет: в пробирке №1– 1С в пробирке №2 – 2С, в пробирке №3 – 3С.
Включить секундомер. В пробирку №1 добавить одну каплю 2н раствора серной кислоты. По секундомеру измерить время от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавить по одной капле 2н серной кислоты в пробирки №2 и №3, отмечая время до появления в растворе опалесценции.
Данные опыта занести в таблицу 1. Рассчитать относительную скорость реакции 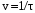 и вписать ее значения в таблицу. Оформить результаты наблюдений в виде графика, откладывая на оси абсцисс концентрацию тиосульфата натрия в виде равномерно стоящих от начала координат трех точек, на оси ординат – относительную скорость. Сделать вывод о характере этой зависимости, а также о том, почему зависимость должна выражаться прямой линией и почему в качестве первой точки этой прямой правомерно использовать точку начала координат.
и вписать ее значения в таблицу. Оформить результаты наблюдений в виде графика, откладывая на оси абсцисс концентрацию тиосульфата натрия в виде равномерно стоящих от начала координат трех точек, на оси ординат – относительную скорость. Сделать вывод о характере этой зависимости, а также о том, почему зависимость должна выражаться прямой линией и почему в качестве первой точки этой прямой правомерно использовать точку начала координат.
ОПЫТ 2. Влияние температуры на скорость химической реакции.
В основе опыта лежит та же реакция, что и в опыте 1:
Na2S2O3 + Н2SO4 = Na2SO4+ Н2О+ SO2+S¯
Ваша задача – зафиксировать время появления опалесценции раствора при различных температурах, но одинаковых концентрациях реагирующих веществ.
Выполнение опыта. Налить в стаканы на 1/2 высоты воду: в первый стакан – водопроводную, во второй – смесь водопроводной и горячей (температура должна быть на 10оС выше, чем в первом стакане), в третий – горячую (температура на 10о выше, чем во втором стакане).
В три пробирки набрать по 10 капель 1н раствора тиосульфата натрия и опустить по одной в стаканы.
Замерить температуру в стаканах. Не вынимая пробирку с тиосульфатом, добавить в нее 1 каплю 2н серной кислоты и измерить время по секундомеру от момента добавления кислоты до появления легкой опалесценции. Повторить опыты с раствором тиосульфата и серной кислотой при двух других температурах. Произвести отсчет времени реакции по секундомеру, как и в первом случае. Результаты наблюдений внести в таблицу 2.
Таблица№2: Влияние температуры на скорость реакции.
| № наблюдения | Температура опыта, оС | Время течения реакции по секундомеру, t (с) | Скорость реакции 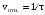 , ,
(усл. ед) |
| 1 |
|
|
|
| 2 |
|
|
|
| 3 |
|
|
|
Оформить результаты наблюдений в виде графика, откладывая на оси абсцисс температуру, а на оси ординат – относительную скорость реакции. Сделать вывод о влиянии температуры на скорость реакции, отметив, почему графическая зависимость от температуры не может выражаться прямой линией. Используя уравнение Вант-Гоффа, установить форму линии и ответить, почему нельзя начинать эту линию от начала координат.
ОПЫТ 3. Влияние катализатора на скорость химической реакции.
Изучить влияние катализатора на скорость реакции можно на примере восстановления перманганата калия. Процесс протекает при комнатной температуре медленно. Ускоряют эту реакцию ионы марганца (II).
Выполнение опыта. В две пробирки поместить несколько капель раствора KMnO4, 1М раствора щавелевой кислоты и серной кислоты. В одну из них бросить кристаллик MnSO4. Через некоторое время отметить изменение окраски растворов в пробирке. Сделать вывод о роли MnSO4. Написать уравнение реакции.
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O
ОПЫТ 4.Смещение химического равновесия при изменении концентрации веществ.
Обратимая реакция между хлоридом железа (III) и роданидом калия или роданидом аммония протекает по уравнению:
FeCl3 + 3KCNS ⇄ Fe(CNS)3 + 3KCl
Образующийся в результате реакции роданид железа (III) имеет темно-красный цвет. По изменению интенсивности окраски можно судить об изменении концентрации Fe(CNS)3, т.е. о смещении равновесия в ту или иную сторону.
Выполнение опыта. В одну пробирку налить примерно 10 мл 0,0025 н раствора хлорида железа (III) и добавить такое же количество 0,0025 н раствора роданида калия или аммония. Раствор размешать стеклянной палочкой и содержимое разлить в 4 пробирки. Одну из пробирок оставить в качестве контрольной (для сравнения). Внести в первую пробирку концентрированный раствор хлорида железа, во вторую – несколько капель насыщенного раствора роданида калия, в третью – немного твердого хлорида калия. Осторожно перемешайте растворы в пробирках и сопоставьте интенсивности окраски полученных растворов с цветом исходного раствора в контрольной пробирке.
Составить уравнение реакции. Написать выражение для константы равновесия. Результаты наблюдений занесите в таблицу 3.
Таблица 3
Влияние концентрации веществ на смещение равновесия
| № пробирки | Добавляемое вещество | Изменение интенсивности окраски (ослабление, усиление) | Направление смещения равновесия (вправо, влево)
|
| 1 | FeCl3 |
|
|
| 2 | KCNS |
|
|
| 3 | KCl |
|
|
Практическая работа
Тема: Определение PH раствора солей
Цель работы:Изучить методы расчета рН растворов электролитов.
Освоить методы определения рН растворов.
а) Определение реакции среды с помощью растворов индикаторов.
В отдельные пробирки поместите разбавленные растворы хлороводородной кислоты, гидроксида натрия, карбоната натрия, хлорида алюминия. Испытайте реакцию среды в этих растворах сначала с помощью раствора индикатора фенолфталеина, а затем и индикатора метилоранжа. По окраске индикаторов определите реакцию среды в исследуемых растворах.
Чем вызвано нарушение ионного равновесия воды в растворах карбоната натрия и хлорида алюминия? Напишите уравнения реакций гидролиза этих солей в молекулярной и ионно-молекулярной формах.
б) Определение реакции среды с помощью универсальной индикаторной бумаги.
По капле испытуемых растворов нанесите так же на отдельные полоски универсальной индикаторной бумаги и, по прилагаемой на упаковке индикаторной бумаги цветной шкале, определите величину рН среды.
Результаты испытаний оформите в виде таблицы:
Определение реакции среды и величины водородного показателя среды некоторых растворов
колориметрическим методом.
| Испытуемый раствор | Окраска индикатора |
Реакция среды
| Величина pH по универсальной индикаторной бумаге |
| фенол-фталеин | Метил-оранж |
| Хлороводородная кислота Гидроксид натрия Карбонат натрия Хлорид алюминия |
|
|
|
|
Практическая работа
Тема: «Качественные реакции на многоатомные спирты»
Цель:
-провести экспериментально качественные реакции на многоатомные спирты;
--закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: пробирки, растворы
Опыт 1. Качественная реакция на многоатомные спирты
В пробирку налейте около 1 мл 10%-ного раствора сульфата мели (II) и добавьте немного 10% раствора гидроксида натрия до образования голубого осадка гидроксида меди (II).
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
Задание
Какая реакция лежит в основе получения голубого осадка гидроксида меди (II)? Напишите уравнение этой реакции.
Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
Практическая работа
Тема: Химические свойства уксусной кислоты.
Цель работы:
-провести экспериментально обменные реакции с уксусной кислотой:
--закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: пробирки, этанол, растворы уксусной кислоты, лакмус, гидроксида натрия, фенолфталеина; стружки магния, гранулы цинка, порошок меди и оксид кальция, кусочек пемзы, водяная баня, газовая горелка.
Опыт 1. Электролитическая диссоциация уксусной кислоты.
В пробирку с раствором уксусной кислоты добавить 3-5 капель раствора индикатора лакмуса. Наблюдать изменение окраски индикатора.
Задание Составить уравнение электролитической диссоциации раствора уксусной кислоты.
Опыт 2. Взаимодействие раствора уксусной кислоты
с некоторыми металлами.
В три пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, в другую – несколько гранул цинка, в третью – порошок меди. В первой пробирке происходит бурная реакция, во второй – реакция протекает спокойно (иногда начинается только при нагревании), а в третьей пробирке реакция не идет.
Задание
1.Какие металлы будут реагировать с уксусной? А какие нет? Сделайте общий вывод об условиях протекания реакций с металлами как органических.
2.Напишите уравнения реакций в молекулярном, ионном и сокращенно-ионном виде и назовите вещества по систематической номенклатуре
Опыт 3. Взаимодействие раствора уксусной кислоты
с оксидами металлов.
Внесите немного на дно пробирки сухого порошка оксида кальция и добавьте 3 мл раствора уксусной кислоты. Наблюдается растворение оксида кальция, при небольшом нагревании скорость реакции увеличивается. Почему?
Задание
Напишите уравнения реакций в молекулярном, ионном и сокращенно-ионном виде и назовите все вещества по систематической номенклатуре.
Опыт 4. Взаимодействие раствора уксусной кислоты с основанием.
Влейте в пробирку 2 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты происходит обесцвечивание.
Задание
Напишите уравнения реакций в молекулярном, ионном и сокращенно-ионном виде и назовите все вещества по систематической номенклатуре
Опыт 5. Взаимодействие уксусной кислоты с солью.
В пробирку налейте 1 мл уксусной кислоты и насыпьте немного гидрокарбоната натрия. Наблюдается выделение газа.
Задание
Напишите уравнения реакций в молекулярном, ионном и сокращенно-ионном виде и назовите все вещества по систематической номенклатуре.
Практическая работа
«Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель работы: изучить химические свойства основных классов неорганических соединений.
Реактивы и оборудование: штатив с пробирками, держатель для пробирок, спиртовка, спички, растворы индикаторов (фенолфталеин, метилоранж), растворы NaOH, H2SO4, CuSO4, гранулы цинка.
Оформление работы
Результаты выполнения работы записывают в таблицу:
| № | Что делали | Что наблюдали | Выводы |
|
|
|
|
|
Ход работы
Опыт 1. Действие индикаторов на растворы кислот и щелочей
В пробирку налейте 1 мл раствора гидроксида натрия NaOH, добавьте 2-3 капли раствора индикатора фенолфталеина. Как изменился цвет раствора?
В пробирку налейте 1 мл раствора серной кислоты H2SO4, добавьте 2-3 капли раствора индикатора метилоранжа. Как изменился цвет раствора?
В пробирку налейте 1 мл воды H2O, добавьте 2-3 капли раствора индикатора метилоранжа. Как изменился цвет индикатора?
Опыт 2. Реакция нейтрализации
В пробирку налейте 1 мл раствора серной кислоты H2SO4, добавьте 2-3 капли индикатора фенолфталеина, затем прилейте 1 мл раствора гидроксида натрия NaOH.
Запишите уравнение реакции. Сделайте вывод, какие вещества образуются при взаимодействии кислоты и щелочи.
Опыт 3. Получение сульфата цинка
В пробирку с гранулой цинка добавьте 1 мл раствора серной кислоты H2SO4. Что происходит в пробирке?
Запишите уравнение реакции. Сделайте вывод, какой газ можно получить взаимодействием кислоты и активного металла.
Опыт 4. Получение и свойства гидроксида меди (II)
а) В пробирку налейте 1 мл раствора сульфата меди (II) CuSO4, добавьте 1 мл раствора гидроксида натрия NaOH.
Отметьте цвет и характер выпавшего осадка. Запишите уравнение реакции. Сделайте вывод, взаимодействием каких веществ можно получить нерастворимое в воде основание.
б) Пробирку с полученным гидроксидом меди (II) Cu(OH)2 закрепите в держателе для пробирок, затем нагрейте в пламени спиртовки.
Что произошло с осадком? Запишите уравнение реакции. Сделайте вывод о том, что происходит при нагревании нерастворимых в воде оснований.







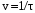 и вписать ее значения в таблицу. Оформить результаты наблюдений в виде графика, откладывая на оси абсцисс концентрацию тиосульфата натрия в виде равномерно стоящих от начала координат трех точек, на оси ординат – относительную скорость. Сделать вывод о характере этой зависимости, а также о том, почему зависимость должна выражаться прямой линией и почему в качестве первой точки этой прямой правомерно использовать точку начала координат.
и вписать ее значения в таблицу. Оформить результаты наблюдений в виде графика, откладывая на оси абсцисс концентрацию тиосульфата натрия в виде равномерно стоящих от начала координат трех точек, на оси ординат – относительную скорость. Сделать вывод о характере этой зависимости, а также о том, почему зависимость должна выражаться прямой линией и почему в качестве первой точки этой прямой правомерно использовать точку начала координат. 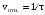 ,
,
















