Периодическая система
химических элементов
Д. И. Менделеева
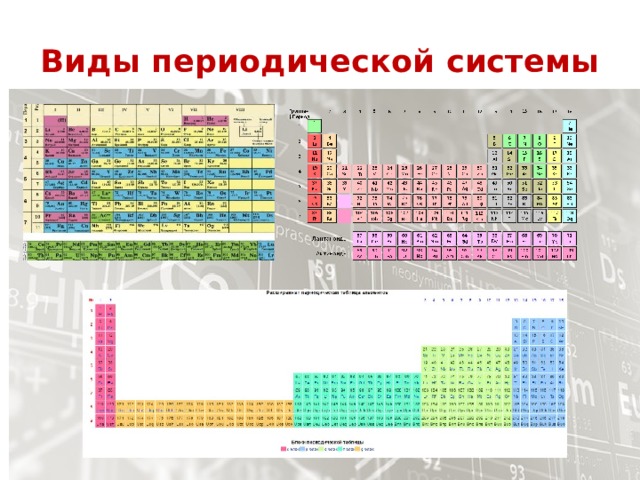
Виды периодической системы

Открытие периодической системы
- Коллеги же Дмитрия Ивановича вспоминали, что великий ученый постоянно работал над таблицей в течение нескольких лет.
- Кстати, Менделеев продолжал корректировать ее и после выхода работы о периодическом законе.
- Кроме того Менделеев не был первым, кто предложил подобную таблицу.
- В 1864 году немецкий ученый Мейер опубликовал свою таблицу, содержавшую 28 элементов, размещенных в шесть столбцов, согласно их валентностям.
- В 1866 году английский химик Джон Ньюлендс сделал попытку связать свойства элементов с их атомным весом, и оформивший свои построения также в виде таблицы
- Но Менделеев об этих работах, как пишут исследователи, не имел информации

Решающий этап его раздумий наступил 1 марта 1869 года (14 февраля по старому стилю)
Менделеев перекладывал карточки (пасьянс из знаков хим.элементов) из одного горизонтального ряда в другой, руководствуясь значениями атомной массы и свойствами простых веществ, образованных атомами одного и того же элемента. В который раз на помощь ему пришло доскональное знание неорганической химии. Постепенно начал вырисовываться облик будущей Периодической системы химических элементов.
Постепенно Дмитрий Иванович пришел к окончательному выводу, что элементы, расположенные по возрастанию их атомных масс, выказывают явную периодичность физических и химических свойств.
Вечером 1 марта 1869 года он набело переписал составленную им таблицу и под названием "Опыт системы элементов, основанной на их атомном весе и химическом сходстве" послал ее в типографию, сделав пометки для наборщиков и поставив дату "17 февраля 1869 года" (это по старому стилю).
Так был открыт Периодический закон...

Таблица Менделеева – путеводная звезда открытия химических элементов и строения атома
В настоящее время ученым удалось расширить число известных элементов с 92 до 118, последние 94 из них были синтезированы в ускорителях, время их жизни составляет миллионные доли секунд, поэтому их химические свойства можно определять только благодаря периодической системе.
Сейчас идет соревнование между лабораториями США, Японии, России и Германии, кто первый откроет новый элемент.
Сейчас пальма первенства целиком принадлежит нашим ученым. Так, в частности, сотрудники лаборатории имени Флерова Объединенного института ядерных исследований в Дубне синтезировали самый на данный момент элемент – 118-й.
В настоящее время ученые рассматривают возможность дальнейшего расширения таблицы Менделеева и получения новых сверхтяжелых элементов и о возможности открытия до 150 элементов. Но это зависит от успехов научного знания

Периодический закон был открыт русским ученым Менделеевым в 1869 году. Он предложил классификацию элементов в виде семейств, в которых периодически повторяются сходные свойства, когда элементы расположены в порядке увеличения атомного веса, опубликовал свою таблицу и дал формулировку нового открытого периодического закона.

Периодическая система позволяет без специальных исследований узнать о свойствах элемента только на основании известных свойств соседних по группе или периоду элементов, а также предсказать некоторые физические свойства простых веществ .

Считается, что появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук – взамен разрозненных сведений об элементах, соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.

Строение таблицы Период
1-3 периоды занимают по 1 строке,
4-ый и последующие периоды занимают по 2 строчки.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды . Они обладают одинаковыми свойствами.

Строение таблицы Группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа .
Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа.

В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Основной принцип системы-периодичность
Закон по Менделееву
Свойства химических элементов, а также их соединений находятся в периодической зависимости от их весов(атомных масс)
Периодическая система –графическое выражение закона

Названия некоторых подгрупп
Элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы
Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.