Справочный материал для подготовки учащихся 9 классов к ОГЭ по теме «Тепловые явления (4)»
Составила учитель физики Горшкова Л.А.
1. Нагревание и охлаждение тел. Количество теплоты. Удельная теплоемкость.
Количество теплоты – это энергия, которую тело теряет или приобретает при теплопередаче.
При остывании тело будет терять (отдавать) некое количество теплоты, а при нагревании поглощать.
Удельная теплоемкость вещества - это величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С).
Расчет количества теплоты:
Q=cm(t2 - t1 ) ,
где Q – количество теплоты,
m – масса тела,
(t2 - t1 ) – разность между начальной и конечной температурами тела,
t1 — начальная температура, t2 — конечная температура.
При нагревании тела t2 t1 и, следовательно, Q 0 (тело получает тепло).
При охлаждении тела t2и t1 и, следовательно, Q (тело отдает тепло).
2.Закон сохранения энергии в тепловых процессах. Уравнение теплового баланса.
Закон сохранения внутренней энергии. При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается неизменной.
При контакте этих тел между ними начнет происходить теплообмен. В процессе теплообмена более горячее тело будет отдавать энергию, а менее нагретое — ее получать. Это будет происходить до тех пор, пока температура тел не станет одинаковой.
Количество теплоты, отданное при теплообмене более горячим телом, будет равно по модулю количеству теплоты, полученному менее горячим телом:
Qпол =|Qотд|.
Это уравнение называют уравнением теплового баланса.
3. Испарение и конденсация. Изменение внутренней энергии в процессе испарения и конденсации. Кипение жидкости. Удельная теплота парообразования.
Парообразование это переход жидкости в газообразное состояние (в пар).
Существует два способа парообразования: испарение и кипение.
Испарение. Молекулы жидкости непрерывно движутся с разными скоростями. Если какая- нибудь достаточно «быстрая» молекула окажется у поверхности жидкости, то она может преодолеть притяжение соседних молекул и вылететь из жидкости. Вылетевшие с поверхности жидкости молекулы образуют над нею пар.
Кипение - это тоже процесс перехода жидкости в пар. Но парообразование при кипении происходит не только на поверхности жидкости, но и по всему её объёму. Причём процесс этот проходит гораздо интенсивнее, чем при испарении.
Поставим на огонь чайник с водой. Так как в воде всегда есть растворённый в ней воздух, то при нагревании на дне чайника и на его стенках появляются пузырьки. Эти пузырьки содержат воздух и насыщенный водяной пар. Сначала они появляются на стенках чайника. Количество пара в них увеличивается, увеличиваются в размерах и они сами. Затем под воздействием выталкивающей силы Архимеда они будут отрываться от стенок, подниматься вверх и лопаться на поверхности воды. Когда температура воды достигнет 100оС, пузырьки будут образовываться уже по всему объёму воды.
Данный процесс сопровождается также выделением энергии.
Испарение происходит при любой температуре, а кипение - только при определённой температуре, которая называется температурой кипения.
Каждое вещество имеет свою температуру кипения.
Конденсация— переход вещества из газообразного состояния (пара) в жидкое.
Удельная теплота парообразования – это физическая величина, которая показывает количество теплоты, нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L.
Единица измерения- Дж/кг.
Если известно, что вещество находится при температуре кипения, то для вычисления количества теплоты, необходимого для превращения его в газообразное состояние используют следующую формулу:
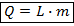
Обозначения:
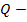 количество теплоты парообразования, Дж;
количество теплоты парообразования, Дж;
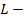 удельная теплота парообразования и конденсации,
удельная теплота парообразования и конденсации,  ;
;
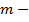 масса вещества, кг.
масса вещества, кг.
4. Плавление и кристаллизация. Изменение внутренней энергии в процессе плавления и кристаллизации. Удельная теплота плавления.
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристаллизацией. Температура, при которой вещество кристаллизуется, называется температурой кристаллизации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.
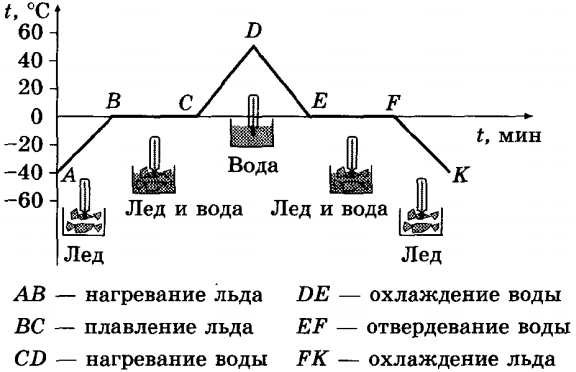
При плавлении кристаллического вещества происходит поглощение энергии, при кристаллизации происходит выделение энергии в окружающую среду.
Удельная теплота плавления — физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1кг, чтобы при температуре плавления полностью перевести его в жидкое состояние.
Для вычисления количества теплоты, необходимого для плавления вещества, используется формула:
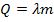 , где:
, где:
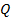 – количество теплоты (Дж);
– количество теплоты (Дж);
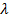 – удельная теплота плавления;
– удельная теплота плавления;
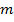 – масса вещества
– масса вещества
5.Влажность воздуха.
Влажность воздуха — содержание водяного пара в воздухе, характеризуемое рядом величин (абсолютная влажность, относительная влажность).
Определение относительной влажности воздуха с помощью термометра.
Психрометр состоит из двух термометров. Сухой термометр показывает температуру окружающего воздуха; второй термометр обёрнут тканью, конец которой опущен в сосуд с водой. Вследствие испарения влаги с поверхности ткани температура последнего понижается.
1.Определить показания сухого термометра.
2. определить показания влажного термометра.
3.Найти разность показаний сухого и влажного термометров.
4.Используя психрометрическую таблицу определить относительную влажность воздуха φ.
6. Тепловые машины. Преобразование энергии в тепловых машинах.
Тепловая машина (тепловой двигатель) - устройство для преобразования внутренней энергии в механическую.
Виды тепловых двигателей: паровая машина, двигатель внутреннего сгорания (ДВС), паровая и газовая турбины, реактивный двигатель.
7.Внутренняя энергия сгорания топлива. Удельная теплота сгорания топлива.
В природе существует много горючих веществ, которые при сгорании выделяют тепло. Это дрова, уголь, нефть, спирт, газ и т.д.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива.
Удельная теплота сгорания обозначается буквой q.
Единицей удельной теплоты сгорания является 1 Дж / кг.
Расчетная формула для количества теплоты, выделившейся при полном сгорании топлива:
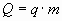 ;
;
где Q - количество выделившейся теплоты ( Дж ),
q - удельная теплота сгорания ( Дж/кг ),
m - масса сгоревшего топлива ( кг ).

























