Учитель химии Магкеева А.К.
Тема: Строение атома.
Цели:
дать понятие о составе атома и составе атомного ядра; раскрыть взаимосвязь понятий: протон, нейтрон, массовое число, электрон.
Задачи:
Обучающие: формирование целостности представления об атоме.
Развивающие: способствовать развитию знаний об атоме, пробудить у учащихся интерес к изучению предпосылок открытия конкретных явлений; продолжить развитие мышления, умение анализировать, сравнивать, делать логические выводы.
Воспитательные: развитие навыков коллективной работы; развитие навыков культуры общения, толерантного отношения друг к другу; умение излагать свою точку зрения и отстаивать свою правоту.
Тип урока: урок изучения нового материала.
План урока:
1.Представления о строении атома.
2. Доказательства сложной структуры атома.
3. Строение атома.
4. Ядерные реакции.
5. Изотопы.
6. Корпускулярно-волновой дуализм.
Ход урока:
I. Орг. момент.
II. Изучение нового материала:
Развитие представлений о строении атома.
Просмотр видеоролика Химия. 8 класс, 2014. Строение атома Модели строения атома. Центр онлайн-обучения Фоксфорд.
Понятие атом (греч. «atomos» – неделимый) ввел Демокрит. У Демокрита атомы выступают в роли первоначала. Они неделимы, различаются по величине, весу, форме и находятся в вечном движении. После Демокрита учение об атомах было на много веков забыто. Возродил атомистическую теорию английский физик и химик Джон Дальтон. Он основывался на открытых в то время законах химии и экспериментальных данных о строении вещества. Таким образом, установил, что атомы одного элемента имеют одинаковые свойства, а разных элементов – различаются по свойствам. Дальтон ввел важную характеристику атома – атомную массу и для очень многих элементов были установлены ее относительные значения. В своем атомно-молекулярном учении Дальтон дает характеристику атому: «Атом неделим, вечен и неразрушим».

Атом делим, как доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала 20 века.
В 1897 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке, содержащей катод и анод. Английский физик Джозеф Томпсон назвал частицы катодных лучей электронами.
Русский ученый Столетов открыл явление фотоэффекта – испускания металлом электронов под действием падающего на него света.
Значимым стало открытие Рентгеном «Х»-лучей, позже названных рентгеновскими в честь ученого. Эти лучи представляют собой электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
Большой вклад в развитие представлений об элементарных частицах внесли французский физик Антуан Анри Беккерель и супруги Кюри, открыв явление радиоактивности. Радиоактивность – это явление самопроизвольного превращения одного химического элемента в другой, сопровождаемое испусканием электронов или других частиц и рентгеновского излучения.
Эти экспериментальные данные свидетельствуют о том, что атом – сложноустроенная система.
Модели атома.
Одной из первых моделей строения атома явилась модель английского физика Джозефа Томсона, предложенная им в в1904 г. – так называемый «пудинг с изюмом»: атом представляет собой сферу положительного электричества с вкрапленными электронами.
Для проверки этой модели в 1899-1911 гг. английский физик Эрнест Резерфорд провел опытные исследования и сформулировал планетарную (ядерную) теорию строения атома. Согласно этой модели, в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100’000 раз меньше размеров самого атома. В ядре сосредоточена практически вся масса атома. Оно имеет положительный заряд. Вокруг ядра движутся электроны, заряженные отрицательно. Их число определяется зарядом ядра.
Однако такая модель имела свои недостатки:
1. Резерфорд не смог объяснить устойчивости атома. Двигаясь вокруг ядра, электрон расходует энергию и в какой-то момент, израсходовав ее всю, он должен остановиться – упасть на ядро, что равносильно гибели атома. Но на самом деле атомы – структуры довольно стабильные.
2. Резерфорд не смог объяснить линейный характер атомных спектров. Согласно его модели, электрон должен излучать энергию постоянно и поэтому атомный спектр должен быть сплошным, но экспериментальные данные доказывали обратное: спектр не сплошной, а прерывистый. Это означает, что электрон излучает энергию порциями.
Свою теорию строения атома, основанную на планетарной модели и квантовой теории, в 1913 году предложил датский физик Нильс Бор. Основные положения он сформулировал в виде постулатов:
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
Но и эта модель не явилась совершенством, в ней также присутствовали противоречия. «Спасти» теорию Бора пытались многие ученые.
В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель строения атома существует до сих пор, сочетает в себе все предыдущие модели и «исправляет» их недостатки. Суть теории в том, что атомное ядро состоит из протонов и нейтронов. В совокупности они называются нуклоны. Число протонов в ядре («+» заряд) характеризует его заряд. Количество электронов («-» заряд), движущихся вокруг ядра, соответствует количеству протонов в нем. Электроны движутся по определенным атомным орбиталям, которые могут существовать в различных формах. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
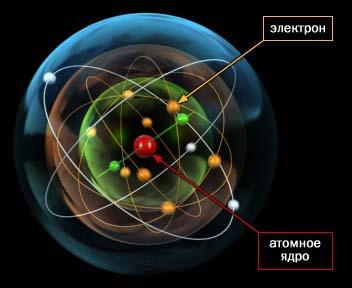
Электроны, протоны и нейтроны называют элементарными частицами.
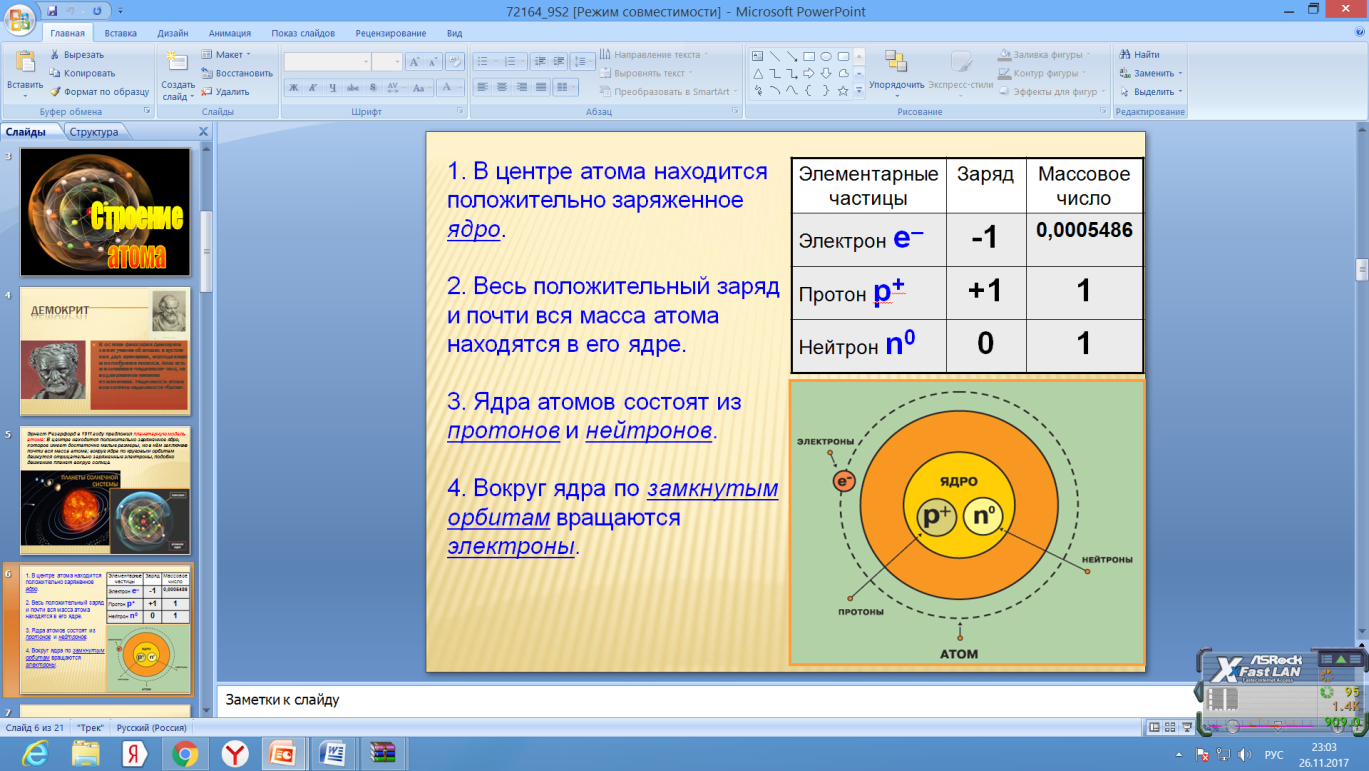
В ядре можно изменить:
А) число протонов в ядре, т.е. заряд атома →образуется новый элемент
Б) число нейтронов в ядре, т.е. заряд атома не измениться→новый элемент не образуется.
Рассмотрим данные случаи подробно.
А). При изменении числа протонов в ядре из исходного эл-та образуются совсем др. хим. эл-ты. Такие процессы называются ядерными.
Ядерные реакции – это процессы превращения атомов одних элементов в другие.
14N + 4He →17O +1 H - 1919г Э.Резерфорд.
226Ra →222 Rn + ….. 14 С →…..+ 0β (ē)
14N +1 n →1 p + ….. 56 Fe + 1 n → 1 p + …..
Для осуществления яд. Реакций широко применяются ускорители заряженных частиц – мощные установки, в которых получают пучки частиц с большим значением энергии.
Б). При изменении числа нейтронов в ядре новый элемент не образуется, но новые атомы будут отличаться от исходных своей массой. Это изотопы (гр. Изос- один + топос – место = занимающий одно место) – это разновидности атомов одного элемента с одинаковым зарядом ядра, но разными массовыми числами. Ar, приводимые в ПС = среднее массовое число природных смесей изотопов.
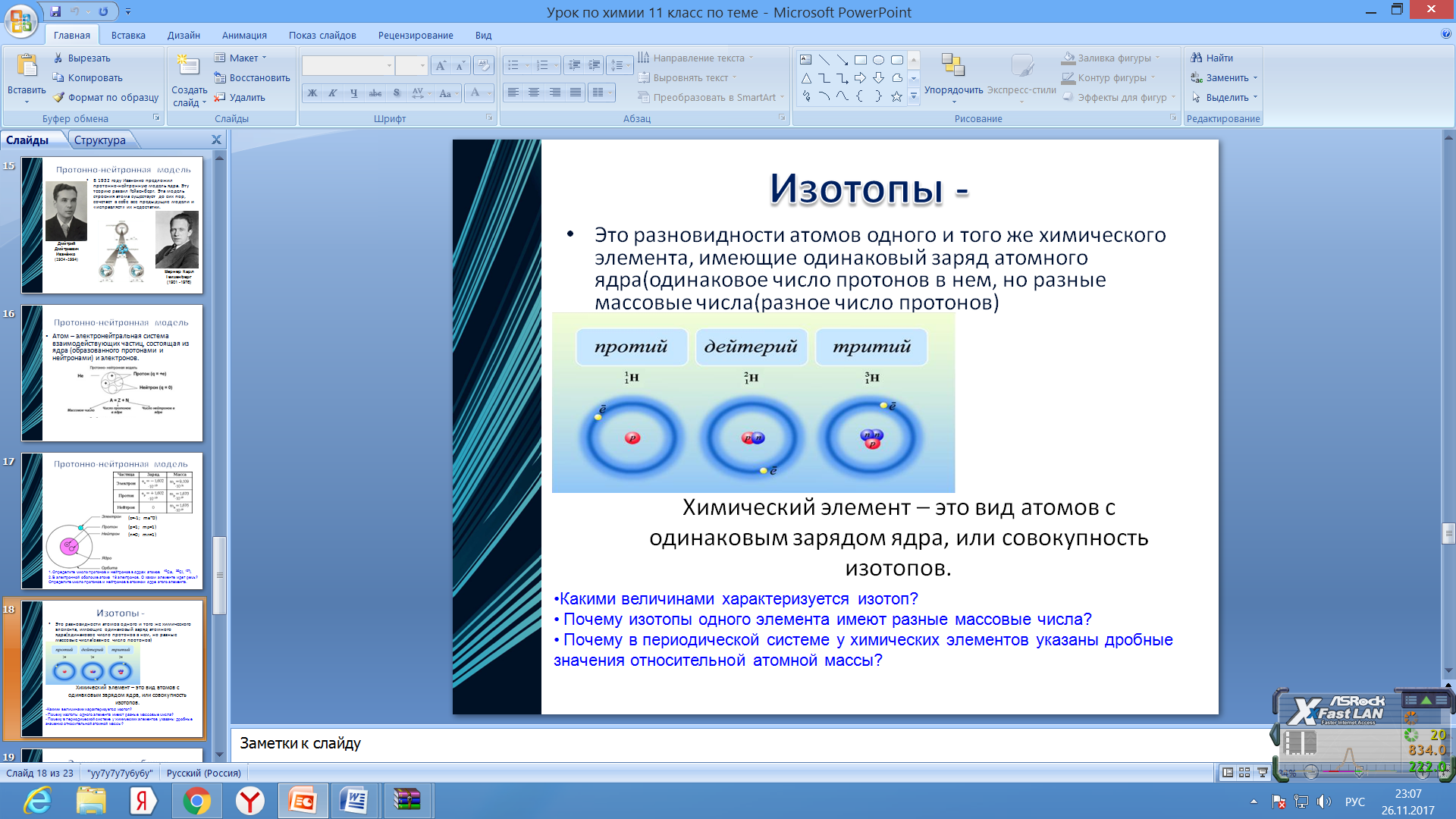
Напр, в природном О2 кроме атомов с массой 16 имеются также атомы с массами 17 и 18. Их соотношение таково: n(16О) : n(17О) : n(18О) = 3000 : 1 : 6.
p=8 p=8 p=8
n=8 n=9 n=10
ē =8 ē =8 ē =8
Оказалось, что и другие элементы состоят из атомов с разной массой: С – 12, 13, 14; Cl-35, 37; Ar – 39, 40; К – 39, 40.
Хим. свойства изотопов совершенно одинаковые (у водорода – нет). Изотопы водорода сильно различаются по свойствам из-за резкого кратного ↑ их Ar. Им даже присвоены индивидуальные названия и знаки:
1Н – протий 1 p, 1 ē, 0 n
2Н = 2 D - дейтерий 1 p, 1 ē, 1 n
3Н = 3Т – тритий 1 p, 1 ē, 2 n
Каковы же свойства элементарных частиц?
Электрон – частица, определяющая наиболее характерные свойства атомов и молекул. Изучение природы и распространения света показало, что он обладает как корпускулярными, так и волновыми свойствами (т.е. объект с двойственной природой – корпускулярно-волновым дуализмом: они являются одновременно и частицами (корпускулами), и волнами). На первые указывает явление фотоэффекта, на вторые – явления интерференции и дифракции света.
Если ē, испускаемые источником, например катодом. Пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают её почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и тёмных колец, т.е. дифракционную картину.
Дифракционная картина включает в себя как собственно дифракцию – огибание волной препятствия, так и интерференцию, т.е.наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, т.к. только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой , ē даёт почернение только в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку.
III.Закрепление материала.
1.Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I.
2.Какими величинами характеризуется изотоп?
2.Почему в периодической системе у химических элементов указаны дробные значения относительной атомной массы?
IV. Рефлексия:
Тема сегодняшнего урока была интересна, все было понятно -
Мне было интересно, но не все было понятно
Было неинтересно, ничего не понятно
V. Д/з : §2
4































