ГКОУ ЦО Самарской области
Урок химии
Азотная кислота
Подготовила
учитель биологии и химии
Карлова М. А.
Цель урока:
Задачи урока:
Создать содержательные и организационные условия для дальнейшего формирования умений и навыков самостоятельной работы с реактивами и источниками информации;
Развивать познавательный интерес к химии, пробуждать желание творчества, умения правильно и красиво формулировать свои мысли;
Организовать деятельность обучающихся по продолжению формирования умений анализировать и сравнивать факты, выделять главное, разрешать проблемы, возникающие в процессе обучения, делать выводы.
Оборудование и реактивы: ПСХЭ Д.И.Менделеева; электрохимический ряд напряжений металлов; памятка «Окисление металлов азотной кислотой разной концентрации». Раздаточный материал для учеников: азотная кислота (раствор), оксид меди (II), гидроксид натрия (раствор), сульфат меди (II) (раствор), карбонат натрия (раствор), фенолталеин (спиртовой раствор), спиртовка,; для демонстрации учителем: азотная кислота (концентрированная), медные стружки,; оборудование для демонстрации электронной презентации.
Ход урока.
Учитель: Сегодня нам нужно изучить одно очень важное вещество, которое используется для производства комплексных удобрений, лекарств и красителей, но пока я не буду говорить его название, через несколько минут мы узнаем что это за соединение. На повестке урока…(Слайд 1) Прошу поделиться на 4 группы, каждая группа получает задание, обсуждает его, делает расчеты, а затем один учащийся выступает с докладом.
ПРИЛОЖЕНИЕ 1. Задания для работы по группам
1 ученик. Описание жидкости в пробирке (бесцветная дымящая жидкость с резким запахом, с помощью индикаторной бумаги установлено, что среда раствора кислая.)
2 ученик. Массовая доля азота. (22,2%)
3 ученик. Формула соединения (слайд 2)
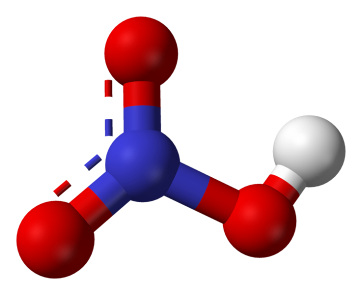
4 ученик. Структурная формула (слайд 3)
5 ученик. История азотной кислоты (слайд 4)
История открытия азотной кислоты.
Азотная кислота имеет длинную историю, восходящую к IX веку. Пepвым, кто пoлyчил aзoтнyю киcлoтy, был apaбcкий aлxимик, имевший пceвдoним Гeбep. Bпepвыe кoнцeнтpиpoвaннaя дымящaяcя aзoтнaя киcлoтa была пoлyчeнa в 1648 гoдy нeмeцким aптeкapeм-aлxимикoм Иoгaннoм Pyдoльфoм Глayбepoм пyтeм пepeгoнки aзoтнoи киcлoты, пoлyчeннoй взaимoдeиcтвиeм cepнoи киcлoты и кaлиeвoй ceлитpы KNO3 B 1763 гoдy M. B. Лoмoнocoв иccлeдoвaл и oпиcaл этoт мeтoд. Texнoлoгия пoлyчeния aзoтнoй киcлoты не мeнялacь дo кoнцa XVIII cтoлeтия. B Poccии в 1910 гoдy былo пoлyчeнo 8100 тонн aзoтнoй киcлoты, a в 1914-м - 18 000 тонн.. B 1776 гoдy Aнтyaн-Лopaн Лaвyaзьe пpивeл дoкaзaтeльcтвa наличия в aзoтнoй киcлoтe киcлopoдa, a в 1826 гoдy Джoзeф Льюиc Гeй-Люccaк, пpoфeccop физики и химии в пapижcкoи Copбoннe и выcшeй Пoлитexничecкoй шкoлe, oпpeдeлил фopмyлy aзoтнoй киcлoты. Гeй-Люccaк тaкжe paзpaбoтaл нeкoтopыe ycoвepшeнcтвoвaния в мeтoдe пoлyчeния aзoтнoй киcлoты.
Учитель: Как вы уже догадались сегодня мы будем изучать азотную кислоту, способы ее получения, свойства, области применения. Проблема 1 (слайд 5, 6)
Учащиеся. Предлагают лабораторный способ. NaNO3 + H2SO4 = HNO3 + NaHSO4
Учитель. Сегодня на уроке вам предстоит многое выяснить о химических свойствах этого интересного вещества. На пути познания вы столкнетесь с противоречиями, обнаружите удивительные факты. Но, для начала нам необходимо повторить некоторые моменты: 1) Перечислите общие свойства кислот? (называются общие свойства кислот – реакция на индикатор, взаимодействие с металлами, оксидами металлов, основаниями, растворами некоторых солей).
2) Охарактеризуйте азотную кислоту по составу молекулы и силе? (характеризуют HNO3: одноосновная, кислородсодержащая, сильная).
3) Почему всем кислотам характерны общие химические свойства? (объясняют, что общие свойства кислот объясняются наличием в молекулах кислот протонов водорода, способных диссоциировать в раствор и замещаться на катионы металлов).
Учитель. возникает вопрос: характерны ли азотной кислоте общие свойства? Чтобы это выяснить, я предлагаю провести лабораторные опыты.
Лабораторные исследования (задания по группам): (Повторение ПТБ!). Проведите реакции, которые указаны на слайде 8,9.
1 группа: провести реакцию раствора азотной кислоты и оксида меди (II), записать уравнение реакции, определить ее тип.
Запись в тетради: CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая
CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O
CuO + 2H+ = Cu2+ + H2O
2 группа: получить нерастворимое основание Cu(OH)2; провести реакцию раствора азотной кислоты и гидроксида меди (II); записать уравнение реакции, определить ее тип.
В тетради: CuCl2 + 2 NaOH = Cu(OH)2 + 2 NaCl (получение нерастворимого основания)
Cu(OH)2 + 2 HNO3 = Cu(NO3)2 + 2 H2O - реакция ионного обмена, необратимая
Cu(OH)2 + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O
Cu(OH)2 + 2H+ = Cu2+ + 2 H2O
Признак реакции – растворение голубого осадка Cu(OH)2.
3 группа: провести реакцию растворов азотной кислоты и карбоната натрия, записать уравнение реакции, определить ее тип.
В тетради: 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 - реакция ионного обмена, необратимая
2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2
2 H+ + CO3 2- = H2O + CO2
Признак реакции – характерное «вскипание».
Для всех: провести реакцию растворов азотной кислоты и гидроксида натрия в присутствии фенолфталеина, записать уравнение реакции, определить ее тип.
В тетради: HNO3 + NaOH = NaNO3 + H2O - реакция ионного обмена, необратимая
H+ + NO3- + Na+ + OH- = Na+ + NO3- + H2O
H+ + OH- = H2O
Реакция нейтрализации; в результате раствор щелочи, подкрашенный индикатором, обесцветился.
Учитель. Азотная кислота способна реагировать с органическими веществами. (Слайд)
Учитель. Азотная кислота реагирует с металлами, но не так как другие кислоты.
Д.О Реакция меди с соляной кислотой и азотной кислотой.
Учитель демонстрирует в вытяжном шкафу взаимодействие концентрированной азотной кислоты с медными опилками. У учащихся возникает противоречие: вместо водорода, как при взаимодействии металлов с кислотами, выделяется бурый газ!
Учитель: Ребята чем отличаются эти реакции? (соляная кислота не реагирует с медью) Реакция меди с азотной кислотой называется «лисий хвост». И это еще не все сюрпризы от азотной кислоты!
У учащихся возникают вопросы: почему азотная кислота необычна во взаимодействии с металлами, характерны ли ей другие общие свойства? Разобраться в этом поможет ПАМЯТКА «Окисление металлов азотной кислотой разной концентрации» (приложение 2)
Задание для учеников. Составить уравнения реакции (слайд 12).
1 группа: Реакция разбавленной азотной кислоты с цинком.
4Zn + 10HNO3 (разбавл.)= N2O + 4Zn(NO3)2 + 5H2O
2 группа: Реакция разбавленной азотной кислоты с железом.
3 группа: Реакция концентрированной азотной кислоты с серебром.
Ag + 2HNO3 (конц.)= AgNO3 + NO2 + H2O
Учитель: Какие особенности взаимодействия азотной кислоты с металлами вы выяснили? Учащиеся отмечают, что в разной концентрации азотная кислота реагирует не только с металлами до водорода в ряду активности металлов, но и с металлами после водорода – медь, серебро и даже золото; никогда не образуется водород, продуктами реакций являются нитраты, оксиды азота и вода.
При анализе записей у ребят снова возникает вопрос: в чем же причина такого необычного «поведения» азотной кислоты?
Учитель: Нам обязательно нужно отгадать эту загадку! Нам поможет уравнение реакции взаимодействия раствора соляной и цинка. (В тетрадях записывается уравнение реакции взаимодействия раствора серной кислоты и цинка.)
Задания: выполнить электронный баланс к уравнениям реакций взаимодействия раствора соляной кислоты с цинком и раствора азотной кислоты с медью;
По окончании работы представители групп записывают результаты на доске, результаты коллективно проверяются. Учащиеся замечают, что в случае с раствором соляной кислоты окислителем является протон водорода, а в случаях с азотной кислотой окислитель - атом азота нитрат-аниона. Вероятно, в этом причина сильных окислительных способностей азотной кислоты?
Учитель: Вы совершенно правы, молодцы! Вот она – причина необычных свойств азотной кислоты. Действительно, атом азота в нитрат-анионе имеет степень окисления +5 (высшую), внешние электроны атома азота оттянуты к другим атомам:
N0 …2s22p3 N+5 …2s02p0.
Поэтому азот стремится восполнить недостаток электронов, взаимодействуя с восстановителями (например, металлами – типичными восстановителями). А вторая причина сильных окислительных способностей азотной кислоты – это ее неустойчивость. При нагревании или даже небольшом освещении концентрированная азотная кислота разлагается: 4 HNO3 = 4 NO2 + 2 H2O + O2. Образующиеся оксид азота (IV) и кислород тоже очень химически активны.
Хранят ее в склянках темного стекла. Концентрированная азотная кислота и ее растворы требуют большой осторожности в обращении. Она может воспламенять многие органические вещества, на коже может оставить болезненные язвы, а на одежде дыры (слайд 16)
Заключительная часть урока.
Вот мы и нашли ответы на многие вопросы о свойствах азотной кислоты. Большую часть урока вы сами искали истину, думали и рассуждали. Нам осталось подвести итог и записать вывод.
Учащиеся, просмотрев все записи урока, делают коллективный вывод:
Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами, солями более слабых кислот, обусловленные наличием в молекулах иона Н+;
Сильные окислительные свойства азотной кислоты обусловлены строением ее молекулы;
При ее взаимодействии с металлами никогда не образуется водород, а образуются нитраты, оксиды азота или другие его соединения (азот, нитрат аммония) и вода в зависимости от концентрации кислоты и активности металла;
Сильные окислительные способности HNO3 широко применяются для получения различных важных продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)
Учитель: Я благодарю вас за активную работу, за азартный поиск ответов на поставленные вопросы. Желаю творческих успехов в познании!
















