Электролитическая диссоциация

Процесс распада электролита на ионы
называется электролитической диссоциацией .
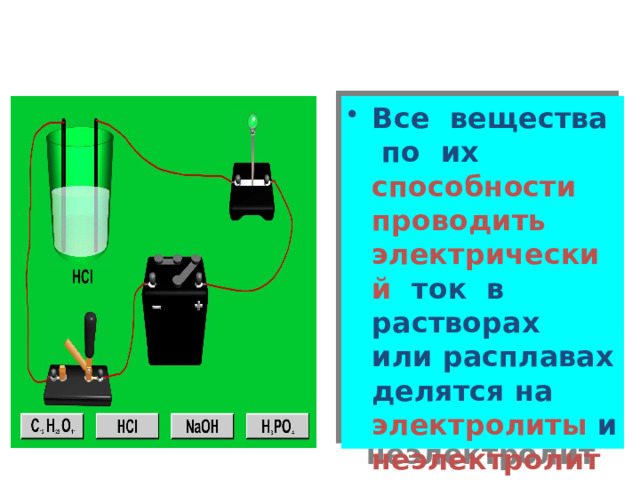
- Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и неэлектролиты .
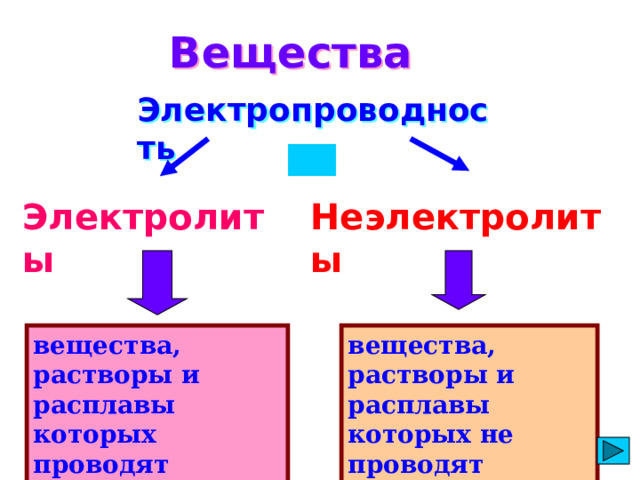
Вещества
Электропроводность
Электролиты
Неэлектролиты
вещества, растворы и расплавы которых проводят электрический ток
вещества, растворы и расплавы которых не проводят электрический ток
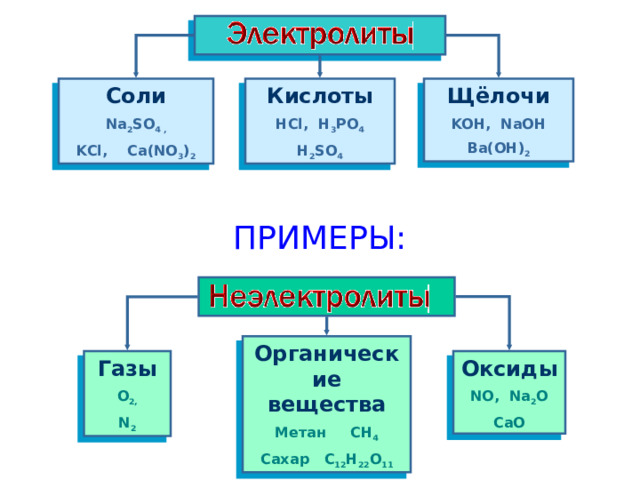
Кислоты
Щёлочи
Cоли
KOH, NaOH
HCl, H 3 PO 4
Na 2 SO 4 ,
H 2 SO 4
Ba(OH) 2
KCl, Ca(NO 3 ) 2
ПРИМЕРЫ:
Органические вещества
Метан CH 4
Сахар C 12 H 22 O 11
Оксиды
Газы
NO, Na 2 O
O 2,
CaO
N 2
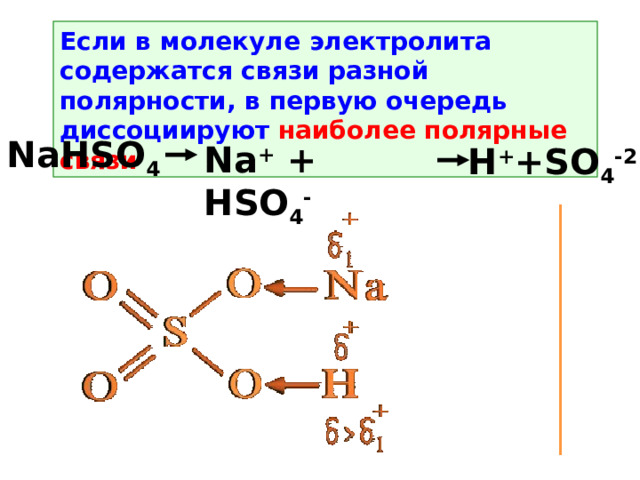
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи
NaHSO 4
Na + + HSO 4 -
H + +SO 4 -2

Электролитическая диссоциация химических элементов
Основные положения теории:
- Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы или из нескольких атомов – сложные ионы.

Электролитическая диссоциация химических элементов
Основные положения теории:
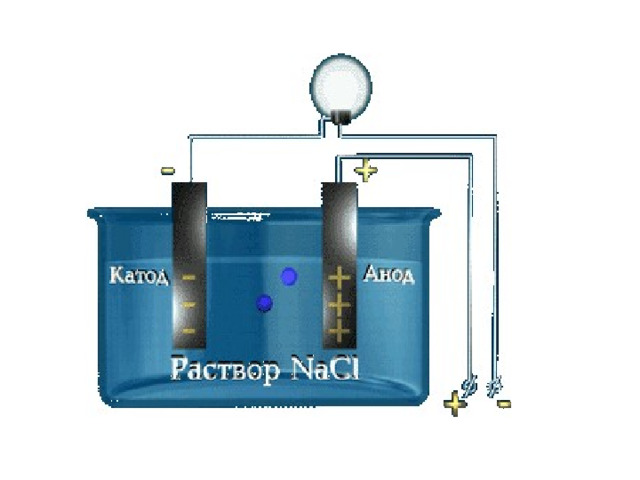
2. При действии электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду.
Поэтому первые называются катионами, а вторые – анионами. Направленное движение ионов происходит в результате притяжения их к противоположено заряженным электродам.
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости .

Количественная характеристика процесса диссоциации
Отношение числа распавшихся молекул к общему числу молекул в растворе
Сила электролита
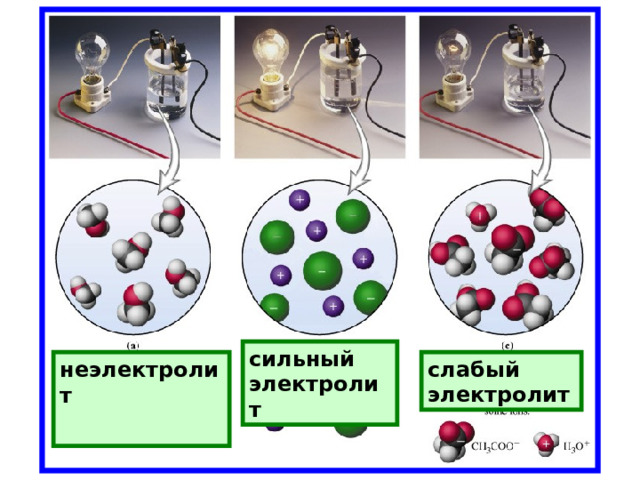
сильный электролит
неэлектролит
слабый электролит

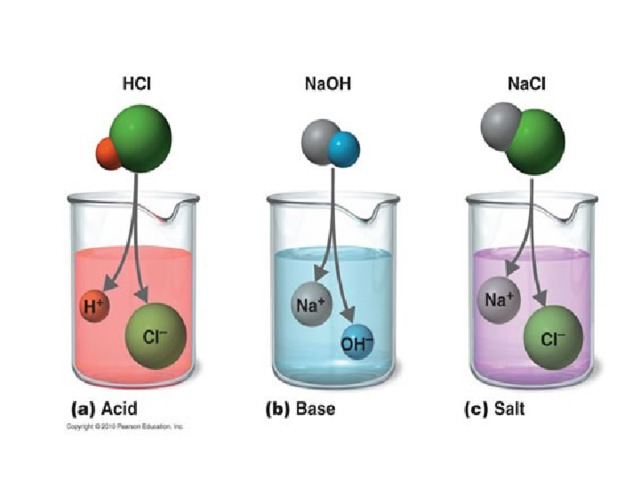
Электролитическая диссоциация
- В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы.
Процесс распада электролита на ионы в растворе или расплаве называется электролитической диссоциацией.
:
:
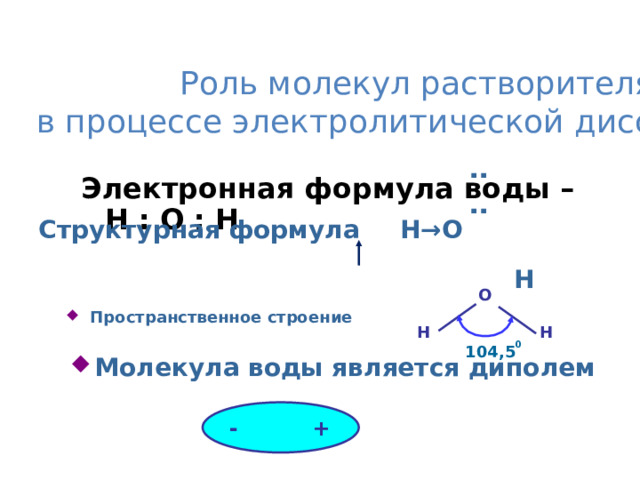
Роль молекул растворителя
в процессе электролитической диссоциации
Электронная формула воды – Н : О : Н
Структурная формула Н →О
Н
- Пространственное строение
O
- Молекула воды является диполем
H
H
104,5 0
+
-

Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания ионов в узлах кристаллической решётки - кристаллическая решётка разрушается .
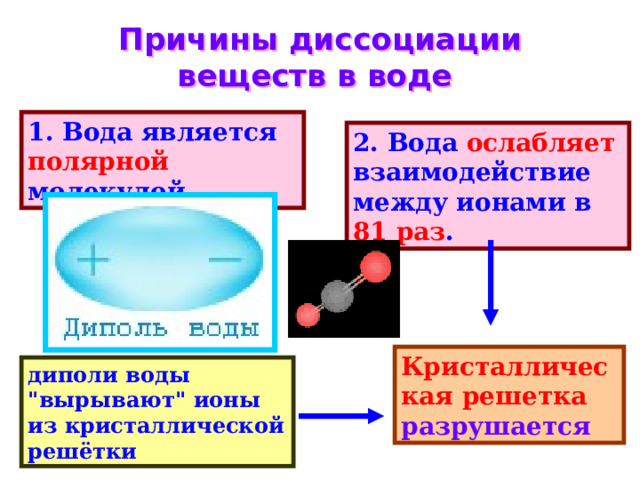
Причины диссоциации веществ в воде
1. Вода является полярной молекулой
2. Вода ослабляет взаимодействие между ионами в 81 раз .
Кристаллическая решетка разрушается
диполи воды "вырывают" ионы из кристаллической решётки
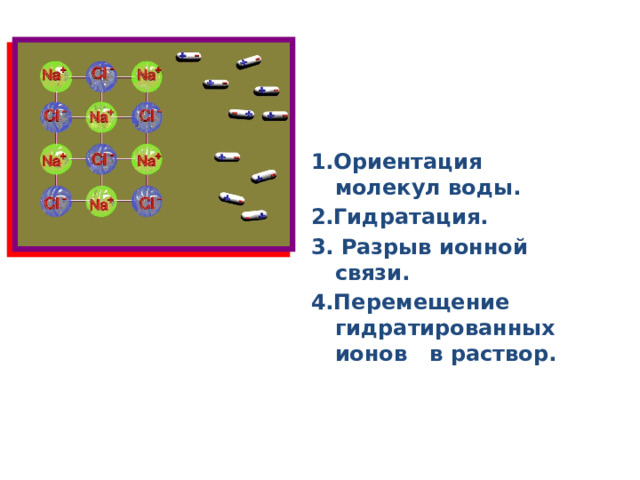
1.Ориентация молекул воды.
2.Гидратация.
3. Разрыв ионной связи.
4.Перемещение гидратированных ионов в раствор.
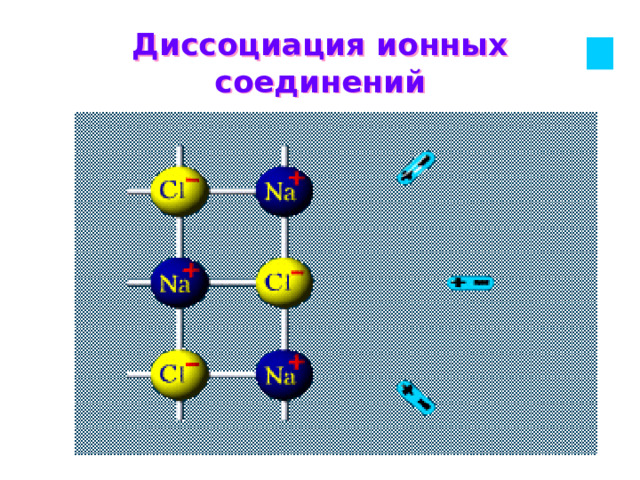
Диссоциация ионных соединений
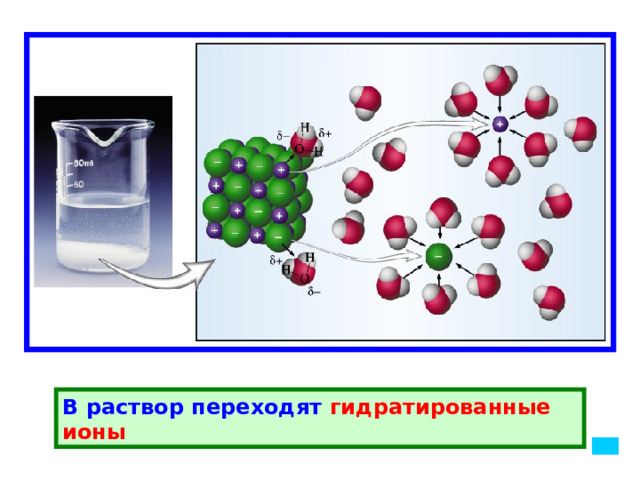
В раствор переходят гидратированные ионы
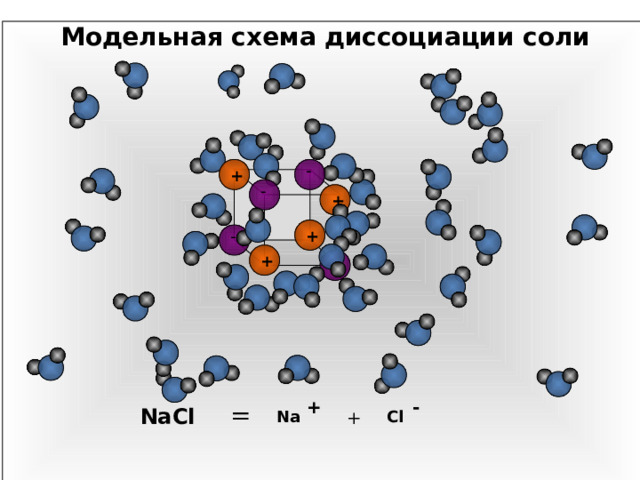
Модельная схема диссоциации соли
-
+
-
+
-
+
+
-
-
+
+
=
NaCl
Cl
Na

Условия протекания реакции ионного обмена
Реакции в растворах электролитов протекают до конца если:
- Образуется или растворяется осадок;
- Выделяется газ;
- Образуется малодиссоциирующее вещество (например Н 2 О)
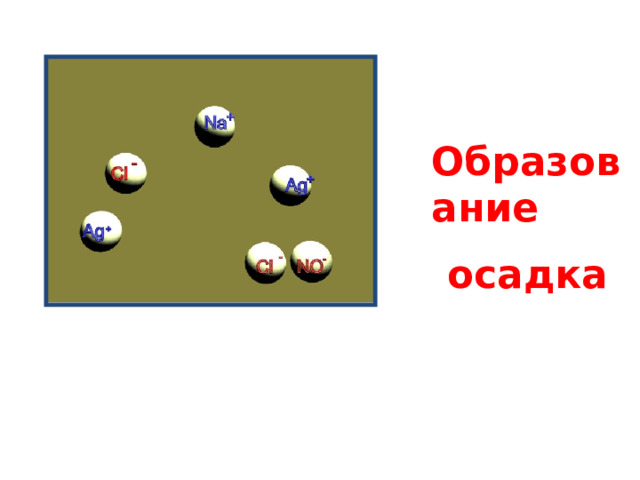
Образование
осадка

Образование
Н 2 О

Выделение
газа

Диссоциация кислот
Двухосновные
H 2 SO 4 , H 2 CO 3 , H 2 S, H 2 SiO 3
Одноосновные
HClO 4 , HNO 3 , HCl, HBr
Четырёхосновные
H 4 P 2 O 7 , H 4 SiO 4
Трёхосновные
H 3 PO 4 , H 3 BO 3
С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и ионы кислотных остатков.
 2 H 2 SO 4 2H + + SO 4 2- H 2 SO 3 H + + HSO 3 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. " width="640"
2 H 2 SO 4 2H + + SO 4 2- H 2 SO 3 H + + HSO 3 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. " width="640"
Диссоциация многоосновных кислот
Сильный электролит
Электролит средней силы
H 2 SO 3 H + + HSO 3 - 1
H 2 SO 4 H + + HSO 4 - 1
HSO 4 - H + + SO 4 2- 2
HSO 3 - H + + SO 3 2- 2
1 2
1 2
H 2 SO 4 2H + + SO 4 2-
H 2 SO 3 H + + HSO 3 -
Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей.
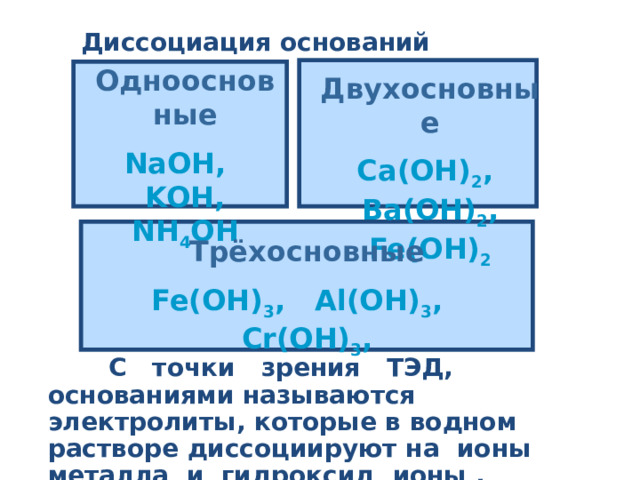
Диссоциация оснований
Одноосновные
NaOH, KOH, NH 4 OH
Двухосновные
Ca(OH) 2 , Ba(OH) 2 , Fe(OH) 2
Трёхосновные
Fe(OH) 3 , Al(OH) 3 , Cr(OH) 3 ,
С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и гидроксид ионы .

Диссоциация оснований
NaOH = Na + + OH -
Ba(OH) 2 = BaOH + + OH - → Ba 2+ + 2OH -
KOH = K + + OH -
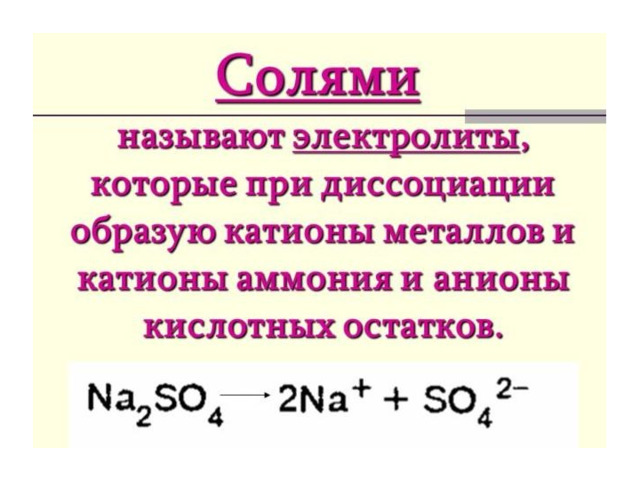
Основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп

Составление ионных уравнений

Даны растворы хлорида железа(III) и гидроксида калия. Написать молекулярное и ионные уравнения реакции между этими растворами.
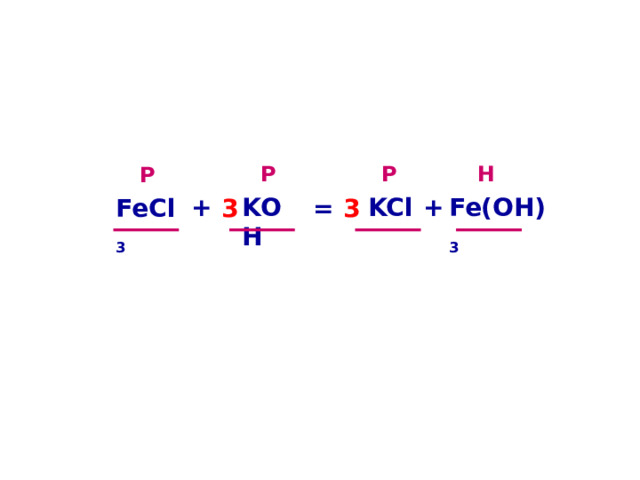
1. Записать молекулярное уравнение реакции
+
+
KOH
KCl
Fe(OH) 3
FeCl 3
=
3
3
расставить коэффициенты

2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей)
Fe(OH) 3
+
+
KOH
KCl
FeCl 3
=
3
3
Используя таблицу растворимости определить растворимость электролитов и записать результат над формулами (Р, М, Н).
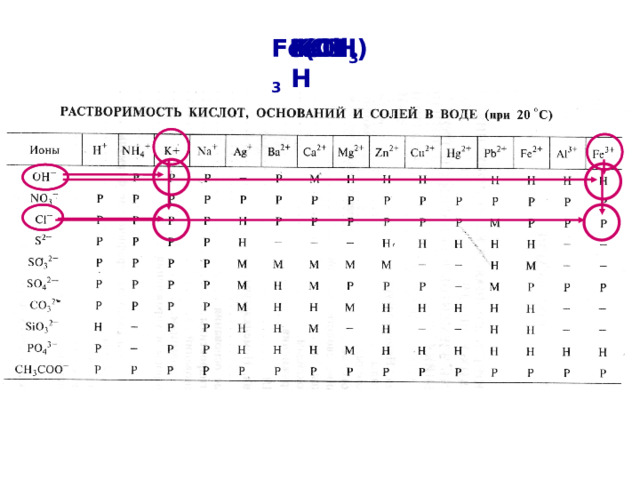
Fe(OH) 3
FeCl 3
KCl
KOH
Р
Н
Р
Р
+
KOH
KCl
Fe(OH) 3
+
FeCl 3
3
=
3

3. Написать полное ионное уравнение реакции.
ЗАПОМНИТЬ!!!
В ионных уравнениях формулы электролитов
1) растворимых в воде всегда записываются в диссоциированном виде;
2) нерастворимых в воде всегда записываются в молекулярном виде;
3) малорастворимых в воде слева записываются в диссоциированном виде, а справа – в молекулярном .
Р
Р
Н
Р
+
Fe(OH) 3
KCl
KOH
+
3
FeCl
=
3
3
3
Cl -
K +
+
+
+
Cl -
Fe(OH) 3
K +
+
+
3
3
3
3
Fe 3+
=
OH -
Необходимо учитывать индексы у ионов и коэффициенты в уравнении реакции.

4. Для составления сокращённого ионного уравнения надо найти одинаковые ионы справа и слева от знака равенства и вычеркнуть их.
K +
Cl -
+
+
3
+
Cl -
+
Fe(OH) 3
K +
+
3
3
3
Fe 3+
3
=
OH -
5. Записать уравнение без вычёркнутых ионов.
Fe(OH) 3
+
3
Fe 3+
=
OH -
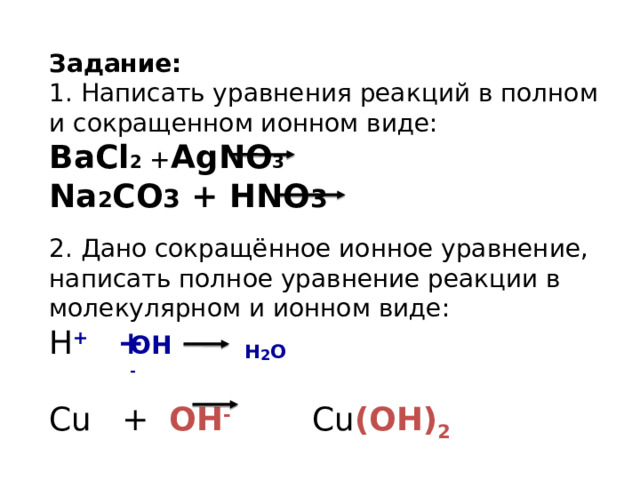
Задание:
1. Написать уравнения реакций в полном и сокращенном ионном виде:
BaCl 2 + AgNO 3
Na 2 CO 3 + HNO 3
2. Дано сокращённое ионное уравнение, написать полное уравнение реакции в молекулярном и ионном виде:
H + +
Cu + OH - Cu (OH) 2
OH -
H 2 O
































 2 H 2 SO 4 2H + + SO 4 2- H 2 SO 3 H + + HSO 3 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. " width="640"
2 H 2 SO 4 2H + + SO 4 2- H 2 SO 3 H + + HSO 3 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. " width="640"






























