Конспект урока «Агрегатные состояния вещества. Водородная химическая связь. Чистые вещества и смеси». Механизация с/х и Прикладная информатика
Цели урока: рассмотреть особенности молекулярного строения и свойства тел в различных агрегатных состояниях. ввести понятия «чистое вещество» и «смесь веществ», раскрыть значение смесей в природе и жизни человека, познакомить учащихся со способами разделения смесей.
Задачи урока: способствовать формированию знаний у учащихся о фазовых переходах, умения объяснять свойства вещества в различных агрегатных состояниях, на основе молекулярного строения вещества; развивать представление о материальности мира, содействовать развитию речи, мышления; воспитывать положительное отношение к предмету.
Агрегатные состояния вещества. Водородная химическая связь.
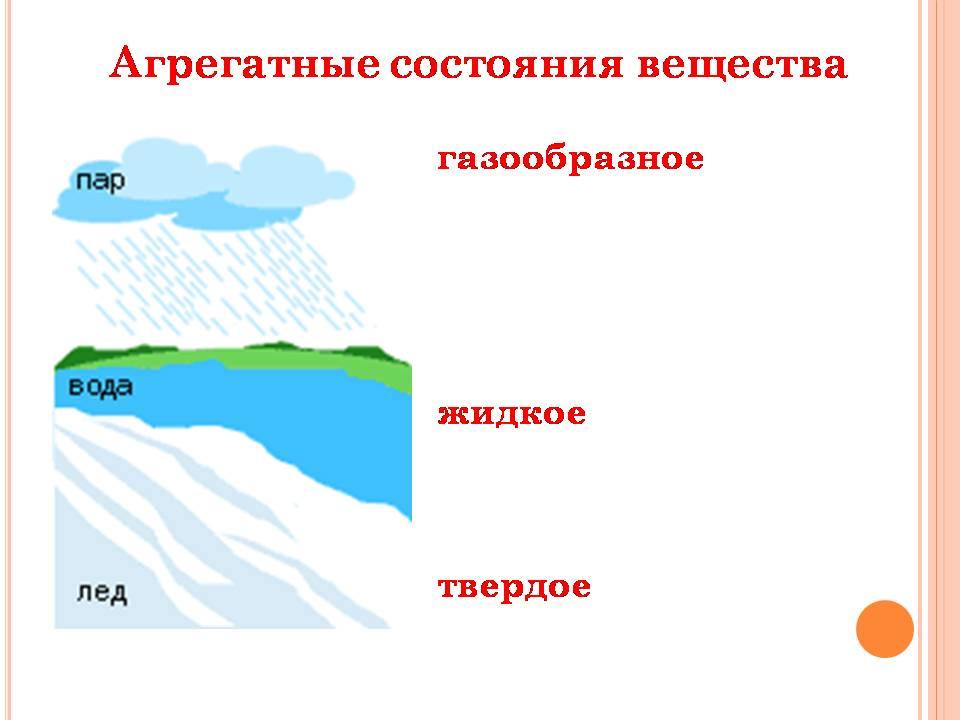
Вода – самое распространенное и самое удивительное вещество на нашей планете. Она вездесуща. На земле нет ничего, что не содержало бы воды. Покрывающий ¾ нашей земли океан, в котором миллиарды лет назад зародилась жизнь, - это вода. Снежные шапки горных вершин, бескрайние ледяные пустыни Арктики и Антарктики – это тоже вода. Тучи и облака, туман и осадки - и это вода.
В атмосферном воздухе всегда содержится вода в газообразном состоянии.
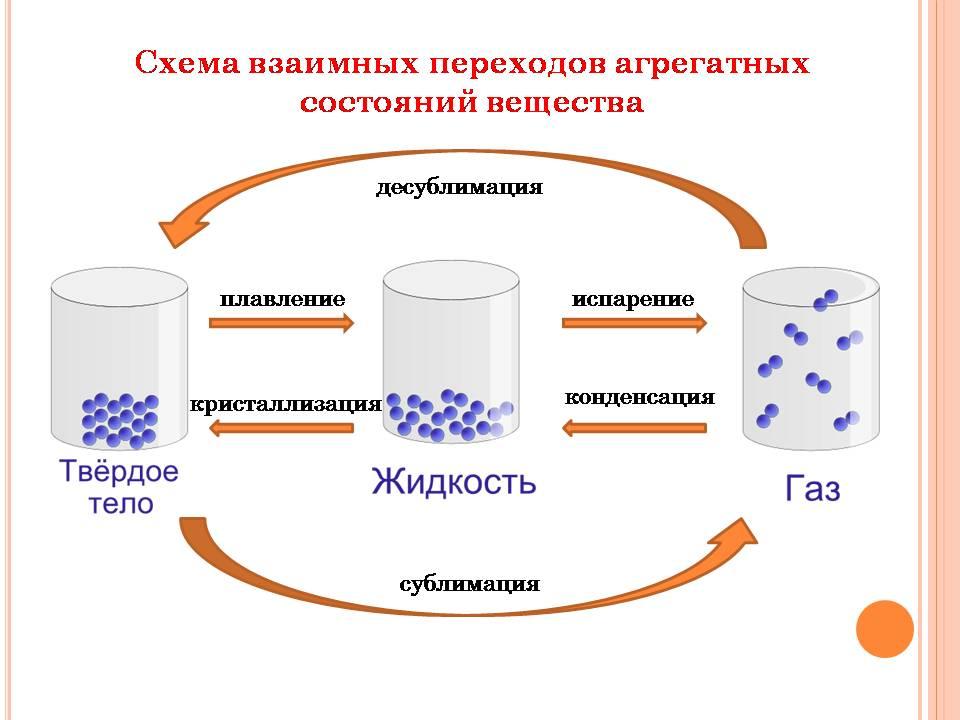
Часто вместо термина «газ» применительно к воде в газообразном состоянии используют слово «пар». Пары воды прозрачны и бесцветны, их невозможно увидеть. А вот в бытовом понимании водяным паром называют мельчайшие капельки сконденсированной влаги, например туман, пар из носика кипящего чайника. Процесс перехода вещества из газообразного в жидкое агрегатное состояние – конденсация. Процесс перехода вещества из жидкого в газообразное агрегатное состояние – испарение.
В жидкостях частицы вещества расположены гораздо ближе друг к другу, и благодаря силам взаимного притяжения молекул жидкости обладают такой важной характеристикой, как собственный объем. Поступательное движение молекул, хотя и затруднено по сравнению с газами, все-таки сохраняется. Это обусловливает такое важнейшее свойство жидкостей, как текучесть.
Большинство жидких веществ при охлаждении переходит в твердое агрегатное состояние. Такой процесс называют кристаллизацией. Для воды этот процесс происходит при температуре 00С. Процесс перехода вещества из твердого агрегатного состояния в жидкое – плавление.
Частицы твердого вещества находятся настолько близко друг к другу, что очень ограничены в движении. Они совершают колебания, главным образом относительно положения равновесия, а вот перемещаться для них – почти неразрешимая задача. Силы взаимного притяжения частиц в твердых веществах настолько велики, что последние, как правило, не обладают текучестью и имеют не только объем, но и форму.
Все низкомолекулярные вещества могут переходить из твердого состояния сразу в газообразное. Такой процесс называют сублимацией. Процесс, обратный сублимации, называют десублимацией.
Почему же вещества молекулярного строения, у которых ковалентные связи образуются между атомами только в пределах одной молекулы, бывают и твердыми, и жидкими? Что заставляет молекулы в таких веществах притягиваться друг к другу?
Одним из видов молекулярного взаимодействия называется водородной связью. Рассмотрим ее на примере воды. Химические связи между молекулами водорода и кислорода ковалентные полярные. Молекула воды имеет угловое строение. Помимо двух общих с водородом электронных пар у атома кислорода имеются две пары собственных электронов, которые называют неподеленными. Кислород как более электроотрицательный атом обладает частичным отрицательным зарядом. Атомы водорода несут частично положительный заряд. Вполне естественно, что между атомом водорода одной молекулы воды и неподеленной электронной парой атома кислорода другой молекулы возникает электростатическое напряжение:

В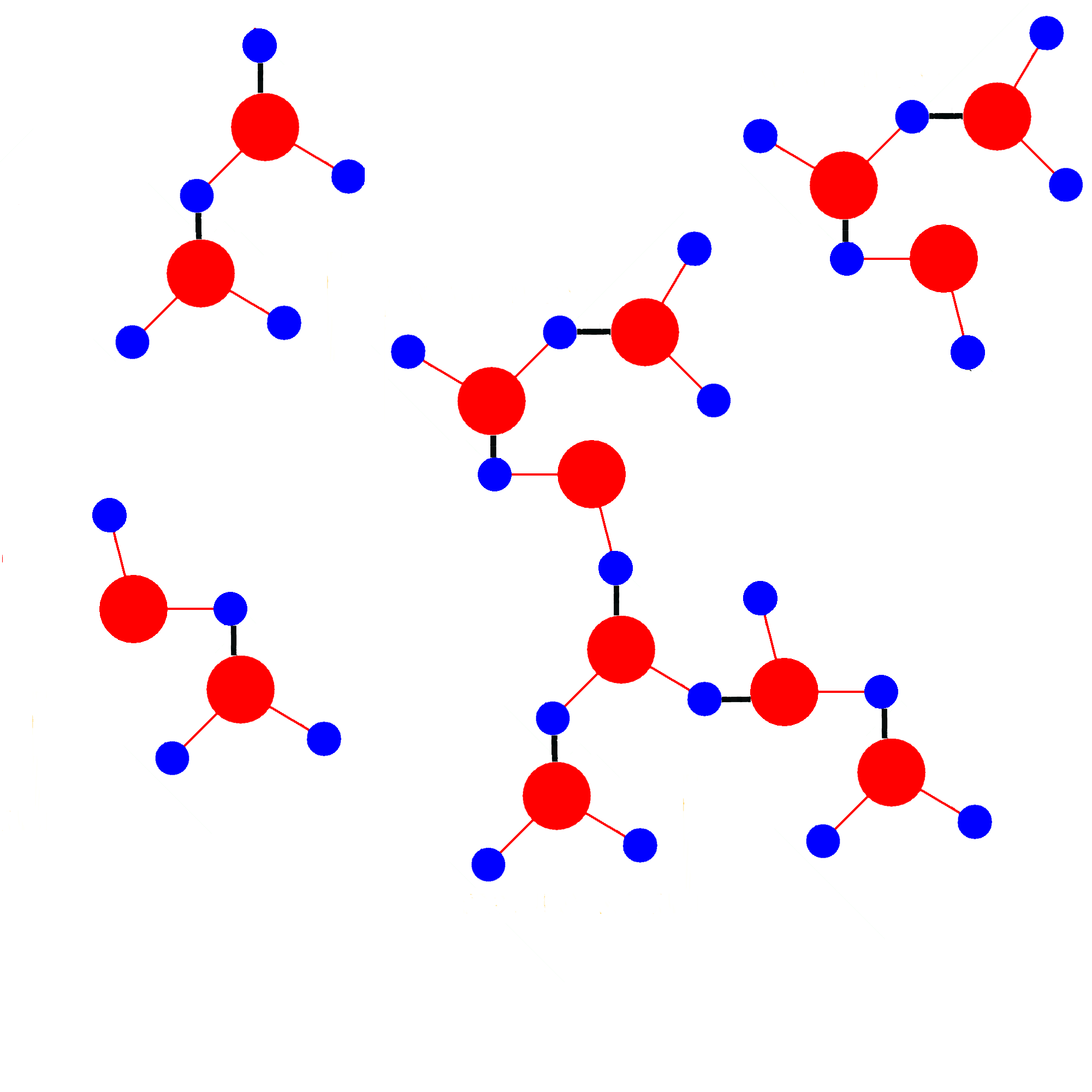 молекуле воды два атома водорода и две неподеленные электронные пары атома кислорода. Следовательно, каждая молекула способна к образованию не одной, а четырех водородных связей. Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.
молекуле воды два атома водорода и две неподеленные электронные пары атома кислорода. Следовательно, каждая молекула способна к образованию не одной, а четырех водородных связей. Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.
Водородная связь может возникать между атомами водорода одной молекулы и атомами неметаллов с высокой электроотрицательностью, имеющими неподеленные электронные пары, другой молекулы.
Химическая связь между атомом элемента с высокой электроотрицательностью, имеющим неподеленные электронные пары (атом фтора, кислорода, азота), одной молекулы и атомом водорода другой молекулы называют водородной.
Чистые вещества и смеси
Один из самых любимых материалов скульпторов, архитекторов, строителей – мрамор. Окраска этой горной породы разнообразна. Основу мрамора составляет вещество – карбонат кальция. Почему мрамор бывает разного цвета? Потому что помимо карбоната кальция в его состав входят примеси, придающие окраску. Чистых веществ в природе, технике, быту совсем немного. Гораздо чаще встречаются смеси – сочетание двух или более веществ. Воздух – это смесь различных газов, нефть – природная смесь органических веществ.
Смеси различаются размером входящих в их состав частиц веществ. Иногда они настолько велики, что их можно видеть невооруженным глазом. Если смешать речной песок с сахарным, то без труда можно разделить отдельные кристаллики.
Смеси, в которых частички составляющих их веществ видны невооруженным глазом или под микроскопом, называют неоднородными, или гетерогенными. Есть смеси, при образовании которых вещества дробятся на мельчайшие частицы, не различимые даже в самый мощный микроскоп. Как бы вы не всматривались в воздух, различить составляющие его газы не удастся. Такие смеси называют однородными или гомогенными.
Состав газовой смеси характеризуется объемной долей каждого из ее компонентов.
Объемная доля () газа в смеси – отношение объема данного газа (Vг) к общему объему смеси (Vсм), выраженное в долях единицы или процентах

Объемная доля показывает, какую часть общего объема смеси занимает конкретный газ.
Состав жидких и твердых смесей принято характеризовать величиной, которая называется массовой долей компонента.
Массовая доля (w) вещества в смеси – отношение массы данного вещества (mв) к общей массе смеси (mсм), выраженное в долях единицы или процентах.










 молекуле воды два атома водорода и две неподеленные электронные пары атома кислорода. Следовательно, каждая молекула способна к образованию не одной, а четырех водородных связей. Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.
молекуле воды два атома водорода и две неподеленные электронные пары атома кислорода. Следовательно, каждая молекула способна к образованию не одной, а четырех водородных связей. Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.











