Агрегатное состояние вещества, переходы.
Вещества могут находиться в различных агрегатных состояниях: твердом, жидком, газообразном. Молекулярные силы в разных агрегатных состояниях различны: в твердом состоянии они наибольшие, в газообразном — наименьшие. Различием молекулярных сил объясняются свойства, которые проявляются в разных агрегатных состояниях:
твердые тела сохраняют объем и форму (несжимаемы), имеют кристаллическое строение, характеризуются плотной упаковкой и дальним порядком в расположении частиц;
жидкости текучи, практически не сжимаются (сохраняют объем), принимают форму сосуда, характеризуются плотной упаковкой и ближним порядком в расположении частиц;
газы легко сжимаются, полностью занимают весь предоставленный им объем, имеют малую плотность, характеризуются большими расстояниями и слабым взаимодействием частиц вещества.

В твердых телах расстояние между молекулами маленькое и преобладают силы взаимодействия. Поэтому твердые тела обладают свойством сохранять форму и объем. Молекулы твердых тел находятся в постоянном движении, но каждая молекула движется около положения равновесия.
В жидкостях расстояние между молекулами побольше, значит, меньше и силы взаимодействия. Поэтому жидкость сохраняет объем, но легко меняет форму.
В газах силы взаимодействия совсем невелики, так как расстояние между молекулами газа в несколько десятков раз больше размеров молекул. Поэтому газ занимает весь предоставленный ему объем.
Переходы из одного агрегатного состояния вещества в другое
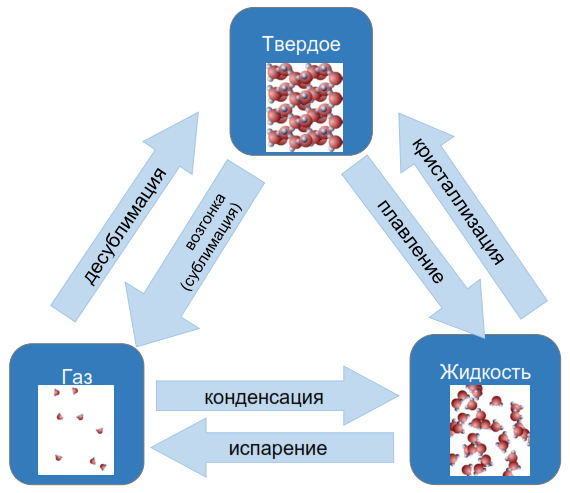
Плавление вещества − переход вещества из твердого состояния в жидкое.
Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Например, у льда Сtпл=00С.
Пока происходит плавление, температура вещества не изменяется.
Что надо сделать, что расплавить вещество массой m? Сначала нужно его нагреть до температуры плавления tпл, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Само плавление будет происходить при постоянной температуре, равной температуре плавления.
Кристаллизация (затвердевание) вещества − переход вещества из жидкого состояния в твердое.
Это процесс, обратный плавлению. Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой плавления.
Пока происходит кристаллизация, температура вещества не изменяется.
Что надо сделать, что вещество массой m кристаллизовалось? Сначала нужно его охладить до температуры плавления tпл, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Кристаллизация будет происходить при постоянной температуре, равной температуре плавления.
Парообразование вещества − переход вещества из жидкого состояния в газообразное.
Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается.
Различают два вида парообразования: испарение и кипение.
Определение
Испарение − парообразование с поверхности жидкости, происходящее при любой температуре.
Скорость испарения зависит от:
температуры;
площади поверхности;
рода жидкости;
ветра.
При испарении жидкость охлаждается. Это объясняется тем, что жидкость покидают частицы с наибольшей кинетической энергией.
Кипение − парообразование по всему объему жидкости, которое происходит только при определенной температуре, называемой температурой кипения.
Каждое вещество имеет свою температуру кипения. Например, у воды tкип=1000С. Пока происходит кипение, температура вещества не изменяется.
Что надо сделать, чтобы вещество массой m выкипело? Сначала нужно его нагреть до температуры кипения tкип, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Само кипение будет происходить при постоянной температуре, равной температуре кипения.
Конденсация вещества − переход вещества из газообразного состояния в жидкое.
Это процесс, обратный парообразованию. Конденсация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой кипения.
Пока происходит конденсация, температура вещества не изменяется.
Что надо сделать, чтобы вещество массой m сконденсировалось? Сначала нужно его охладить до температуры кипения tкип, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Конденсация будет происходить при постоянной температуре, равной температуре кипения.



















