
Агрегатные состояния вещества

Три состояния воды
Газообразное - пар
Твердое - лед
Жидкое - вода
В различных состояниях вещества обладают разными свойствами.

Расположение молекул в твердых телах
Молекулы расположены в определенном порядке – кристаллическая структура.
Молекулы колеблются возле своего места – сохраняя объем и форму твердого тела.
Притяжение между молекулами очень сильное
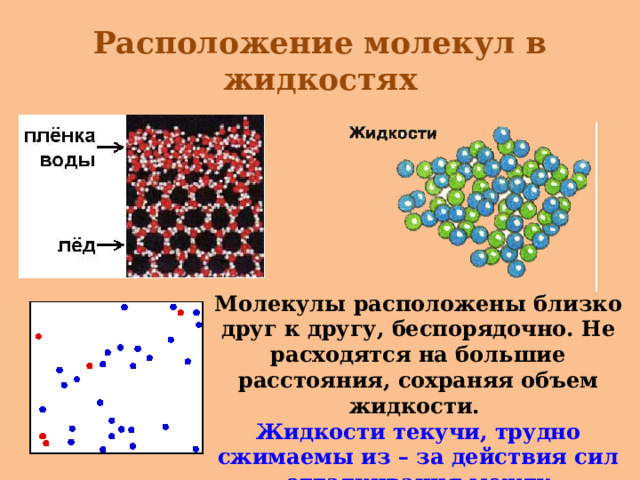
Расположение молекул в жидкостях
Молекулы расположены близко друг к другу, беспорядочно. Не расходятся на большие расстояния, сохраняя объем жидкости.
Жидкости текучи, трудно сжимаемы из – за действия сил отталкивания между молекулами.

Расположение молекул в газах
Расстояние между молекулами намного больше, чем в жидкостях.
Беспорядочное расположение молекул - силы притяжения слабые – отсутствие постоянного объема и формы у газов.

Основные свойства трех состояний веществ
Газы заполняют весь предоставленный объем (все пространство). Хорошо сжимаются и расширяются.
Жидкости принимают форму сосуда. Имеют объем, не имеют форму. Трудно сжимаются.
Твердые тела имеют форму и объем. Трудно деформируются. Имеют кристаллическую структуру.
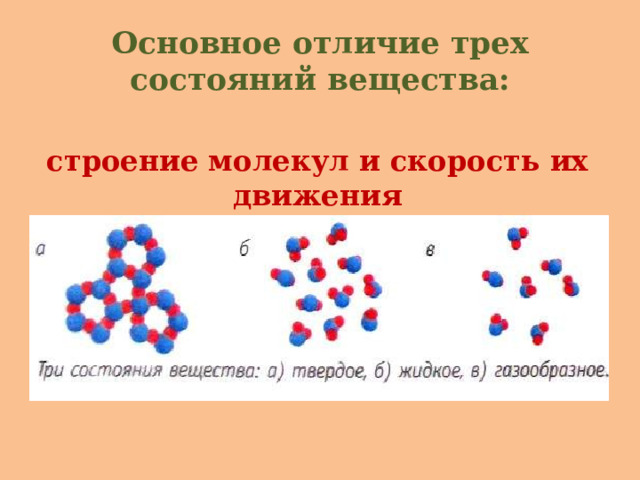
Основное отличие трех состояний вещества:
строение молекул и скорость их движения

Переход из одного состояния в другое используют в практике:
В работе технических устройств: паровой турбине, двигателе внутреннего сгорания
для получения сплавов
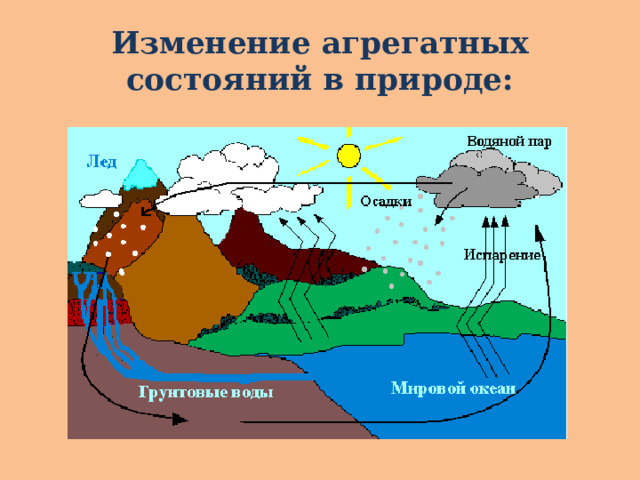
Изменение агрегатных состояний в природе:

Условия перехода вещества из одного состояния в другое:
Изменение температуры сопровождается выделением энергии
Увеличение температуры – нагрев – увеличение внутренней энергии вещества
Уменьшение температуры – охлаждение – уменьшение внутренней энергии вещества
Передавая телу энергию, можно перевести его из одного состояния в другое

Каким бывает лед?
Горячий лёд
Английский физик Бриджмен показал, что вода под давлением р ~2*10 9 Па остаётся твёрдой даже при t = 76 0 С. Это так называемый «горячий лёд - 5». Взять его в руки нельзя, о свойствах этой разновидности льда узнали косвенным образом.
«Горячий лёд» плотнее воды (1050кг/м 3 ), он тонет в воде.
Сегодня известно более 10 разновидностей льда с удивительными качествами.

Сухой лёд
При сгорании угля можно получить не жар, а наоборот, холод. Для этого уголь сжигают в котлах, образующийся дым очищают и улавливают в нём углекислый газ. Его охлаждают и сжимают до давления 7*10 6 Па. Получается жидкая углекислота. Её хранят в толстостенных баллонах.
При открывании крана жидкая углекислота резко расширяется и охлаждается, превращаясь в твёрдую углекислоту – «сухой лёд».
Под влиянием теплоты хлопья сухого льда сразу переходят в газ, минуя жидкое состояние.

Плавление
- переход вещества из твердого состояния в жидкое

Чтобы расплавить тело, его нужно нагреть до определенной температуры
Температура, при которой тело плавится называется температурой плавления.

При плавлении:
- увеличивается скорость движения молекул;
- разрушается упорядоченность строения молекул (кристаллическая структура нарушается);
- силы притяжения между молекулами ослабевают

Кристаллизация
- переход вещества из жидкого состояния в твердое

Нагретое тело охлаждается до определенной температуры
Температура, при которой вещество кристаллизуется, называется температурой кристаллизации
Температура плавления равна температуре кристаллизации
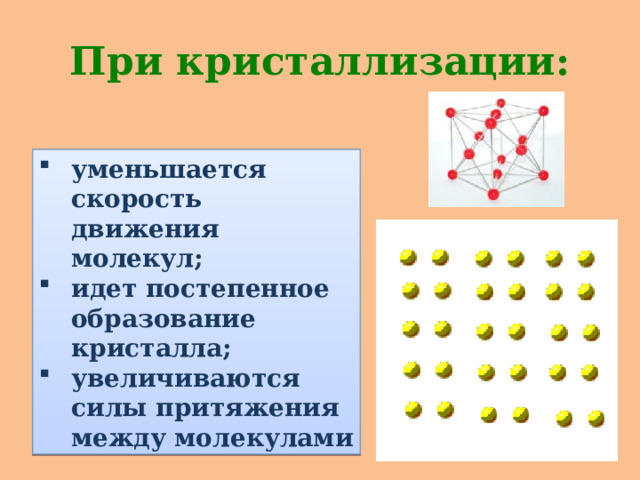
При кристаллизации:
- уменьшается скорость движения молекул;
- идет постепенное образование кристалла;
- увеличиваются силы притяжения между молекулами

Ответить на вопросы:
- 1. почему нельзя нагреть и расплавить свинец в оловянной ложке?
- 2. можно ли расплавить цинк в алюминиевой чаше?
- 3. расплавится ли цезий в воде при температуре С?
- 4. одинаковы ли условия кристаллизации стали и железа?


































