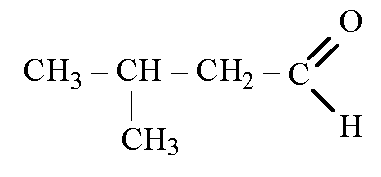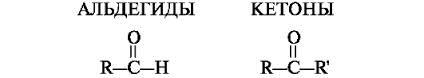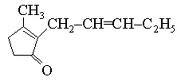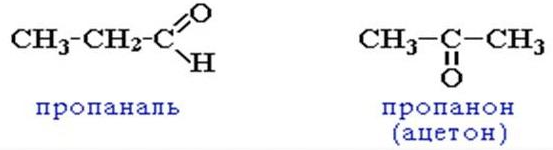Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Общая формула предельных монокарбоновых кислот CnH2n+1COOH
1. По типу углеводородного радикала, связанного с карбоксильной группой:
ароматические (бензойная кислота);
алифатические - предельные (капроновая кислота) и непредельные (акриловая кислота);
алициклические (хинная кислота);
гетероциклические (никотиновая кислота).
2. По числу карбоксильных групп:
одноосновные (муравьиная HCOOH, уксусная кислота CH3COOH)
двухосновные (щавелевая HOOC−COOH, янтарная (бутандиовая) кислота HOOC−CH2−CH2COOH)
многоосновные (лимонная кислота HOOC−CH2−C(OH)(COOH)−CH2−COOH).
НОМЕНКЛАТУРА И ИЗОМЕРИЯ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
В соответствии с международной номенклатурой ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию углеводородного радикала окончание "-овая" и слово "кислота". При этом отсчет производится от первого атома углерода, входящего в состав карбоксильной группы. Это правило не распространяется на аминокислоты, для которых нумерация начинается со второго атома углерода, если считать атом карбоксильной группы.
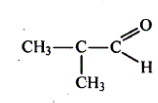
Например: CH3−CH2−COOH - пропановая кислота, CH3−C(CH3)2−COOH - 2,2-диметилпропановая кислота.
Многие из карбоновых кислот имеют тривиальные названия:
| Название по ИЮПАК | Тривиальное название | Формула | Название соли |
| Метановая кислота | Муравьиная кислота | HCOOH | формиаты |
| Этановая кислота | Уксусная кислота | CH3COOH | ацетаты |
| Пропановая кислота | Пропионовая кислота | C2H5COOH | пропионаты |
| Бутановая кислота | Масляная кислота | C3H7COOH | бутираты |
| Пентановая кислота | Валериановая кислота | C4H9COOH | валераты |
| Гексановая кислота | Капроновая кислота | C5H11COOH | капронаты |
Для одноосновных карбоновых кислот характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Межклассовая изомерия со сложными эфирами
ХИМИЧЕСКИЕ СВОЙСТВА
одноосновных предельных карбоновых кислот
1. Кислоты реагируют с активными металлами:
2CH3COOH+Zn=(CH3COO)2Zn+H2
и с оксидами металлов:
MgO+CH3COOH=(CH3COO)2Mg+H2O
2. Реагируют с сильными основаниями (щелочами), с образованием соответствующих солей:
CH3COOH+NaOH⟶CH3COONa+H2O
3. Реагируют с солями слабых кислот, например, карбонатами (только те кислоты, которые сильнее угольной):
Na2CO3+2HCOOH=2HCOONa+CO2+H2O
4. Реакция этерификации - это взаимодействие карбоновых кислот со спиртами в присутствии катализаторов - водоотнимающих средств (например, H2SO4 конц.), приводящее к образованию сложных эфиров:
RCOOH+R′OH=RCOOR′+H2O
Механизм реакции этерификации представлен на схеме:
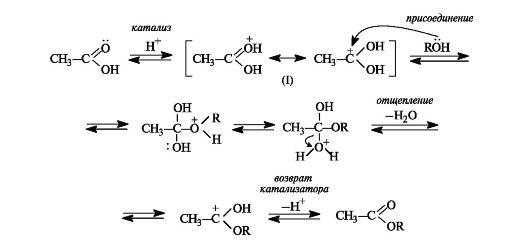
Этерификация - обратимая реакция. Смещение равновесия вправо возможно отгонкой из реакционной смеси образующегося эфира, отгонкой или связыванием воды, либо использованием избытка одного из реагентов. Реакция, обратная этерификации, приводит к гидролизу сложного эфира с образованием карбоновой кислоты и спирта.
5. С другими карбоновыми кислотами реакция также протекает в присутствии водоотнимающих средств и приводит к образованию ангидридов:
RCOOH+R′COOH→P2O5,t∘CRCOOOCR′+H2O
Методы ПОЛУЧЕНИЯ карбоновых кислот
Лабораторными методами получения карбоновых кислот являются:
1. Окисление спиртов, альдегидов и кетонов
Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве условного окислителя [O] могут применяться KMnO4, K2Cr2O7, CuO и др.
R−CH2OH→[O]R−C(O)H→[O]R−COOH
2. Омыление (гидролиз) сложных эфиров
R−COOR1+KOH⟶R−COOK+R1OH
R−COOK+HCl⟶R−COOH+KCl
3. Жесткое окисление алкенов (перманганат калия в кислой среде):
CH2=CH2→KMnO4,H+CH3COOH
R−CH=CH−R1→KMnO4,H+R−COOH+R1−COOH
НАХОЖДЕНИЕ В ПРИРОДЕ и ПРИМЕНЕНИЕ карбоновых кислот
Соли высших предельных кислот являются мылами (подробно см. тему "Мыла"). Карбоновые кислоты являются частью природных животных жиров и растительных масел, восков, используются в пищевой, полимерной промышленности, в фармации и в органическом синтезе.
Наиболее широко используются уксусная и муравьиная кислота, являющиеся реагентами во многих процессах органического синтеза. Муравьиная кислота – широко применяется в медицине под названием "муравьиный спирт" (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
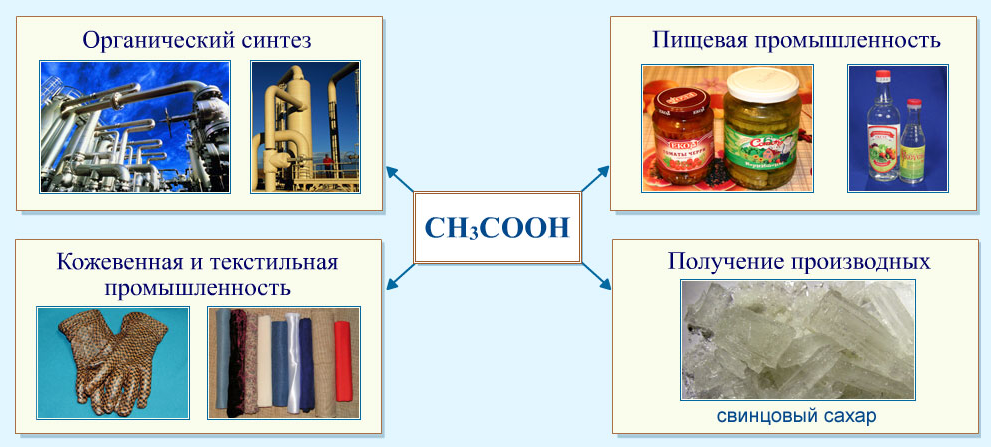
Другие карбоновые кислоты также находят широкое применение.
Масляная кислота C3H7COOH – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота HOOC−COOH – в металлургической промышленности (удаление окалины), в средствах санитарной гигиены для удаления известкового налета.
Стеариновая C17H35COOH и пальмитиновая кислота CC15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Альдегиды и Кетоны
Альдегиды и кетоны относятся к классу органических кислородсодержащих, а именно - карбонильных соединений, то есть содержат карбонильную группу -C(O)-. Альдегиды и кетоны также называют оксосоединениями, карбонильную группу - оксо-группой.
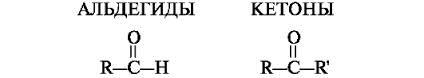
Альдегиды
Название "альдегид" было введено Юстусом фон Либихом как сокращение от латинского alcohol dehydrogenatus — дегидрированный спирт или спирт, лишенный водорода. Название радикала "формил", а также другие однокоренные слова (формальдегид, формиаты) произошли от латинского слова formica — "муравей".
Простейший альдегиды (метаналь, этаналь) - газы, альдегиды состава (ССС2–С14) – жидкости, остальные – твердые вещества. Температуры кипения альдегидов меньше, чем у соответствующих спиртов из-за отсутствия водородных связей.
Альдегидная группа содержится во многих природных веществах, таких, как углеводы, некоторые витамины (ретиналь, пиридоксаль). В небольших количествах альдегиды содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид, бензальдегид, цитраль и ванилин. Запах жасмина и розы также обусловлены присутствием в эфирных маслах соответствующих альдегидов и кетонов.
| Альдегид, кетон название | Формула | Запах |
| бензальдегид | 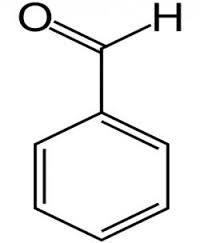
| горького миндаля 
|
| коричный альдегид | 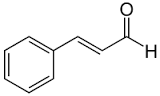
| корицы 
|
| ванилин | 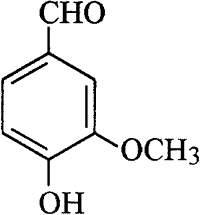
| ванили 
|
| жасмон | 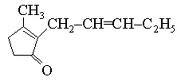
| жасмина 
|
| цитраль | 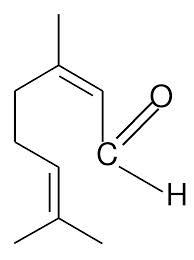
| цитрусовых 
|

Впервые синтетический альдегид был использован в 1921 году при создании легендарного аромата Chanel №5, в который входили соединения из группы так называемых жирных альдегидов, обладающие характерным цитрусовым или цветочным запахом и своеобразными "мыльными" полутонами.
Сегодня наиболее часто в парфюмерии используют следующие альдегиды:
C7 - гептаналь, обладающий «зеленым», травянистым запахом;
C8 - октаналь, апельсиновый запах;
C9 - нонаналь, запах розы;
C10 - деканаль, запахом напоминает цедру апельсина; цитраль, более сложный альдегид с запахом лимона;
C11 - ундеканаль , «чистый» альдегид, содержащийся в масле листьев кориандра;
C12 - лауриловый альдегид с запахом сирени или фиалки;
C13 - восковой запах с грейпфрутовой нотой;
C14 - ундекалактон, соединение с характерным запахом персика, использовавшееся, в частности, при создании легендарного аромата Guerlain Mitsouko.
Низшие альдегиды - формальдегид (метаналь) и уксусный альдегид (этаналь) обладают токсичными свойствами. Так, уксусный альдегид является продуктом неполного окисления алкоголя (этилового спирта) в организме человека и образуется при чрезмерном употреблении спиртных напитков. Именно он является виновником "похмельного синдрома". Формальдегид может выделяться в окружающую среду при разложении фенолформальдегидных смол (основа ДСП - древесностружечных плит, из которых производят мебель и некоторые строительные материалы), и может вызывать сильные отравления, онкологические заболевания, поражение центральной нервной системы. Поэтому формальдегид является экотоксикантом и относится ко II классу опасности (высокоопасные соединения).
СТРОЕНИЕ И КЛАССИФИКАЦИЯ АЛЬДЕГИДОВ
По определению ИЮПАК:
Определение
Альдегиды — класс органических соединений вида R-C(О)H, в которых карбонильная группа -С(О)- связана с одним атомом водорода и одним углеводородным радикалом R. При этом группа -С(О)Н называется альдегидной группой.
Общая формула предельных одноатомных альдегидов CnH2nO.
Классификация альдегидов
Альдегиды классифицируются по нескольким признакам:
1. В зависимости от насыщенности углеводородного заместителя:
предельные (насыщенные) альдегиды (ацетальдегид);
непредельные (ненасыщенные) альдегиды (акролеин);
ароматические альдегиды (бензальдегид).
2. В зависимости от числа карбонильных групп:
НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛЬДЕГИДОВ
В соответствии с международной (систематической) номенклатурой ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль (для диальдегидов — суффикса -диаль). Помимо систематической номенклатуры, для обозначения альдегидов широко используются тривиальные названия:
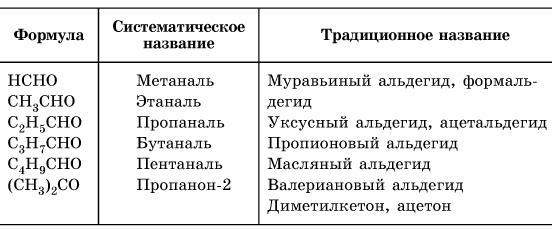
При составлении названия альдегидов по систематической номенклатуре нужно помнить ряд правил:
1. Если альдегидная группа в соединении одна, то она всегда занимает крайнее положение, и поэтому в названии альдегида номер при альдегидной группе, как правило, не ставят.
2. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл), то к названию добавляется суффикс -карбальдегид.
3. Если в соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил-, указывая её положение :
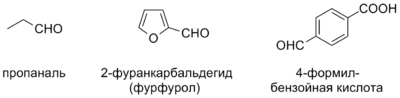
Для альдегидов характерна следующие виды изомерии:
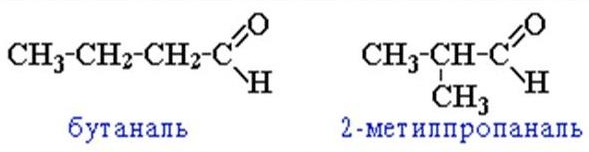
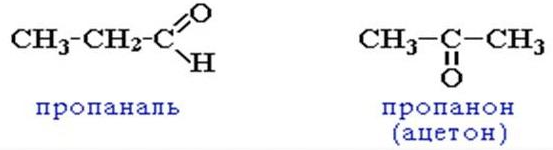
Задание для самостоятельного выполнения:
1. Запишите структурные формулы следующих соединений:
3-метилбутановая кислота,
2-пропилпентановая кислота,
3-метилгексановая кислота,
3,4- диметилоктановая кислота.
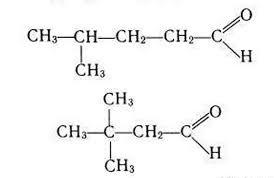
2. Назовите формулы следующих соединений: