
Алканы :
характеристика, свойства, получение и применение

Алканы – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
Основные характеристики:
- пространственное строение – тетраэдрическое
- sp 3 – гибридизация,
- ‹ HCH = 109 ° 28
- длина (-С-С-) 0,154 нм
С n H 2n+2
Номенклатура
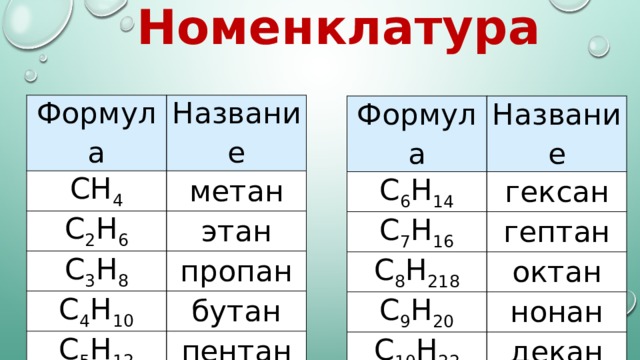
Формула
Название
CH 4
метан
C 2 H 6
этан
C 3 H 8
пропан
C 4 H 10
бутан
C 5 H 12
пентан
Формула
Название
C 6 H 14
гексан
C 7 H 16
гептан
C 8 H 218
октан
C 9 H 20
нонан
C 10 H 22
декан

По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана
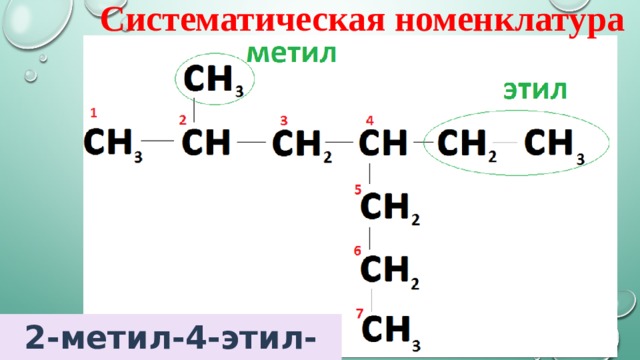
Систематическая номенклатура
2-метил-4-этил-гептан

Изомерия
характерна СТРУКТУРНАЯ изомерия цепи с С 4

Физические свойства
В обычных условиях
С 1 - С 4 – газы
С 5 - С 15 – жидкие
С 16 – твёрдые

Химические свойства
1. Реакции замещения.
а) Галогенирование
С n H 2n+2 + Cl 2 = С n H 2n+1 Cl + HCl
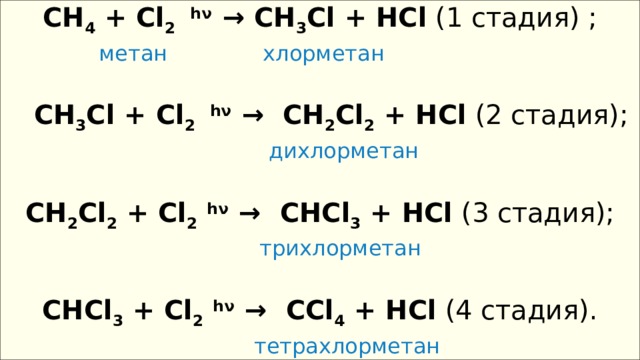
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия) ;
метан хлорметан
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия);
дихлорметан
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3 стадия);
трихлорметан
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4 стадия).
тетрахлорметан

б) Нитрование
р еакция М.И. Коновалова
С n H 2n+2 + HNO 3 (р-р) t˚С = С n H 2n+1 NO 2 + H 2 O
CH 4 + HNO 3 (р-p) t˚С → CH 3 NO 2 + H 2 O
нитрометан
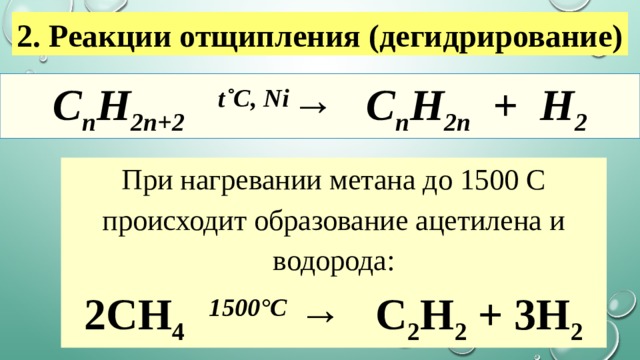
2. Реакции отщипления (дегидрирование)
C n H 2n+2 t˚С, Ni → C n H 2n + H 2
При нагревании метана до 1500 С происходит образование ацетилена и водорода:
2CH 4 1500°С → C 2 H 2 + 3H 2
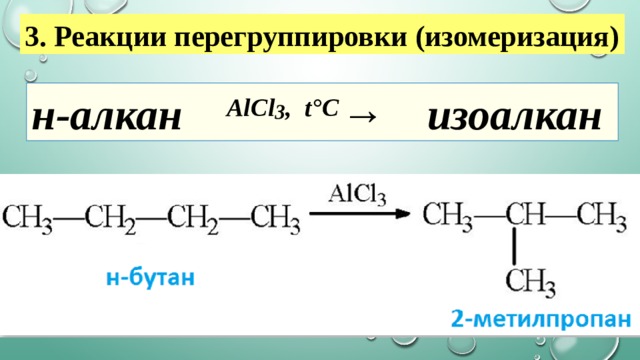
3. Реакции перегруппировки (изомеризация)
н-алкан AlCl 3 , t°С → изоалкан

4. Реакции горения
(горят светлым некоптящим пламенем)
C n H 2n+2 + O 2 t°С → CO 2 + H 2 O

5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C 10 H 22 t°С → C 5 H 12 + C 5 H 10
алкан алкен

5. Реакции разложения
б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С и Н 2 :
СH 4 1000°С → C + 2H 2

5. Реакции разложения
в) Конверсия метана с образованием
синтез – газа (СО + Н 2 )
CH 4 + H 2 O 800˚C, Ni → СО + 3Н 2

Получение алканов
В лаборатории
- Гидролиз карбида алюминия (получение метана):
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 ↑

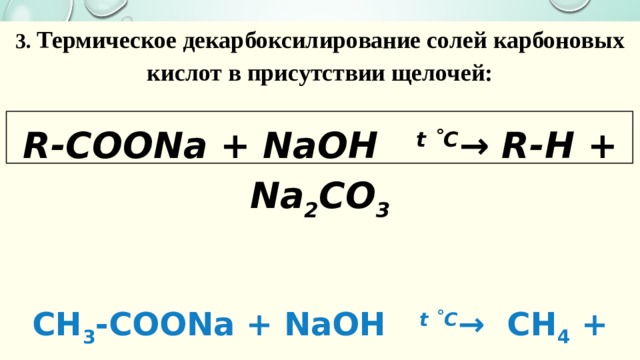
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
R-COONa + NaOH t ˚С → R-H + Na 2 CO 3
CH 3 -COONa + NaOH t ˚С → CH 4 + Na 2 CO 3
C 2 H 5 -COONa + NaOH t ˚С → C 2 H 6 + Na 2 CO 3

4. Каталитическое гидрирование алкенов и алкинов:
C n H 2n + H 2 t, kat, p → C n H 2n+2
C 2 H 4 + H 2 300°C, Ni → C 2 H 6
C n H 2n-2 + 2H 2 t, kat → C n H 2n+2
C 2 H 2 + 2H 2 t, kat → C 2 H 6

5. Электролиз растворов солей
карбоновых кислот - реакция КОЛЬБЕ
2H 2 O + 2CH 3 COONa эл.ток =
= H 2 + 2NaHCO 3 + C 2 H 6

В промышленности
1. Из природного и попутного нефтяного газа
2. Синтезом из водяного газа
CO + H 2 t,kat → C n H 2n+2 + H 2 O
CO + 3H 2 - t,kat → CH 4 + H 2 O

3. Синтезом из простых веществ:
C + H 2 t,kat,p → C n H 2n+2
C + 2 H 2 500°C,Ni → CH 4
Лакокрасочная промышленность
Медицина
АЛКАНЫ
Топливо
Парфюмерия и косметика

















































