Аллотропия фосфора. «Розовый» фосфор
Современная наука щедра не только на принципиально новые открытия в разных своих сферах, но также на переосмысление и дополнение того, что, казалось бы, уже практически известно. Так, в нынешнем году, исследователям из Великобритании, в процессе изучения механизма аллотропного превращения белого фосфора в красный, удалось увидеть переходное состояние (или по-научному интермедиат) этого превращения, которое назвали «розовым» фосфором.
Теперь обо всём по порядку.
Кто-то ещё со школьной скамьи помнит, что аллотропия – это явление существования одного и того же химического элемента в виде разных простых веществ. Такие вещества называют аллотропными модификациями или просто аллотропами этого элемента. Причиной аллотропии является разное расположение атомов в кристаллической решётке или возможность образования элементом нескольких видов молекул с различающимся составом. В первом случае говорят о твёрдых аллотропных модификациях, - это аллотропы углерода (алмаз, графит, графен); во втором - о веществах с молекулярным строением, таких как аллотропы кислорода, - дикислород О2 и озон О3, аллотропы углерода – фуллерены С60, С70, и упомянутый в теме статьи фосфор.
Об аллотропных модификациях фосфора кое-что уже известно, и довольно давно. Существует три классических аллотропа фосфора – белый, красный и чёрный.
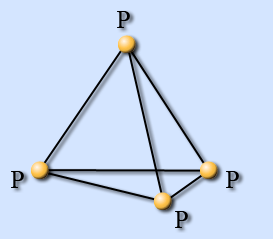
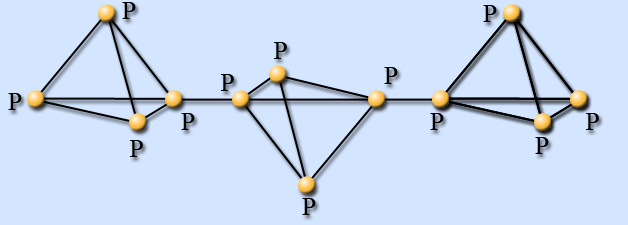
Рис.1 Белый фосфор Рис.2 Красный фосфор
Первый аллотроп (Рис.1) представляет собой тетраэдр, в вершинах которого расположены атомы фосфора. Белый фосфор невероятно реакционноспособен, ядовит, светится в темноте и вообще легко самовоспламеняется.
Второй аллотроп (Рис.2) имеет полимерную структуру, здесь нити из атомов фосфора сшиты друг с другом. Как видно из рисунка, молекулы красного фосфора значительно больше молекул белого. Он не так ядовит, достаточно устойчив и используется в производстве спичек.
Третий же аллотроп (Рис.3), чёрный фосфор, химически инертен и имеет структуру, схожую со структурой графита:
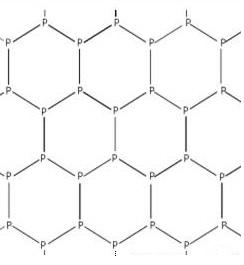
Рис.3 Чёрный фосфор
Если эти три аллотропные модификации фосфора сами по себе известны, и учёные-химики знают, что нужно сделать, чтобы превратить белый фосфор в красный, а красный – в чёрный, то механизмы таких превращений не изучались вплоть до 2014 года, когда был открыт новый вид фосфора – фосфорен (см. Han Liu et al., 2014. Phosphorene: An Unexplored 2D Semiconductor with a High Hole Mobility). Кстати, назван он так, потому что похож на небезызвестный графен. И графен, и фосфорен - это двумерные аллотропы углерода и фосфора соответственно, образованные слоем атомов толщиной всего лишь в один (!) атом (Рис.4).
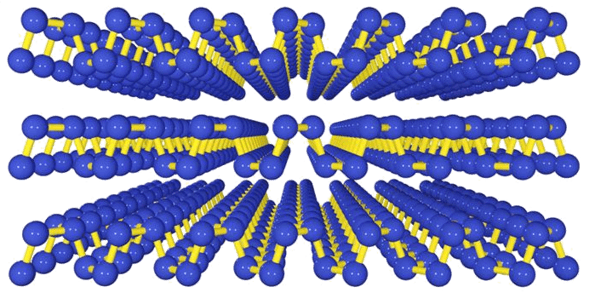
Рис 4. Фосфорен
Камнем преткновения в изучении механизмов аллотропных превращений являлась чрезвычайная химическая активность белого фосфора – он попросту самовозгорался на воздухе, образуя оксид, P4O10, который затем «набирал» из того же воздуха пары воды и образовал ортофосфорную кислоту H3PO4.
В 2009 году учёные придумали всё-таки способ погасить активность белого фосфора, спрятав его в молекулярный контейнер (см. Prasenjit Mal et al, 2009. White Phosphorus Is Air-Stable Within a Self-Assembled Tetrahedral Capsule). Этот контейнер предполагал наличие одной молекулы P4 внутри. Однако тот, факт, что для аллотропного превращения в красный фосфор, молекулы белого должны связаться друг с другом, учтён не был – контейнер не позволял это сделать.
Более результативной оказалась группа профессора Университетского колледжа Лондона Кристофа Зальцманна (Christoph G. Salzmann). В качестве контейнера они использовали одностенную углеродную нанотрубку (ОУНТ). Она представляет собой свёрнутый в трубочку листок графена (о его структуре сказано выше). Диаметр такой трубки не превышает 8,1 ангстрем. Стоит упомянуть, что1 ангстрем в 10 миллиардов раз меньше 1 метра. Такая трубка позволила изолировать белый фосфор от паров воды и, главное, от кислорода воздуха. Вместе с этим, препятствий для объединения молекул белого фосфора больше не было. Самой тонкой работой здесь являлся непосредственный процесс заполнения фосфором нанотрубки. С одного конца она была закрыта «головкой» полусферической формы. Второй конец оставался открытым. Нанотрубку длительное время держали в белом фосфоре, а затем её подвергали воздействию воздуха, который окислял ближние молекулы фосфора, таким образом закупоривая трубку.
В качестве доказательства заполненности нанотрубки использовали разные физические методы, одним из которых стала просвечивающая электронная микроскопия высокого разрешения (ПЭМВР). Она показала (Рис.5), что молекулы фосфора располагаются в нанотрубке, как горошины в стручке:

Рис 5. Расположение молекул белого фосфора P4 в нанотрубке
К тому же, пучок электронов, необходимый для формирования изображения в методе ПЭМВР, запустил процесс связывания молекул белого фосфора в единую цепь – он их «сшил». Полученную цепную структуру (Рис.6) стал новым аллотропом фосфора и получил название «розовый фосфор». Учёные предположили, что розовый фосфор является первой ступенью в механизме преобразования белого фосфора в красный.
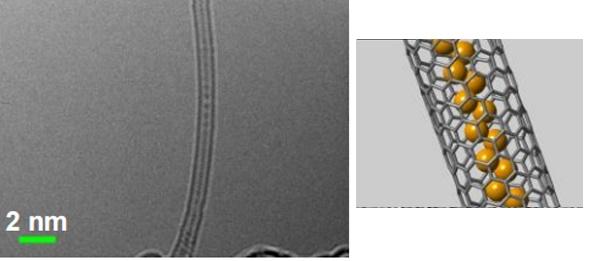
Рис 6. Полимеризация молекул P4 в нанотрубке
Интересен ещё тот факт, что по предварительным расчётам полученный аллотроп может обладать необычными электронными свойствами. Но, для выяснения и подтверждения этих расчётов, нужно придумать метод оценивания электронных свойств розового фосфора так, чтобы эффект влияния углеродной нанотрубки, которая является хорошим проводником, был исключён.
На сегодняшний момент исследователи также провели ряд компьютерных моделирований реакций с участием молекул P4 и продуктов их превращений, которые протекали бы в нанотрубках большего диаметра. Вместе с этим были выдвинуты предположения о том, какие структуры могли бы получиться из атомов углерода.
Источник: Martin Hart et al. Encapsulation and Polymerization of White Phosphorus Inside Single-wall Carbon Nanotubes // Angewandte Chemie International Edition. 2017. Accepted Author Manuscript. DOI: 10.1002/anie.201703585.
1





















Электронная тетрадь по химии 8 класс...
Химия 11 класс ФГОС
Химия 9 класс ФГОС
Химия. Вводный курс. 7 класс ФГОС
Химия 8 класс
Электронная тетрадь по химии 9 класс...
Электронная тетрадь по химии 7 класс...
Химия. Сложные вопросы
© 2017, Перес Герреро Нина Ригобертовна 1427 4
Рекомендуем курсы ПК и ППК для учителей