СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Альтерация: дистрофия, некроз.
Альтерация - патологический процесс, характеризующийся повреждением тканей и нарушением их жизнедеятельности. Морфологически альтерация проявляется дистрофией и некрозом.Альтерация сопровождается обратимымиизменениями клеток, волокнистых структур и межклеточного вещества.
Просмотр содержимого документа
«Альтерация: дистрофия, некроз.»

Повреждение
Содержание:
- Общая характеристика дистрофий;
- Паренхиматозные дистрофии;
- Мезенхимальные дистрофии;
- Смешанные дистрофии;
- Общие проявления нарушений обмена веществ;
- Некроз;
- Атрофия.
Альтерация
Это патологический процесс, характеризующийся повреждением тканей и нарушением их жизнедеятельности. Морфологически альтерация проявляется дистрофией или некрозом. Закономерности формирования альтерации те же, что и формирование тканевой дистрофии, некротических и некробиотических процессов. В определенных случаях альтерация может сопровождаться обратимыми изменениями клеток (например, мутное набухание), волокнистых структур и межклеточного вещества (мукоидное набухания). При этом отмечают ультраструктурные повреждения нуклеоплазмы и мембран ядерных оболочек, набухание митохондрий, дезорганизацию крист, просветление матрикса митохондрий, снижение мембран эндоплазматического ретикулума, количества рибосом, появление различных вкраплений в цитоплазме и др. Все указанные изменения после прекращения воздействия патогенного фактора постепенно исчезают, структура и функция клеток может восстановится.
Альтерация может возникать или вследствие непосредственного воздействия патогенного агента на ткань (холод, тепло, механическая травма, радиационное облучение), или в результате нервно-рефлекторных и гуморальных воздействий с участка первичного повреждения (например, при ожогах кожи могут возникнуть некротические и дистрофические изменения внутренних органов). Степень альтерации зависит как от силы патогенного фактора, так и реактивности тканей при сниженной резистентности организма умеренное влияние может манифестироваться неадекватно тяжелыми альтеративными изменениями тканей. Считают, что клетки паренхиматозных органов более чувствительны к патогенному воздействию, то есть раньше и легче поддаются альтерации, чем сосуды и строма.


Определение, механизмы развития и классификация дистрофий:
Дистрофия - это сложный патологический процесс, обусловленный нарушением трофики тканей, характеризующийся количественными и качественными нарушениями состава клеток или тканей, приводящих к нарушению их функций. Причинами дистрофий чаще являются интоксикация, инфекция, гипоксия или другие патологические процессы. Дистрофия является универсальным ответом организма на патологическое воздействие и может проявляться на различных уровнях: субклеточном, клеточном, тканевом, органном.
В основе дистрофий лежат 4 возможных механизма развития:
- Инфильтрация - это проникновение веществ в клетку или ткань извне, в связи с их избыточным содержанием. Появление включений в эпителии канальцев почки при протеинурии или глюкозурии.
- Трансформация - переход одних веществ в другие - например при избыточном употреблении углеводов и белков они превращаются в жиры и накапливаются в клетках или ткани.
- Декомпозиция (фанероз) - это распад сложных веществ, например липопротеидных мембран в клетке при интоксикации, с возникновением жировой и белковой дистрофии.
- Извращенный синтез - это образование и накопление в клетке или ткани веществ, которые в норме не встречаются.
Дистрофии классифицируются по различным принципам. По преимущественной локализации изменений выделяют паренхиматозные, стромально-сосудистые и смешанные дистрофии. По преимущественно нарушенному обмену веществ дистрофии могут быть белковыми, жировыми, углеводными и минеральными. По причине развития дистрофии подразделяются на приобретенные и врожденные, а по распространенности на местные и общие.



Паренхиматозные дистрофии
- характеризуются локализацией патологического процесса внутри клеток паренхимы органа. По преимущественно нарушенному обмену веществ выделяют белковые, жировые и углеводные паренхиматозные дистрофии.
Паренхиматозные белковые дистрофии: Развиваются довольно часто при гипоксии, различных инфекционных заболеваниях, интоксикациях. Однако степень повреждения клеток при этом не одинакова, и поэтому белковые дистрофии могут быть обратимыми и необратимыми. Среди паренхиматозных белковых дистрофий выделяют зернистую, гиалиново-капельную, гидропическую.
Зернистая дистрофия. Наиболее часто зернистая дистрофия возникает в клетках сердца, печени и почек. Эти органы выглядят тусклыми, набухшими, на разрезе напоминают вареное мясо. Поэтому этот вид дистрофий называют также мутным набуханием. При зернистой дистрофии в клетках происходит поверхностное, обратимое уплотнение белка (денатурация). Обычно повреждается свободный белок клеток, который образует в цитоплазме множественные небольшие зерна. Клетки при этом набухают, цитоплазма их выглядит зернистой. Набухший эпителий почечных канальцев резко суживает их просвет; в мышечных волокнах сердца исчезает поперечная исчерченность, в набухших гепатоцитах печени плохо различимы ядра. При зернистой дистрофии функция органов изменяется незначительно.

Гиалиново - капельная дистрофия характеризуется появлением внутри клеток крупных белковых капель. Чаще она возникает в почках, реже в миокарде, еще реже - в сердце. Это тяжелый необратимый вид дистрофии, всегда заканчивается коагуляционным некрозом клетки со снижением или прекращением функции органа. При поражении почек дистрофическим процессом характерно появление протеинурии, цилиндрурии, в крови возникает гипопротеинемия. В печени гиалиново-капельная дистрофия возникает чаще при алкогольном гепатите, крупные белковые зерна в цитоплазме гепатоцитов при этом получили название телец Мэллори. По сравнению с зернистой это более тяжелый вид белковой дистрофии, которая обычно развивается в почках, реже в печени и крайне редко в миокарде. При гиалиново-капельной дистрофии белок клеток изменяется более глубоко, наступает его коагуляция, он уплотняется, сливается в гомогенные капли, напоминающие основное вещество гиалинового хряща. В почках гиалиново-капельная дистрофия развивается при заболеваниях, для которых характерна потеря организмом белка.
Гидропическая дистрофия, или водяночная , характеризуется накоплением в цитоплазме клеток капель белковой жидкости. Если этой жидкости очень много и она заполняет всю клетку, вытесняя ядро на периферию, возникает крайняя степень гидропической дистрофии - баллонная, особенно характерная в гепатоцитах при вирусном гепатите. Гидропическая дистрофия - это тяжелый необратимый вид дистрофии, всегда заканчивается колликвационным некрозом клетки. Кроме печени она чаще бывает в коже, ганглиозных клетках, надпочечниках, миокарде. Ее причиной чаще являются нарушение водно-солевого обмена, гипопротеинемия, отеки, нередко возникает при инфекциях и интоксикациях. Функция органов при гидропической дистрофии значительно снижается.

Роговая дистрофия - это появление рогового вещества там, где в норме оно не встречается (слизистые оболочки), либо избыточное накопление там, где оно бывает в норме (кожа). Наиболее частыми причинами роговой дистрофии являются авитаминозы, пороки развития кожи, вирусная инфекция, хроническое воспаление. К разновидностям роговой дистрофии относят гиперкератоз (избыточное ороговение на коже, например, в виде кожного рога), ихтиоз (врожденный гиперкератоз кожи, несовместимый с жизнью), лейкоплакия (ороговение слизистых оболочек, покрытых многослойным плоским неороговевающим эпителием). Чаще лейкоплакия возникает в шейке матки, что может приводить к развитию плоскоклеточного рака. К врожденным паренхиматозным дистрофиям, обусловленным накоплением в тканях аминокислот, относят тирозиноз, цистиноз и фенилкетонурию (фенилпировиноградная олигофрения). Чаще при них поражаются печень, селезенка, костный мозг, почки и нервная система. характеризуется избыточным образованием рогового вещества в ороговевающем эпителии (гиперкератоз, ихтиоз) или образованием рогового вещества там, где в норме его не бывает. Процесс может быть местным или распространенным. Причины роговой дистрофии разнообразны: нарушение развития кожи, хроническое воспаление, вирусные инфекции, авитаминозы и др. Исход может быть двояким: устранение вызывающей причины в начале процесса может привести к восстановлению ткани, однако в далеко зашедших случаях наступает гибель клеток. Значение роговой дистрофии определяется ее степенью, распространенностью и длительностью. Длительно существующее патологическое ороговение слизистой оболочки (лейкоплакия) может явиться источником развития раковой опухоли. Врожденный ихтиоз резкой степени, как правило, несовместим с жизнью.

Паренхиматозные жировые дистрофии. Жиры (липиды и липоиды) входят в состав жиробелковых комплексов мембран клеток и внутриклеточных структур. Нарушение обмена цитоплазматического жира заключается либо в накоплении жира необычного для данных клеток состава, либо в образовании липидов в тех клетках, в которых в норме их нет. Жировые дистрофии называют еще липидозами. Обычно паренхиматозная жировая дистрофия развивается в сердце, печени и почках.Одной из основных причин этого вида дистрофии является гипоксия. При всех заболеваниях, сопровождающихся кислородным голоданием, в сердце, печени и почках развивается жировая дистрофия. Механизмы развития жировых и белковых дистрофий идентичны. Вместе с тем в разных органах имеются специфические особенности образования внутриклеточного жира.
Жировая дистрофия миокарда развивается преимущественно в результате декомпозиции жиробелковых комплексов мембран внутриклеточных структур. Однако если уровень липидов в крови значительно повышен (гиперлипидемия), преобладает механизм инфильтрации. Независимо от механизма развития патологического процесса в кар- диомиоцитах появляются вначале мелкие включения жира (пылевидное ожирение), затем они сливаются в капли (мелкокапельное ожирение), которые постепенно заполняют всю саркоплазму, сдавливая внутриклеточные структуры и приводя к их гибели. Макроскопически сердце при жировой дистрофии дряблое, полости его растянуты, на разрезе миокард тусклый, глинистого вида. Иногда на эндокарде трабекул и папиллярных мышц можно видеть желтоватые поперечные полоски. Внешне эндокард несколько напоминает шкуру тигра и поэтому такое сердце получило название «тигровое сердце». Такая картина связана с выраженным ожирением кардиомиоцитов, расположенных по ходу венул и вен, где кровь особенно бедна кислородом, и отражает состояние недостаточности сердца с резким снижением его функции.

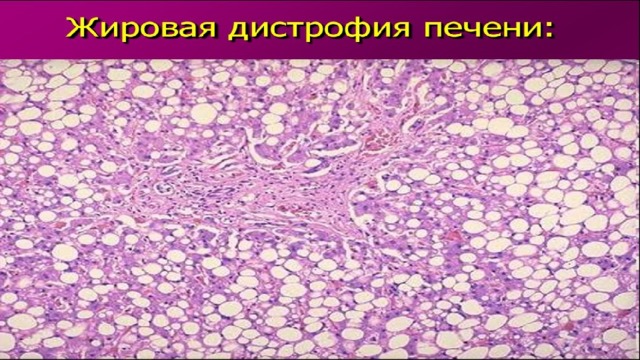
Жировая дистрофия печени развивается преимущественно по механизму инфильтрации, особенно при болезнях и патологических состояниях, сопровождающихся гипоксией и гиперлипидемией. Однако при многих инфекциях и интоксикациях, например вирусном гепатите, токсической дистрофии печени, преобладает декомпозиция — распад внутриклеточных структур с выделением из их мембран липоидов. Может иметь место трансформация. белков и углеводов в жиры, что наблюдается при хроническом алкоголизме. В цитоплазме гепатоцитов вначале появляются мелкие капли жира (мелкокапельное ожирение), затем они сливаются в крупные капли (крупнокапельное ожирение), заполняющие нередко всю цитоплазму и оттесняющие ядро к периферии гепатоцита. При этом внутриклеточные структуры постепенно погибают. Печень увеличивается в размерах, становится дряблой, на разрезе она глинистого или желтоватого цвета, функция ее резко снижается.
Жировая дистрофия почек чаще всего развивается по типу инфильтрации. В результате этого в условиях гиперлипидемии и гиперхолестеринемии (например, при атеросклерозе) клетки эпителия почечных канальцев, а иногда и стромы почек инфильтрируются большим количеством липоидов. Однако может иметь место и декомпозиция мембран внутриклеточных структур, особенно при заболеваниях, сопровождающихся нарастающей гипоксией. При жировой дистрофии почки увеличиваются в размерах, становятся дряблыми, на разрезе рисунок их виден нечетко, на поверхности почек нередко отмечается серо-желтый крап. Функция почек снижается. Исход паренхиматозной жировой дистрофии зависит от степени ее выраженности — пылевидное и мелкокапельное ожирение обратимо при ликвидации вызвавшей его причины, крупнокапельное ожирение может закончиться гибелью клеток.

Паренхиматозные углеводные дистрофии. Данная дистрофия возникает при нарушении обмена полисахаридов (гликогена) и гликопротеидов (муцины и мукоид). Нарушение обмена гликогена проявляется его накоплением в эпителии канальцев почки (при сахарном диабете), органах ретикуло-эндотелиальной системы при гликогенозах (тезаурисмозах), самые частые из которых - болезнь Гоше, Андерсена, Помпе, Мак-Ардля и другие. Все углеводы, которые находятся в организме, можно разделить на полисахариды (самым распространенным из которых является гликоген), гликозаминогликаны (мукополисахариды: гиалуроновая и хондроитинсерная кислоты, гепарин) и гликопротеиды. Паренхиматозные углеводные дистрофии связаны, как правило, с нарушением обмена гликогена и гликопротеидов.
Гликоген – это запасы организма на «черный голодный день». Основную их часть он хранит в печени и мышцах и расходует эту энергию очень экономно. Гликоген в норме находится в том или ином количестве' почти во всех клетках и тканях организма. Однако главные его запасы сосредоточены в печени и скелетных мышцах; достаточно много гликогена и в мышце сердца. В регуляции уровня гликогена в тканях важная роль принадлежит клеткам островкового аппарата поджелудочной железы, в которых синтезируется инсулин. При сахарном диабете в результате нарушения образования инсулина глюкоза недостаточно усваивается клетками, повышается ее концентрация в крови (гипергликемия) и в моче (глюкозурия). Наблюдающееся при этом уменьшение запаса гликогена в печени сопровождается усиленной инфильтрацией гепатоцитов липидами и развитием в них жировой дистрофии. Высокое содержание глюкозы в моче приводит к инфильтрации углеводами эпителия дистальных сегментов почечных канальцев и синтезу в них гликогена. Эпителий канальцев при этом повреждается, становится светлым, при специальных методах окрашивания в нем выявляются гранулы и капли гликогена.
Глюкопротеиды входят в состав многих, в том числе слизистых веществ (муцины и мукоиды), образующихся в железах слизистых оболочек. При нарушении обмена глюкопротеидов муцины и мукоиды накапливаются в эпителии желез, при этом обычно густой слизью закрываются их протоки. Железы растягиваются и превращаются в полости, заполненные слизью (кисты) . В этих условиях эпителий желез погибает, а слизистая оболочка может атрофироваться. Иногда в слизистых оболочках накапливаются вещества, лишь напоминающие слизь, — псевдомуцины, которые уплотняются, становятся тягучими, похожими на коллоид. Развивается коллоидная дистрофия. Такое явление наблюдается в щитовидной железе при коллоидном зобе, когда его фолликулы переполняются и растягиваются коллоидом, пропитывающим и строму железы. Гликозамингликаны и глюкопротеиды определяют с помощью ряда методов, из которых наиболее часто применяют окраски толуидиновым синим или метиленовым синим. Эти окраски выявляют хромотропные вещества, дающие реакцию метахромазии. Обработка срезов ткани гиалуронидазами (бактериальной, тестикулярной) с последующей окраской теми же красителями позволяет дифференцировать различные гликозамингликаны. Главными представителями глюкопротеидов являются муцины и мукоиды. Муцины составляют основу слизи, продуцируемой эпителием слизистых оболочек и железами. Мукоиды входят в состав многих тканей; они в большом количестве имеются в эмбриональных тканях, сохраняясь в пупочном канатике у новорожденных.
Причиной нарушения обмена глюкопротеидов является воспаление слизистых оболочек. При достаточно быстрой ликвидации воспаления удается предотвратить атрофию слизистых и обеспечить их восстановление.
Мезенхимальные дистрофии
Стромально-сосудистые (мезенхимальные) дистрофии развиваются в результате нарушений обмена веществ в соединительной ткани и выявляются в строме органов и стенках сосудов. В зависимости от вида нарушенного обмена веществ их делят на белковые, жировые и углеводные. К диспротеинозам относятся мукоидное набухание, фибриноидное набухание, гиалиноз и амилоидоз. Мукоидное набухание, фибриноидное набухание и гиалиноз являются последовательными стадиями дезорганизации соединительной ткани. Амилоидоз отличается от этих процессов тем, что в основе его лежит синтез аномального белково-полисахаридного комплекса.
Мукоидное набухание - поверхностная и обратимая дезорганизация соединительной ткани. При этом в основном веществе соединительной ткани происходит накопление и перераспределение глюкозамингликанов (ГАГ). Накопление ГАГ приводит к появлению метахромазии. Метахромазия - это свойство менять цвет красителя. Так, при окраске гематоксилин-эозином соединительная ткань красится не в розовый, а в синеватый цвет, толуидиновым синим - в розовый. Под влиянием различных патогенных факторов в нем происходят накопление и перераспределение гликозаминогликанов, которые обладают свойством притягивать воду (гидрофильность). При мукоидном набухании происходит разволокнение соединительной ткани, но структура самих коллагеновых волокон не изменяется, поэтому этот вид дистрофии обратим, если ликвидировать вызвавшую ее причину. Органы внешне не изменены, функция их незначительно снижается. Макроскопически орган при мукоидном набухании не изменяется. Поверхностная дезорганизация соединительной ткани может заканчиваться восстановлением структуры ткани или переходом в фибриноидное набухание.

Фибриноидное набухание - это глубокая необратимая дезорганизация соединительной ткани, которая может завершаться некрозом, гиалинозом или склерозом. Чаще мукоидное и фибриноидное набухание встречается в клапанах сердца при ревматических болезнях, но может возникнуть также при интоксикации, инфекции и так далее.
Фибриноид. Этот вид белковой мезенхимальной дистрофии является этапом, следующим за мукоидным набуханием Нарастает гидрофильность соединительной ткани, и она притягивает к себе из крови воду. Вследствие повышения проницаемости сосудов плазма, содержащая белки, в том числе такие, как фибриноген, выходит в интерстициальную ткань. Происходит накопление гликозаминогликанов, фибрина и других белков плазмы крови не только в основном веществе соединительной ткани, но и в коллагеновых волокнах, которые вначале также набухают (фибриноидное набухание), а затем разрушаются. Остатки коллагеновых волокон вместе с набухшим и резко измененным основным веществом превращаются в гомогенную, рыхлую, бесструктурную массу (фибриноидный некроз). На всех стадиях фибриноида необратимо страдают и основное вещество, и волокна соединительной ткани. Увидеть фибриноидные изменения можно только в световой или электронный микроскоп. Вместе с тем функция органов при этом резко нарушается. Например, при фибриноидном некрозе капилляров почечных клубочков почки перестают функционировать. Развивается острая почечная недостаточность, которая может привести больного к смерти. Заканчивается фибриноид либо склерозом, т. е. замещением погибшей интерстициальной ткани грубоволокнистой соединительной тканью, либо гиалинозом.
Гиалиноз. В результате этой дистрофии образуются и накапливаются в ткани однородные полупрозрачные массы (гиалин), напоминающие гиалиновый хрящ. Гиалин - это фибриллярный белок в сочетании с белками плазмы крови, фибрином, иммунными комплексами. Внешне гиалин гомогенный, блестящий, светлый, напоминает гиалиновый хрящ. Гиалиноз считают местным, если он образуется в участках фибриноидного некроза, например в клапанах сердца при ревматизме. Распространенной считают такую форму, при которой гиалиноз развивается в артериолах всех органов, но прежде всего головного мозга, сердца и почек при гипертонической болезни. В зависимости от преимущественной локализации процесса различают гиалиноз сосудов и гиалиноз собственно соединительной ткани. Учитывая причину развития гиалиноза, можно выделить такие его разновидности, как гиалиноз в исходе фибриноидного набухания, плазматического пропитывания, хронического воспаления, некроза, склероза. По распространенности гиалиноз подразделяют на системный и местный.
Системный гиалиноз чаще возникает при фибриноидном набухании и плазматическом пропитывании. Местный гиалиноз чаще встречается при хроническом воспалении, склерозе и некрозе. При гиалинозе сосудов обычно страдают мелкие артерии и артериолы, и он развивается в исходе плазматического пропитывания. Гиалиноз сосудов обычно носит системный характер, но в большей степени при этом характерно поражение почек, головного мозга, сетчатки глаз, поджелудочной железы и кожи. Особенно характерен гиалиноз сосудов для гипертонической болезни, симптоматической гипертонии, сахарном диабете и аутоиммунных заболеваниях. Гиалиноз собственно соединительной ткани развивается обычно в исходе фибриноидного набухания при ревматических болезнях. В большинстве случаев исход гиалиноза неблагоприятный, но возможно и рассасывание гиалиновых масс (гиалиноз молочных желез при лактации и в келлоидных рубцах на коже).
Амилоидоз - это мезенхимальный диспротеиноз, сопровождающийся образованием в мезенхиме сложного вещества, который характеризуется образованием на базальных мембранах слизистых оболочек, сосудов, а также в интерстициальной соединительной ткани особого, очень прочного вещества, состоящего на 96 % из белка, а на 4 % из углеводов и «гематогенных добавок» — различных химических веществ белковой природы из плазмы крови и тканей. Образовавшееся вещество носит название «амилоид» и в норме у человека не встречается. В связи с тем что амилоид обладает слабыми антигенными свойствами, иммунная система человека не воспринимает это новое для организма вещество как чужеродное и не реагирует на него. В результате амилоид беспрепятственно накапливается в тканях, сдавливает и разрушает их структуры. Органы, пораженные амилоидозом, увеличиваются в размерах, становятся плотными, ломкими, а на разрезе имеют сальный вид. Амилоидоз может развиваться почти во всех органах и тканях, за исключением костной и хрящевой. Но особенно часто амилоид откладывается в селезенке, почках, печени и надпочечниках. В селезенке амилоид появляется вначале в лимфоидных фолликулах, и на разрезе ткань ее приобретает вид как бы усеянной белесоватыми мелкими зернами саго, в связи, с чем называется «саговой» селезенкой. Нередко амилоид откладывается равномерно по всей пульпе селезенки, и тогда на разрезе она приобретает сальный вид — «сальная» селезенка. Большое значение в клинике имеет амилоидоз почек. Амилоидные массы откладываются вначале в стенках сосудов паренхимы почек, капилляров клубочков, затем в базальных мембранах канальцев и, наконец, в строме органа. Постепенно функциональные структуры почек полностью замещаются амилоидом, почка сморщивается, развивается амилоидный нефроз, и почки перестают функционировать. Амилоидоз является необратимым состоянием.



Классификация амилоидоза . В зависимости от химического состава, по виду F - компонента выделяют несколько видов амилоида: АА (при некоторых наследственных формах, а также при вторичном амилоидозе), AL (при первичном амилоидозе, миеломной болезни), FAP (семейном амилоидозе), AS (старческом амилоидозе). По этиологии выделяют первичный (идиопатический), наследственный (генетический, семейный), вторичный (приобретенный), и старческий амилоидоз. Для первичного амилоидоза характерно отсутствие предшествующего заболевания, преимущественное поражение мезодермальных тканей (сердечно-сосудистой системы, мышц, нервов и кожи), генерализованный характер, непостоянство красочных реакций, склонность к образованию узловатых отложений амилоида.
Наследственный амилоидоз характеризуется предрасположенностью к амилоидозу определенных этнических групп населения, по клинико-морфологическим проявлениям он близок к первичному амилоидозу. Вторичный амилоидоз возникает как осложнение какой-то болезни, например, хронической инфекции (особенно туберкулез), болезней с гнойно-деструктивными процессами (ХОБЛ, остеомиелит, нагноение ран), злокачественных новообразований, ревматических болезней (особенно ревматоидный артрит). Вторичный амилоидоз наиболее часто является паренхиматозным и поражает такие органы, как селезенка, почки, печень, надпочечники, кишечник. При старческом амилоидозе преимущественно поражается сердце, головной мозг и поджелудочная железа (триада Шварцмана).
По распространенности выделяют генерализованную и локальную формы амилоидоза. С учетом пораженных органов и систем различают 7 типов амилоидоза: а) кардиопатический; б) нефропатический; в) эпинефропатический; г) нейропатический; д) гепатопатический; е) смешанный; ж) АПУД - амилоидоз (возникает в органах АПУД - системы при развитии в них опухолей).
Стромально-сосудистые жировые дистрофии возникают при нарушении обмена нейтральных жиров или холестерина и его эфиров. Нарушение обмена холестерина проявляется чаще атеросклерозом, который поражает крупные артерии. Нарушение обмена нейтральных жиров чаще проявляется увеличением запаса жира в жировых депо. Это может носить общий и местный характер. Общее увеличение нейтрального жира называется ожирением или тучностью. По этиологическому принципу ожирение разделяют на первичное (причина не установлена) и вторичное. Вторичное ожирение подразделяется на алиментарное (несбалансированное питание, гиподинамия), церебральное (развивается при травме головного мозга, опухолях головного мозга), эндокринное, наследственное.
Наибольшее значение в патологии имеет общее увеличение нейтрального жира в организме, называемое общим ожирением, или тучностью. Причиной этого могут быть нейроэндокринные расстройства регуляции жирового обмена при ряде заболеваний ЦНС (травма или опухоль головного мозга), поражения гипофиза и других желез внутренней секреции, а также избыточное питание. Это может является причиной алиментарного ожирения, которое может развиваться и при нарушениях усвоения нейтрального жира, например при алкоголизме, малоподвижном образе жизни. Важное значение в патологии имеет ожирение сердца, при котором жир в избыточном количестве откладывается под эпикардом и между пучками мышечных волокон, особенно правых отделов сердца. Сдавленные жиром мышечные волокна атрофируются, истончаются, функция миокарда резко снижается, может даже произойти разрыв стенки правого желудочка сердца. Нарушение обмена холестерина заключается в очаговом накоплении его в интиме крупных сосудов, что лежит в основе атеросклероза.

При местном увеличении количества жировой клетчатки говорят о липоматозах. Среди них наибольший интерес представляет болезнь Деркума, которая является следствием полигландулярной эндокринопатии и сопровождается появлением в подкожной клетчатке узловатых, очень болезненных отложений жира. Уменьшение запаса жира в жировом депо также может носить общий и местный характер. Общее уменьшение количества жира называется истощением или кахексией.
Мезенхимальные углеводные дистрофии связаны с нарушением обмена гликопротеидов и ГАГ. Мезенхимальную дистрофию, связанную с нарушением обмена гликопротеидов, называют ослизнением тканей. Этот вид дистрофий связан в основном с нарушением обмена глюкопротеидов и проявляется развитием на месте соединительной ткани, хрящей, жировой клетчатки густой слизеподобной массы. Такая дистрофия называется мезенхимальной слизистой дистрофией и связана с нарушением функции эндокринных желез. Типичным примером является слизистый отек — микседема — при недостаточности щитовидной железы. Ослизнение тканей может наблюдаться и при резком истощении организма — кахексии. В отличие от мукоидного набухания, при этом происходит замещение коллагеновых волокон слизеподобной массой. Наиболее частыми причинами ослизнения являются дисфункция эндокринных желез (микседема) или кахексия различного генеза. Гистион - структурная единица соединительной ткани. Она состоит из микроциркуляторного русла и окружающей микроциркуляторное русло соединительной ткани с различными соединительнотканными клетками и нервными элементами. В области гистиона осуществляются функции питания соответствующего региона паренхимы. Это- подвоз питательных продуктов и удаление вредных метаболитов. Следовательно, на уровне гистиона осуществляется структурно-функциональное единство паренхимы и мезенхимы. При ней повреждаются структуры межклеточного вещества, волокна, цементирующая субстанция и клетки.
Смешанные дистрофии
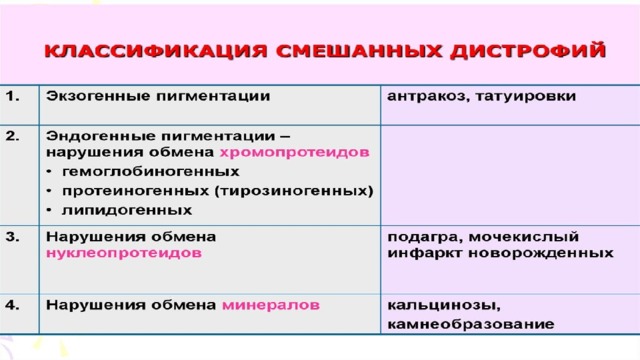
Они возникают при нарушении обмена сложных белков - хромопротеидов, нуклеопротеидов, липопротеидов, а также минеральных веществ. Нарушение обмена хромопротеидов:
Хромопротеиды - окрашенные белки или эндогенные пигменты, по происхождению делятся на гемоглобиногенные, протеиногенные или тирозиногенные (связанные с обменом тирозина), липидогенные. К гемоглобиногенным пигментам относятся пигменты, образующиеся в физиологических условиях: гемосидерин, ферритин и билирубин. В условиях патологии, кроме упомянутых пигментов, образуются гематоидин, гематины, порфирин. Ферритин содержится практически во всех органах и тканях, увеличивается его количество при шоке, что способствует падению артериального давления. Гемосидерин - продукт полимеризации ферритина, образуется в очагах кровоизлияний. Например, в легких при митральном пороке сердца, вследствие венозного застоя и кровоизлияний, происходит накопление гемосидерина, возникает склероз, что проявляется развитием бурой индурации легкого.
Системное накопление гемосидерина , обусловленное нарушением всасывания пищевого железа в тонкой кишке, характерно для гемохроматоза. При этом развивается гемосидероз печени, поджелудочной железы, надпочечников и др. У больных появляется бронзовая окраска кожи, сахарный диабет, пигментный цирроз печени. К гематинам относятся малярийный пигмент (гемамеланин) - накапливается в селезенке, лимфоузлах, костном мозге при малярии, и они становятся серого (дымчатого) цвета; соляно-кислый гематин (гемин) - образуется исключительно в желудке при язвах и эрозиях; формалиновый пигмент - образуется в тканях при фиксации кислым формалином.
Псевдомеланин - пигмент черного цвета, образуется при соединении железа с сероводородом, поэтому встречается в толстой кишке (дно язв) или коже (при гангрене). Гематоидин - пигмент, не содержащий железа, образуется без участия кислорода, поэтому определяется в центральных участках крупных гематом.
Билирубин - не содержит железа, его накопление приводит к желтухе. В зависимости от причины развития, различают надпеченочную, печеночную и подпеченочную (механическую) желтухи. Надпеченочная желтуха развивается в связи с усиленным внутрисосудистым гемолизом при инфекциях, болезнях крови (анемии, гемобластозы), переливании иногруппной крови и т.д.
Печеночная желтуха возникает при болезнях печени: гепатите, циррозе, раке. Причиной подпеченочной желтухи является нарушение оттока желчи, обусловленное камнями, раком желчных путей, раком головки поджелудочной железы и фатерова соска, метастазами рака в лимфоузлы ворот печени и др. К наиболее важным протеиногенным пигментам относится меланин. Синтез его происходит в меланоцитах, которые находятся в эпидермисе, сетчатке и радужке глаз, мягких мозговых оболочках, надпочечнике и слизистой толстой кишки. Общее приобретенное накопление меланина характерно для болезни Аддисона. Заболевание возникает при двустороннем поражении коры надпочечников и уменьшении выброса ими гормонов.
Врожденное системное накопление меланина характерно для пигментной ксеродермы. Местный гипермеланоз чаще наблюдается в невусах, меланомах и при меланозе толстой кишки. Системное уменьшение содержания меланина характерно для альбинизма. Местный гипомеланоз встречается в виде белых пятен на коже, получил название витилиго или лейкодерма.

Гемоглобиногенные пигменты. В физиологических условиях постоянно происходит гемолиз эритроцитов. В результате этого их красящее вещество — гемоглобин — распадается на белок — глобин и протопорфирин железа — гем. Железо либо сохраняется в геме, либо покидает его. Таким образом в норме в крови и тканях появляются две группы гемоглобиногенных пигментов — содержащих и не содержащих железо. Железо, вышедшее из гема, соединяется с цитоплазмой клеток ретикуло- эндотелиальной системы (РЭС), макрофагов и образует 2 пигмента — гемосидерин и ферритин. Вместе с тем гем, лишенный железа, образует в клетках РЭС пигмент билирубин. В условиях патологии (некоторые инфекции, интоксикации, переливание несовместимой крови, анемии, переохлаждение организма, ожоговая болезнь) резко усиливается гемолиз эритроцитов, в связи с чем в избытке образуются гемоглобиногенные пигменты. «Обломки» эритроцитов, гемоглобин захватываются эндотелиальными клетками сосудов, ретикулярными клетками, гистиоцитами селезенки, печени, костного мозга, лимфатических узлов, эндотелиальными клетками легких, почек, желез, а также различными макрофагами, имеющимися в каждом органе. В этих клетках образуются гемосидерин и ферритин, в связи с чем органы приобретают ржаво-коричневую окраску. Развивается гемосидероз отдельных органов или общий (распространенный) гемосидероз. Если разрушение эритроцитов происходит не в просвете сосуда, а вне его (кровоизлияние в ткани), возникает местный гемосидероз. При этом гемоглобин захватывается в основном макрофагами, в них образуются гемосидерин и ферритин. Такие макрофаги называются сидерофагами. Они в большом количестве присутствуют в гематомах, в участках кровоизлияний. Сидерофаги выявляются в тканях с помощью реакции Перлса — образования берлинской лазури. При этом все клетки, содержащие железо, окрашиваются в голубой цвет. Большое значение в клинике имеет местный гемосидероз легких, так называемая бурая индурация легких.
В условиях патологии могут появляться два гемоглобиногенных пигмента, не встречающиеся в норме. Солянокислый гематин, бурого цвета, образуется при соединении гемоглобина с соляной кислотой желудочного сока при желудочных кровотечениях, возникающих как осложнение язвенной болезни желудка или острых эрозивных гастритов. Наличие солянокислого гема- тина в рвотных массах придает им характерный вид «кофейной гущи», который позволяет заподозрить желудочное кровотечение. Малярийный пигмент (гемомеланин) появляется в циркулирующей крови в результате распада эритроцитов, пораженных паразитирующими в них плазмодиями малярии. Гемомеланин захватывается клетками РЭС, в результате чего ткани селезенки, печени, костного мозга, лимфатических узлов, головного мозга приобретают пепельную окраску. В нормальных условиях при распаде эритроцитов и потере гемом железа в результате сложных химических реакций в печени образуется пигмент билирубин, входящий в состав желчи. При нарушении образования или выделения билирубин накапливается в крови и окрашивает все ткани в желтый цвет. Возникает желтуха. Различают три вида желтухи. Первая — надпеченочная, связанная с повышенным образованием билирубина в связи с чрезмерным внутрисосудистым гемолизом эритроцитов при сепсисе, возвратном тифе и других инфекциях, интоксикациях гемолитическими ядами, иммунных нарушениях. Такую желтуху еще называют гемолитической. Вторая — печеночная (паренхиматозная), возникающая при поражении гепатоцитов и потере ими способности обеспечивать образование билирубина. Такая желтуха появляется при гепатитах, циррозе печени, иногда при беременности. Третья — подпеченочная (механическая), связанная с нарушением проходимости желчных протоков, например в результате, их закупорки камнями при желчнокаменной болезни или сдавления опухолью. При этом желчь застаивается в печени, желчные капилляры разрываются и желчь попадает в кровь.
Тирозиновые пигменты. В группе тирозиновых (протеиногенных) пигментов наибольшее значение имеет нарушение обмена меланина. Этот буро-черный пигмент в норме содержится в радужке глаз, волосах, коже, пищеварительном тракте, придавая им соответствующую окраску. Меланин защищает организм от ультрафиолетовых лучей. Ультрафиолетовые лучи стимулируют образование меланина в коже, появляется загар. Меланин образуется из аминокислоты тирозина под действием фермента тирозиназы в клетках-меланобластах. Обмен меланина регулируется вегетативной нервной системой, а также гипофизом, подпочечниками, половыми железами. Как проявление патологии наблюдается распространенный мел а н о з кожи при кахексии, развивающейся вследствие истощающих заболеваний, тяжелых авитаминозов, туберкулезного или опухолевого поражения надпочечников. В последнем случае развивается аддисонова болезнь, при которой кожные покровы приобретают бронзовый оттенок. К местным меланозам относятся так называемые родимые пятна, или невусы, на коже. Из невусных клеток может развиться злокачественная опухоль — меланома. Наследственное заболевание, при котором в коже, волосах, сетчатке и радужке глаз отсутствует меланин, называется альбинизм, а такие люди или животные—альбиносами У них очень белые кожа, волосы, а радужки глаз красные. После воспалительных поражений на коже могут появляться лишенные пигмента участки белого цвета, называемые лейкодермой.
Липидогенные пигменты. Среди липидогенных пигментов наибольшее значение имеют липофусцин и его разновидности — гемофусцин, цироид, липохромы. Липофусцин представляет собой сложное соединение, в котором преобладают жиры. Он образуется в клетках печени, почек, миокарда, скелетных мышц, симпатических ганглиев в виде бурых зерен вблизи ядра или на периферии клетки. Считают, что при недостаточном обеспечении тканей кислородом липофусцин способствует нормальному течению окислительно-восстановительных процессов в клетках.

Нарушение обмена нуклеопротеидов: Нуклеопротеиды построены из белка и нуклеиновых кислот - ДНК и РНК. Конечные продукты нуклеинового обмена - мочевая кислота и её соли, выводятся почками, что проявляется в избыточном образовании мочевой кислоты, солей и отложением их в тканях. К нарушениям обмена нуклеопротеидов относятся подагра, мочекаменная болезнь и мочекислый инфаркт. Подагра характеризуется поражением мелких суставов с образованием в них подагрических шишек, суставы при этом деформируются. Часто поражаются почки («подагрическая почка») и больные умирают от уремии.
Мочекислый инфаркт встречается у новорожденных, проживших не менее 2 суток, обусловлен массивным распадом ядер клеток при переходе из внутриутробных во внеутробные условия жизни, и проявляется выпадением в почках солей мочекислого натрия.
Нуклеопротеиды построены из белка и нуклеиновых кислот — дезоксирибонуклеиновой (ДНК) или рибонуклеиновой (РНК). ДНК содержится в ядре, являясь основой хромосом, а РНК — в ядрышке и цитоплазме клеток. При распаде нуклеопротеидов, помимо белка и ряда других соединений, образуются пуриновые основания, превращающиеся в мочевую кислоту. Последняя выделяется с мочой. Содержание мочевой кислоты в моче возрастает при заболеваниях, сопровождающихся усиленным распадом ядер клеток (гнойные воспалительные процессы, лейкозы) На ее содержание и обмен в организме оказывает влияние богатая пуринами пища — мясо, икра, яйца. При нарушении обмена нуклеопротеидов может развиться ряд заболеваний, среди которых наибольшее значение имеют подагра и мочекислый инфаркт почек.
Минеральные дистрофии: Из минеральных веществ наиболее часто встречаются нарушения обмена кальция, что проявляется известковыми дистрофиями (кальциноз, обызвествление). Соли и их ионы принимают участие практически во всех видах обмена веществ, течении физиологических процессов и поддержании гомеостаза. Они определяют осмотическое давление крови и ее объем, обеспечивают распределение жидкости между внеклеточной и внутриклеточной средой, участвуют в поддержании кислотно-основного состояния. Проницаемость мембран, образование энергии в клетках, синтез и распад гликогена, работа мышц, нервных клеток — все эти процессы осуществляются нормально только при достаточном уровне и правильном соотношении ионов. Расстройства минерального обмена возникают либо в результате изменения поступления солей в организм, либо при нарушении их выведения, а также при расстройстве распределения ионов между внутриклеточной и внеклеточной средой. Наибольшее значение в жизнедеятельности организма имеют соли натрия, калия и кальция.
Нарушение обмена натрия. Натрий в основном обусловливает осмотическое давление плазмы. Он постоянно выводится с мочой, потом и другими экскретами, поэтому для восполнения его содержания необходимо постоянное поступление извне. Нарушения обмена натрия проявляются либо увеличением (гипернатриемия), либо уменьшением (гипонатриемия) его концентрации в крови.
Гипернатриемия возникает при избыточном поступлении натрия в организм с пищей, введении гипертонического раствора хлорида натрия, соды (бикарбоната натрия). Гипернатриемия может возникать при снижении выведения натрия из организма в случае усиления образования альдостерона, например, при поражении надпочечников. Гипернатриемия может привести к серьезным нарушениям жизнедеятельности. В частности, в связи с повышением нервно-мышечной возбудимости развиваются судорожные состояния.

Гипонатриемия встречается при дефиците натрия в пище и усиленной потере его, например, в случае недостаточной выработки альдостерона, при сильном потоотделении, нарушениях функции почек, при тяжелом поносе. Для гипонатриемии характерны появление мышечной слабости, нарушение чувствительности, гипотония, расстройства функции пищеварительного тракта (диспепсические явления). Снижение осмотического давления плазмы крови может привести к усиленному поступлению воды из сосудов в ткани и развитию отека.
Нарушение обмена калия. Калий также участвует в регуляции жизненно важных функций — процессах возбуждения и торможения в нервной системе, синтезе гликогена и белков, обмене натрия и поддержании кислотно-основного состояния. Регуляция обмена калия, как и натрия, осуществляется минералокортикоидами, прежде всего альдостероном, который способствует задержке в организме ионов Na + и выделению ионов К + Калий содержится в основном в цитоплазме, и в отличие от натрия его содержание в тканевой жидкости и в крови невелико. Нарушения обмена калия проявляются гиперкалиемией и гипокалиемией.
Гиперкалиемия возникает при избыточном поступлении калия в организм с пищей и лекарственными препаратами, при нарушении выделения калия почками. Важное значение в развитии гиперкалиемии имеют распад клеточных мембран и выход калия из клеток в кровь. Такое явление возникает при тяжелой гипоксии, травмах, гемолизе эритроцитов, коматозном состоянии. Гиперкалиемия приводит к временному повышению, а затем падению нервно-мышечной возбудимости, нарушению некоторых видов чувствительности. Характерны снижение артериального давления и частоты сердечных сокращений, спастические сокращения желудка, кишечника и желчного пузыря, сопровождаемые болью.

Гипокалиемия возникает при дефиците калия в пище, усиленном выделении его почками, при значительном разведении плазмы крови во время введения физиологического раствора и раствора глюкозы. При гипокалиемии нервно-мышечная возбудимость падает; наблюдаются угнетение рефлексов, мышечная слабость, снижение моторики пищеварительного тракта, тонуса мочевого пузыря. Часто возникают нарушения ритма сердца.
Нарушение обмена кальция. Нарушение обмена кальция имеет огромное значение в патологии, так как кальций является необходимым компонентом многих метаболических и физиологических процессов. Он принимает участие в работе митохондрий и выработке энергии, определяет проницаемость биологических мембран, участвует в деятельности нейронов, мышц и синапсов, является важнейшим фактором свертывания крови. Основное депо кальция — кости. Уровень кальция в плазме крови и его обмен регулируются двумя гормонами — паратгормоном, который вырабатывается паращитовидными железами, и тирокальцитонино, который образуется в щитовидной железе. Уровень ионов Са 2+ в плазме крови под влиянием паратгормона увеличивается. Тирокальцитонин, напротив, тормозит выход ионов Са 2+ из костей и снижает его уровень в плазме крови. Нарушения обмена кальция проявляются гиперкальциемией и гипокальциемией.
Гиперкальциемия может возникать при избыточном введении кальция с лекарственными препаратами, при усиленном выходе ионов Са 2+ из костей и повышении его всасывания в пищеварительном тракте в случае увеличения функции пара щитовидных желез. Гиперкальциемия может развиваться также при гипервитаминозе D и злокачественных опухолях костей, сопровождающихся их распадом. Гиперкальциемия приводит к снижению нервно-мышечной возбудимости, угнетению и блокаде произвольных движений (паралич).


Дистрофическое обызвествление обычно связано с некробиотическими и некротическими изменениями тканей, что сопровождается их «ощелачиванием». Соли кальция, хорошо растворяясь в кислой среде, в щелочной среде не растворяются и выпадают из растворов. Именно это явление лежит в основе дистрофического обызвествления тромбов, особенно в венах («венные камни»), образования очагов творожистого некроза органов при туберкулезе (петрификаты), в тканях и оболочках погибшего плода («каменный плод»), в некоторых опухолях матки. Участки дистрофического обызвествления макроскопически выглядят в виде белесоватых плотных очагов, с трудом разрезаются ножом, вокруг них разрастается соединительная ткань.
Метастатическое обызвествление связано с переносом кровью солей кальция из их депо в костях в различные органы и ткани. Такое состояние обмена кальция возникает при нарушениях его регуляции, например при гипервитаминозе D, гиперфункции пара щитовидных желез в случае возникновения в них опухоли. Кальций перенасыщает кровь и в случае обширных деструктивных процессов в костях, например при их опухолях, остеомиелите.
Гипокальциемия возникает при снижении потребления кальция с пищей и ослаблении его выхода из костей, усиленной потере кальция почками и снижении всасывания в кишечнике при гипофункции паращитовидных желез. Гипокальциемия приводит к резкому увеличению нервно-мышечной возбудимости и развитию судорог (тетания). Спастические сокращения мышц могут распространяться на межреберные мышцы и диафрагму, вызывать спазм голосовой щели, бронхоспазм и удушение. При недостатке витамина D в детском возрасте возникает заболевание — рахит. В патологии встречаются и другие ситуации, когда уровень кальция в крови снижен.

Камни , или конкременты, являются следствием нарушения минерального обмена. Они образуются в полых органах или выводных протоках. Камни бывают единичные и множественные, состоят из разных минеральных веществ, определяющих их цвет и плотность. Так, камни-фосфаты — белого цвета, ураты — желтого, пигментные камни — темно-коричневого или темно-зеленого цвета. Форма камней нередко отражает форму полости, в которой они образуются. В желчном пузыре камни круглые или граненые (фасетчатые), в лоханках и чашечках почек — отросчатые, в мочевом пузыре — гладкие, овальные или круглые. На распиле камни имеют либо лучистое, либо слоистое, либо лучисто-слоистое строение.
Наибольшее значение в патологии имеют камни желчного пузыря и желчевыводящих путей, которые образуются при желчнокаменной болезни, камни почек и мочеточников, появляющиеся при мочекаменной болезни. Возможно образование камней в мочевом пузыре, кишечнике (копролиты), венах (венные камни).
Образование камней происходит на фоне нарушения минерального и других видов обмена веществ при определенных местных изменениях, возникающих в органах, — нарушении секреции, застое секрета, воспалении. При этом появляется какая- либо органическая основа — комочки слизи, слущенный эпителий, на которую выпадают соли, содержащие холестерин, известь или пигмент (камни желчного пузыря), фосфаты или оксалаты (камни мочевых путей). Большую роль в образовании камней играет воспаление. Так, при желчнокаменной болезни воспаление желчного пузыря и сгущение желчи способствуют образованию камней, а последние в свою очередь, постоянно раздражая стенку желчного пузыря, поддерживают его воспаление. Значение камнеобразования велико. При мочекаменной болезни камни могут либо способствовать воспалению почки (пиелонефрит), либо, закрывая мочеточник, обусловливают развитие гидронефроза, ведущего к гибели органа.
Нарушения белкового обмена в той или иной степени имеются при всех патологических процессах и болезнях. Это понятно, если учесть, что простые и сложные белки составляют структуру субклеточных органелл и клеток, белки-ферменты определяют течение обменных процессов, а белки-рецепторы воспринимают и передают сигналы клетке из внеклеточной среды.
Общее состояние белкового обмена оценивается по азотистому равновесию. В нормальных условиях у взрослого человека количество азотсодержащих веществ, выделяемых из организма, равно их количеству, поступающему с пищей. Азотистое равновесие может изменяться, проявлением чего является положительный или отрицательный азотистый баланс. Положительный азотистый баланс возникает в том случае, если в организм поступает больше азотсодержащих продуктов, чем выделяется, т. е. когда анаболические процессы преобладают над катаболическими. Это наблюдается, в частности, при беременности, в растущем организме, при действии некоторых гормонов (анаболические гормоны) и др. Отрицательный азотистый баланс возникает в том случае, если азотсодержащих продуктов поступает меньше, чем выделяется из организма, т. е. если катаболические процессы преобладают над анаболическими. Такое явление имеет место, например, при голодании, лихорадке, действии катаболических гормонов, при потере белка почками, тяжелом поносе, при выделении белков через ожоговую поверхность и др. Расстройства белкового обмена могут возникать на этапе переработки пищевых продуктов в пищеварительном тракте, в процессе межуточного обмена и при выведении конечных продуктов распада белков. Тяжелые расстройства белкового обмена возникают при дефиците его в пище, нарушении переваривания пищевых продуктов и всасывания аминокислот. Полное голодание, несбалансированная по аминокислотному составу пища, нарушение секреторной и моторной функции пищеварительного тракта являются причинами алиментарной белковой недостаточности.

При распаде белка происходит образование конечных азотсодержащих продуктов — аммиака, мочевины и мочевой кислоты с последующим их выведением из организма. Одним из важных продуктов распада белка является нетоксичная мочевина, которая образуется главным образом в печени из токсичного аммиака. Гиперазотемия за счет других азотистых продуктов, особенно аммиака и его производных, возникает и при нарушении функции печени.
Гипопротеинемия, как правило, возникает при уменьшении концентрации альбуминов, которые образуются в печени. Это может быть следствием голодания, нарушения функций самой печени, при расстройствах всасывания белков в кишечнике, а также при потере белка почками, выходе его на ожоговую поверхность кожи, переходе альбуминов в ткань в случае резкого увеличения проницаемости капилляров. Гипопротеинемия за счет альбуминов приводит к снижению онкотического давления крови по сравнению с тканями и развитию отеков. Она может отражаться на реологических свойствах крови и изменять микроциркуляцию.
Гиперпротеинемия возникает обычно при увеличении содержания глобулинов при воспалительных процессах, аллергии, инфекционных заболеваниях. Диспротеинемия возникает часто. При многих патологических процессах, особенно воспалительных и инфекционных, имеют место снижение уровня альбуминов и увеличение содержания глобулинов в плазме крови. При ряде заболеваний иммунной системы, а также при некоторых формах опухолей в крови появляются качественно измененные иммунные белки. Их называют парапротеинами. Важное значение в патологии имеет изменение концентрации белков свертывающей и противосвертывающей систем крови. В частности, уменьшение в плазме крови уровня фибриногена приводит к кровоточивости, а увеличение в ней уровня фибриногена вызывает повышение свертываемости крови и тромбообразование.

Нарушение липидного обмена. Жиры, или липиды, являются основным компонентом всех биологических мембран и определяют их проницаемость. Липиды участвуют в создании межклеточных контактов, поскольку обладают свойствами изолятора. Они являются источником синтеза ряда гормонов и биологически активных веществ. Липиды составляют устойчивый энергетический резерв организма в отличие от лабильного резерва, которым является гликоген. Нарушение липидного обмена может происходить на всех этапах трансформации жиров в организме. В кишечнике их расщепление во многом зависит от фермента поджелудочной железы — липазы, а также от желчи, которая активирует этот фермент.
Желчь способствует дроблению крупных жировых капель на мелкие (эмульгирование), обеспечивает транспорт жирных кислот через стенку кишки (всасывание). В том случае, если отсутствует липаза или желчь, жиры не расщепляются, не всасываются и выделяются с калом. Хотя ткани могут синтезировать собственные жиры, однако среди жирных кислот есть ненасыщенные, которые являются незаменимыми и не синтезируются в организме. При их отсутствии развиваются некрозы кожи и другие расстройства. Синтезированные в кишечной стенке собственные жиры поступают в лимфу, а из нее в кровь.
Нарушение процессов жирового обмена проявляется увеличением уровня липидов в крови — гиперлипидемией. Гиперлипидемия возникает при повышенном поступлении жиров с пищей, усиленной мобилизации жира из депо, как это бывает при гипоксии и голодании. Она возникает также при нарушениях перехода жиров в ткани, что имеет место при сахарном диабете, атеросклерозе и других заболеваниях. Важное значение в патологии имеет нарушение промежуточного обмена жиров. Поступающие в клетку жирные кислоты могут расщепляться и использоваться для синтеза глюкозы, холестерина, а также утилизироваться в цикле трикарбоновых кислот.

Нарушение углеводного обмена. Углеводы, простые и сложные сахара, входят в состав таких соединений, как АДФ и АТФ, физиологически активных веществ, в частности гепарина. В форме гликозоаминогликанов они являются составной частью мембран клеток и субклеточных структур, а также межклеточного вещества. Сахара участвуют в дезинтоксикации организма, формировании аппетита (глюкоза) и других функциях. Углеводы являются важнейшим субстратом, из которого синтезируется энергия в форме АТФ. Мозг утилизирует только глюкозу и при ее недостатке нарушаются структура и функция нейронов. Нарушения обмена углеводов могут происходить на всех его этапах — от расщепления и всасывания в пищеварительном тракте до утилизации простых сахаров в тканях. Всасывание глюкозы в кишечнике осуществляется с помощью определенных ферментов, активность которых регулируется различными гормонами. Например, при недостатке в организме инсулина нарушается транспорт глюкозы из кишечника в кровь. В норме по системе воротной вены сахара из кишечника поступают в печень, где происходят их многообразные превращения. При снижении этого уровня клетки печени повышают его, а при увеличении уровня глюкозы в крови они утилизируют ее. Эта регуляция осуществляется с помощью двух важных процессов, происходящих в гепатоцитах, — распада гликогена до глюкозы (гликогенолиз) и синтеза гликогена из глюкозы (гликогенез). Оба эти процесса интенсивно протекают и в скелетных мышцах за счет синтеза гликогена из молочной кислоты, которая накапливается в мышцах при физической нагрузке. При различных болезнях, сопровождающихся нарушениями функции печени, все эти процессы могут нарушаться. Печень утрачивает способность высвобождать и запасать углеводы в форме лабильного депо — гликогена и в форме стабильного депо — жиров. В этом случае уровень глюкозы в крови нередко существенно отклоняется от нормы, создавая опасность возникновения тяжелых патологических состояний.


Нарушение кислотно-основного состояния. Соотношение концентрации водородных — Н + и гидроксильных — ОН - ионов, так называемое кислотно-основное состояние (КОС), имеет существенное значение в жизнедеятельности и характеризуется величиной pH. В процессе нормальной жизнедеятельности организм подвергается чрезмерным воздействиям кислых или основных соединений в связи с приемом разнообразной пищи, образованием продуктов метаболизма (молочная кислота), изменением работы выделительных систем — легких, почек, пищеварительного тракта
Поддержание КОС на нормальном уровне обеспечивается мощными системами химической и физиологической регуляции. Химическая регуляция КОС осуществляется буферными системами крови и тканей, которые при изменении pH возвращают его к необходимым параметрам. С буферными системами тесно связана физиологическая регуляция КОС, осуществляемая в первую очередь легкими и почками. Легкие выделяют избыток СОг при его накоплении в крови и, напротив, снижают выделение СОг при уменьшении его содержания в крови. Этот процесс связан с реакцией на содержание в крови углекислого газа дыхательного центра, усиливающего вентиляцию легких. При этом СОг удаляется из организма и КОС не отклоняется от нормального. Важная роль в поддержании КОС принадлежит почкам. При накоплении в организме кислых соединений почки задерживают основные соединения и выделяют кислые, а при накоплении основных соединений они, напротив, задерживают кислые и выделяют основные. Это обеспечивается работой канальцевого аппарата почек. При чрезмерных воздействиях кислых или основных соединений, а также при расстройстве рассмотренных механизмов компенсации КОС возникают его нарушения. Существует две формы нарушения КОС — ацидоз и алкалоз.

Ацидоз — такое нарушение КОС, при котором в организме накапливается избыточное количество кислых соединений. Алкалоз — такое нарушение КОС, при котором в организме происходит избыточное накопление или уменьшение выделения основных соединений. Ацидоз нередко возникает при уменьшении выделения легкими СО2 вследствие нарушения внешнего дыхания. Накопление СОг приводит к избыточному образованию угольной кислоты в организме. Эта форма ацидоза получила название газовый (дыхательный) ацидоз. При нарушениях обмена веществ, сопровождающихся накоплением органических кислот, при сахарном диабете, гипоксии, лихорадке, инфекциях возникает негазовый ацидоз. Такая же форма возникает при снижении выделения кислых соединений из организма в связи с нарушением функции почек или при потере основных соединений в связи с поносом, усиленным потоотделением и др. Реже негазовый ацидоз развивается при введении в организм кислых соединений. Тяжелый ацидоз крайне опасен для жизни. Он вызывает расстройства нервной деятельности, вплоть до ацидотической комы, сопровождающейся потерей сознания.
Алкалоз развивается вследствие усиления выделения С0 2 из организма через легкие при увеличении их вентиляции. Такой алкалоз носит название газовый (дыхательный) алкалоз. Он возникает при некоторых опухолях мозга, кратковременной острой гипоксии, искусственной вентиляции легких во время операций. Негазовый алкалоз обычно появляется при длительном потреблении щелочной (растительной) пищи, введении лекарственных препаратов, например гидрокарбоната натрия, в случае усиленной потери соляной кислоты при неукротимой рвоте, токсикозе беременных, отравлениях. При алкалозах, особенно газовых, падает сосудистый тонус, уменьшается объем циркулирующей крови, снижается кровоток в мозге. Все это чревато тяжелыми расстройствами нервной деятельности, угнетением дыхания и других функций.

Нарушение водного обмена. Вода составляет 60—65% массы тела человека и высших животных. Все основные физиологические процессы могут происходить нормально только при сохранении водного баланса на определенном уровне. Количество выделяемой из организма воды в норме должно соответствовать количеству потребляемой воды. При этом активно поддерживается не только внешний водный баланс, но и соотношение объема жидкости во внеклеточной (кровь, лимфа, межклеточное пространство) и внутриклеточной средах. Регуляция объемов жидкостей организма осуществляется нейроэндокринной системой. В регуляции водного баланса принимают участие такие гормоны, как АДГ, альдостерон, тироксин и др. Нарушения водного обмена проявляются обезвоживанием (гипогидратация) и задержкой воды в организме (гипергидратация).
Гипогидратация возникает при ограничении приема воды, избыточном ее выделении и нарушении минерального обмена. Ограничение приема воды возникает при изоляции человека в чрезвычайных обстоятельствах — в пустыне, при природных катаклизмах, а также у тяжелобольных при длительном угнетении сознания, при бешенстве, сопровождающемся водобоязнью, холере и ряде других инфекционных заболеваний. Гипогидратация возникает и при усиленной потере воды через почки или легкие. Значительное увеличение диуреза наблюдается при некоторых заболеваниях гипофиза, сопровождающихся уменьшением образования АДГ (несахарный диабет, несахарное мочеизнурение); при заболевании почек — гломерулонефрите и др. Гипогидратация вызывает тяжелые нарушения деятельности сердечно-сосудистой системы — уменьшение объема циркулирующей крови, падение сократительной функции сердца и артериального давления. Расстройства кровообращения при гипогидратации вызывают нарушения нервной деятельности в виде утраты сознания, судорожных состояний и нарушений чувствительности.

Гипергидратация возникает при избыточном введении в организм воды или при уменьшении ее выделения. «Водное отравление» особенно часто возникает при увеличении потребления воды одновременно с ограничением ее выделения из организма, например у больных с недостаточностью функции почек или при введении АДГ. Водное отравление сопровождается снижением осмотического давления плазмы крови, что может привести к тяжелым нарушениям деятельности ЦНС вплоть до развития комы. С гипергидратацией, возникающей вследствие нарушения водного и минерального обмена, связано возникновение отеков. Отек — скопление жидкости в тканях или полостях вследствие нарушения ее распределения между кровью и межклеточной средой. В зависимости от локализации отеки носят различные названия. Скопление жидкости в межклеточных пространствах кожи и подкожной клетчатки называется анасарка, в полостях — водянка. Патологическое скопление жидкости в брюшной полости получило название асцита
Механизмы отеков. Нарушение соотношения гидродинамического, осмотического, онкотического и мембраногенного факторов может приводить к усиленному выходу жидкости из сосудов в ткань и развитию отека. Эти факторы составляют патогенетические механизмы отека. Гидродинамический механизм отека включается в случае повышения кровяного давления в венах и давления лимфы в лимфатических сосудах.
Осмотический механизм участвует в развитии отека, когда снижается осмотическое давление крови и повышается осмотическое давление тканей. Осмотическое давление крови снижается крайне редко, но осмотическое давление тканей в патологии возникает часто — при ацидозе, усиливающем диссоциацию солей, лихорадке, воспалении, венозной гиперемии и другое.
Онкотический механизм отека включается: а) при уменьшении онкотического давления крови (потеря почками белка, в первую очередь альбуминов, снижение синтеза альбуминов печенью, выход альбуминов из крови в ткань, снижение альбумино-глобулинового коэффициента и др.); б) при увеличении онкотического давления тканей (усиленный распад белка тканей, выход альбуминов из крови, увеличение гид- рофильности белка при ацидозе, изменение ионного состава среды и т. п.).
Мембраногенный механизм отека включается при повышении проницаемости биологических мембран в связи с расстройствами обмена веществ, сопровождающимися ацидозом, при интоксикациях и аллергии, вызывающих высвобождение биологически активных веществ, расстройствах минерального обмена и потере мембранами кальция и др. При любом виде отека включаются все эти механизмы, однако среди них, как правило, можно выделить ведущий.
Виды отеков. Выделяют сердечные (застойные), почечные (нефритические и нефротические), голодные (кахектические), токсические и другие виды отека,. Застойные отеки возникают при сердечной недостаточности. Например, при недостаточности правого желудочка сердца развивается застой крови в венах и включается гидродинамический механизм отека. Возникающее при этом нарушение вымывания продуктов метаболизма из тканей и гипоксия приводят к включению остальных механизмов отека. Учитывая важное значение эндокринной системы и почек в развитии отека, некоторые авторы выделяют эндокринно почечный механизм; он может иметь ведущее значение в развитии сердечных отеков. Нефритические отеки возникают при. гломерулонефрите и некоторых других заболеваниях почек. При
нефрозах с мочой в больших количествах теряется белок крови, прежде всего альбумины (протеинурия). Потеря белка приводит к снижению онкотического давления крови и развитию отека.
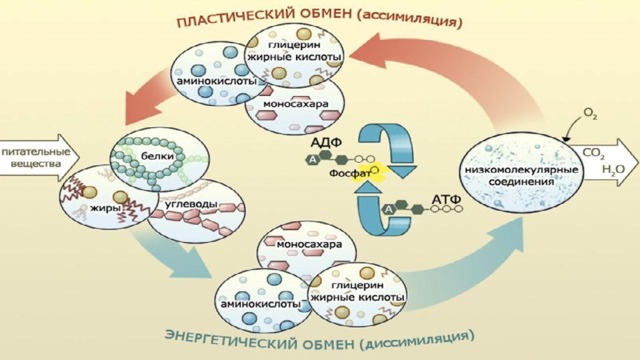
Нарушение энергетического и основного обмена. Энергия, заключенная в химических связях питательных веществ, в процессе метаболических превращений преобразуется в аденозинтрифосфорную кислоту (АТФ). Поступающие в клетку вещества доставляются в митохондрии, где происходит тканевое дыхание и синтезируется основная часть АТФ. Из одной молекулы глюкозы в процессе тканевого дыхания образуется 38 молекул АТФ. Тканевое дыхание представляет собой окисление субстратов до С0 2 и воды с образованием АТФ (фосфорилирование). В процессе фосфорилирования энергия окисления используется для синтеза АТФ из АДФ и фосфорной кислоты. Существует еще один способ получения энергии — анаэробный гликолиз , протекающий не в митохондриях, а в цитоплазме клеток. В процессе анаэробного гликолиза кислород не используется. При анаэробном гликолизе глюкоза или гликоген расщепляются только до пировиноградной кислоты, которая затем переходит в молочную кислоту. При анаэробном гликолизе из одной молекулы глюкозы образуется лишь 2 молекулы АТФ. Хотя анаэробный гликолиз представляет собой малоэкономный путь получения энергии, он абсолютно необходим для нормальной деятельности клеток. Образованная в митохондриях энергия в форме АТФ транспортируется из них к местам утилизации — сократительным белкам, мембранам, ядру, где и расходуется в процессе мышечного сокращения, активного транспорта ионов, синтеза белка. Транспорт энергии осуществляется креатинфосфатом, который образуется на мембранах митохондрий из креатина и АТФ. В местах утилизации из креатинфосфата вновь синтезируется АТФ, энергия которой используется непосредственно для выполнения функции субклеточных структур и клетки в целом. В клетке энергия используется в двух главных направлениях: на выполнение специализированной деятельности (сокращение мышц, возбуждение нейрона, синтез секрета) и на пластические процессы (синтез клеточных структур, их обновление, поддержание целостности клетки).
Нарушение энергетического обмена. В целом нарушение энергетического баланса в организме возникает либо в результате снижения образования АТФ, либо расстройства ее транспорта, либо нарушения утилизации энергии клеткой. Образование АТФ снижается при нарушении процессов окисления, причиной которого могут быть гипоксия, дефицит субстратов окисления, изменение работы ферментных систем митохондрий. Такое состояние тканевого дыхания, при котором окислительные процессы протекают нормально или даже усилены, но процесс фосфорилирования ослаблен и АТФ образуется недостаточно, называется разобщением биологического окисления. В условиях патологии эти факторы могут привести к снижению энергетического обеспечения клеток вследствие уменьшения образования энергии в форме АТФ. Расстройства внутриклеточного транспорта энергии наблюдаются при изменении активности ферментов, участвующих во взаимодействии АТФ и креатина. Снижение активности наблюдается при изменении pH клетки, нарушении ионного равновесия и др. Нарушение энергетического обеспечения клеток вследствие расстройства утилизации энергии АТФ встречается в основном в сердце.
Нарушение основного обмена. Основной обмен характеризуется минимальным количеством энергии, необходимым для поддержания жизнедеятельности в состоянии полного физического покоя, натощак, при температуре комфорта. Величина основного обмена зависит от многих факторов, в том числе от массы тела, роста, пола, возраста и др. В условиях патологии величина основного обмена является диагностическим тестом при оценке общих изменений обмена веществ в организме. Основной обмен может увеличиваться при многих болезненных и патологических состояниях, сопровождающихся усилением окислительных процессов и физиологических функций. Снижение основного обмена наблюдается при утрате произвольных движений, недостаточности функции гипофиза, надпочечников и щитовидной железы, голодании.

Некроз
- это гибель клеток или тканей в живом организме. Некроз в своем развитии проходит ряд последовательных стадий, таких как некробиоз (обратимая стадия), паранекроз (стадия необратимых изменений), смерть клетки и аутолиз.
В ядрах клеток под воздействием рибонуклеазы и дезоксирибонуклеазы последовательно возникают кариопикноз (сморщивание ядра), кариорексис (разрыв его на глыбки), кариолизис (растворение). В цитоплазме клеток под воздействием гидролитических ферментов лизосом происходят коагуляция и денатурация белков, плазморексис и плазмолизис (цитолиз). В межуточном веществе некроз проявляется фибринолизом, эластолизом, образованием липогранулем. От некроза следует отличать апоптоз - запрограммированный процесс активного саморазрушения клетки. Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. При снижении уровня апоптоза происходит накопление аномальных клеток). При активации апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани.
Апоптоз - это генетически контролируемая смерть клетки, это защита организма от персистенции поврежденных клеток, которые могут оказаться потенциально опасными для многоклеточного организма. Апоптоз регулируется внешними факторами и автономными механизмами, протекает в два этапа: образование апоптозных тел и фагоцитоз апоптозных тел макрофагами. Морфологически проявляется гибелью единичных, беспорядочно расположенных клеток, формированием округлых, окруженных мембраной телец (“апоптотические тельца”) , которые фагоцитируются окружающими клетками. В отличие от некроза, целостность клеточной мембраны сохранена и воспалительный ответ отсутствует.

Классификация некроза. По этиологии некроз может быть травматическим, токсическим, аллергическим, трофоневротическим, сосудистым. По патогенезу или механизму действия выделяют прямой и непрямой некроз. Прямой некроз возникает непосредственно в связи с действием патологического фактора и чаще в месте его приложения (токсический или травматический некроз).
Клинико-анатомические формы некроза:
- 1. Коагуляционный (сухой) - некроз, возникающий в тканях, богатых белком и бедных жидкостью. Примером может быть творожистый (при туберкулезе, лимфогранулематозе и т.д.), фибриноидный (при ревматических болезнях) и восковидный некроз (например, некроз прямых мышц живота при брюшном тифе).
- 2. Колликвационный (влажный) - некроз, возникающий в тканях, богатых жидкостью и бедных белком, чаще в головном или спинном мозге. После заживления такого некроза в ткани остается киста.
- 3. Секвестр - участок некроза, который длительно не подвергается аутолизу и не замещается соединительной тканью. Чаще всего возникает в костной ткани при остеомиелите.
- 4. Гангрена - некроз ткани, которая соприкасается с внешней средой. Чаще возникает в конечностях, может быть и во внутренних органах (легкие, кишечник). Выделяют несколько разновидностей гангрены: а) сухая (чаще возникает в конечностях); б) влажная; в) анаэробная (при присоединении анаэробной инфекции); г) пролежни - возникают у тяжелых больных на коже, если они долго лежат в постели; г) нома - некроз кожи и мягких тканей щеки у детей при кори.
- 5. Инфаркт - это некроз, обусловленный уменьшением или прекращением притока к ткани артериальной крови. Непосредственной причиной инфаркта может быть тромбоз, эмболия или спазм артерии, а также функциональное перенапряжение органа при недостаточном его кровоснабжении.

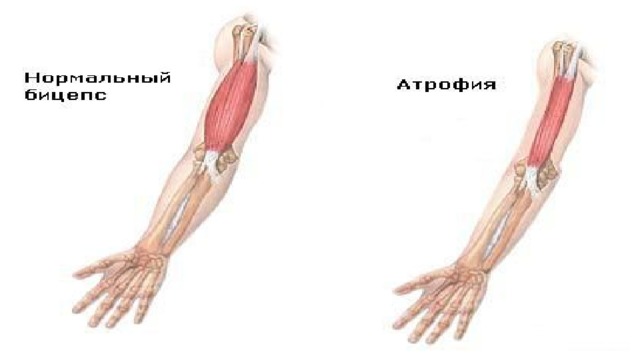
Атрофия
Это прижизненное уменьшение объема ткани или органа за счет уменьшения размеров каждой клетки, а в дальнейшем — числа клеток, составляющих ткань, сопровождающееся снижением или прекращением их функции. Атрофия, которая характеризуется уменьшением размерa нормально сформированного органа, отличается от агенезии, аплазии и гипоплазии, которые являются патологией развития органа.
Агенезия — полное отсутствие органа и его закладки в связи с нарушением хода онтогенеза.
Аплазия — недоразвитие органа, который имеет вид раннего зачатка.
Гипоплазия — не полное развитие органа (орган частично уменьшен в размере).
Атрофию делят на физиологическую и патологическую:
Физиологическая атрофия наблюдается на протяжении всей жизни человека. Так, после рождения атрофируются и облитерируются пупочные артерии, артериальный (боталлов) проток. У пожилых людей атрофируются вилочковая и половые железы.
Сенильная (старческая) атрофия : уменьшение количества клеток — одно из морфологических проявлений процесса старения. Этот процесс имеет наибольшее значение в тканях, образованных постоянными, неделящимися клетками, например, в мозге и сердце. Атрофия при старении часто отягощается атрофией в результате влияния сопутствующих факторов, например, ишемии.
Патологическая атрофия может иметь местный и общий характер. Местная атрофия. Различают следующие виды местной патологической атрофии в зависимости от причины и механизма развития: Атрофия от бездействия: развивается в результате снижения функции органа.
Атрофия под воздействием физических и химических факторов. Под действием лучевой энергии атрофия особенно выражена в костном мозге, половых органах. Йод и тиоурацил подавляют функцию щитовидной железы, что ведет к ее атрофии.
Общая атрофия, или истощение (кахексия) имеет следующие причины:
- атрофия из-за недостатка питательных веществ: тяжелое белковое и калорийное голодание приводит к использованию тканей организма, в первую очередь скелетной мускулатуры, в качестве источника энергии и белков после того, как другие источники (гликоген и жиры в жировых депо) истощаются. Такая атрофия возникает также при болезнях пищеварительного тракта вследствие снижения его способности переваривать пищу.
- раковой кахексии (при любой локализации злокачественной опухоли);
- эндокринной (гипофизарной) кахексии (болезнь Симмондса при поражении гипофиза, при повышении функции щитовидной железы - тиреотоксическом зобе);
- церебральной кахексии (поражение гипоталамуса);
- истощение при хронических инфекционных заболеваниях (туберкулез, бруцеллез, хроническая дизентерия).
Значение атрофии для организма определяется степенью уменьшения органа и понижения его функции. Если атрофия и склероз не достигли большой степени, то после устранения причины, вызвавшей атрофию, возможно восстановление структуры и функции. Далеко зашедшие атрофические изменения необратимы.


Атрофия может наблюдаться, в иммобилизированных скелетных мышцах и костях (при лечении переломов). При длительном постельном режиме, гиподинамии скелетная мускулатура атрофируется достаточно быстро вследствие бездействия. Первоначально наблюдается быстрое уменьшение размеров клеток, которые также быстро восстанавливают объем при возобновлении активности. При более длительной иммобилизации мышечные волокна уменьшаются и в размерах, и в количестве. Так как скелетная мускулатура может регенерировать в ограниченном объеме, восстановление размеров мышц после потери мышечных волокон происходит в основном путем компенсаторной гипертрофии оставшихся в живых волокон, на что требуется длительный период восстановления.
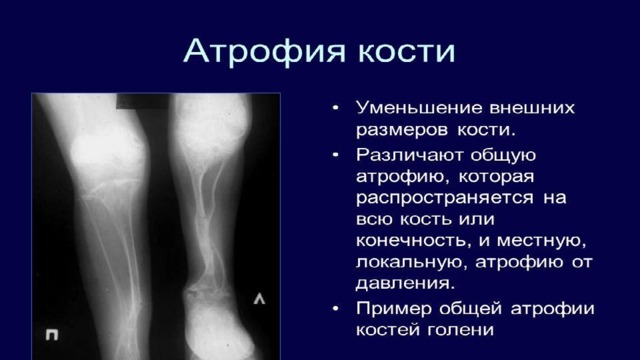
Атрофия кости заключается в том, что резорбция кости происходит быстрее, чем ее формирование; это проявляется уменьшением размеров трабекул (уменьшение массы), что приводит к остеопорозу от бездействия. Кроме того, примерами дисфункциональной атрофии могут служить атрофия зрительного нерва после удаления глаза; краев зубной ячейки, лишенной зуба.
Атрофия , вызванная недостаточностью кровоснабжения, развивается вследствие сужения артерий, питающих данный орган. Уменьшение кровотока (ишемия) в тканях в результате заболеваний артерий приводит к гипоксии, вследствие чего возникает уменьшение объема клеток, их количества - деятельность паренхиматозных органов снижается, размер клеток уменьшается. Гипоксия стимулирует пролиферацию фибробластов, развивается склероз. Такой процесс наблюдается в миокарде, когда на почве прогрессирующего атеросклероза венечных артерий развивается атрофия кардиомиоцитов и диффузный кардиосклероз; при склерозе сосудов почек развивается атрофия и сморщивание почек; болезни сосудов мозга, проявляются мозговой атрофией, включающей в себя и гибель нейронов.

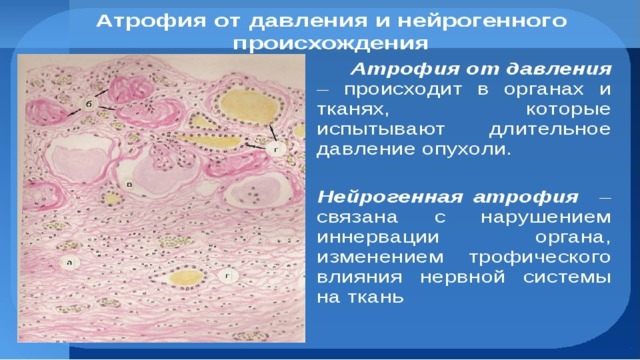
Атрофия от давления: длительное сдавливание ткани вызывает атрофию. Большое, инкапсулированное доброкачественное новообразование в спинномозговом канале может вызвать атрофию спинного мозга. Вероятно, этот вид атрофии возникает из-за сдавления мелких кровеносных сосудов, что приводит к ишемии, а не от прямого влияния давления на клетки. При давлении аневризмы в телах позвонков и в грудине могут появляться узуры. Атрофия от давления возникает в почках при затруднении оттока мочи. Моча растягивает просвет лоханки, сдавливает ткань почки, которая превращается в мешок с тонкими стенками, что обозначают как гидронефроз. При затруднении оттока спинномозговой жидкости происходят расширение желудочков и атрофия ткани мозга — гидроцефалия.
Атрофия при денервации (нейротическая атрофия): состояние скелетной мускулатуры зависит от функционирования иннервирующего нерва, что необходимо для сохранения нормальной функции и структуры. Повреждение соответствующего мотонейрона в любой точке между телом клетки в спинном мозге и моторной концевой пластинкой ведет к быстрой атрофии мышечных волокон, которые иннервируются этим нервом. При временной денервации с помощью физиотерапии и электрической стимуляции мышц можно предотвратить гибель мышечных волокон и гарантировать восстановление нормальной функции при возобновлении функционирования нерва.
Атрофия в результате недостатка трофических гормонов: эндометрий, молочная железа и большое количество эндокринных желез зависят от трофических гормонов, необходимых для нормального клеточного роста и уменьшение количества этих гормонов ведет к атрофии. При уменьшении секреции эстрогена в яичниках наблюдается атрофия эндометрия, влагалищного эпителия и молочной железы. Болезни гипофиза, сопровождающиеся уменьшенной секрецией гипофизарных трофических гормонов, приводят к атрофии щитовидной железы, надпочечников и половых желез.