| . | УПРАВЛЕНИЕ ОБРАЗОВАНИЯ ГОМЕЛЬСКОГО ОБЛАСТНОГО ИСПОЛНИТЕЛЬНОГО КОМИТЕТА
Мозырский ГОСУДАРСТВЕННЫЙ политехнический колледж |
Цикловая комиссия спецдисциплин специальности «Переработка нефти и газа»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
открытого учебного занятия по дисциплине
«Неорганическая химия»
Тема «Аммиак»
Разработала Н.В.Саяпина,
преподаватель химии
2017
Рассмотрено на заседании цикловой комиссии
спецдисциплин специальности «Переработка нефти и газа»
«_____» ___________________ 2017 г.
Протокол №___
Председатель цикловой комиссии ___________/Л.А.Раевская/
Аннотация
Учебное занятие по теме «Аммиак» проводится в рамках темы «Неметаллы». Основная цель – формировать знания о строении молекул аммиака, о способах получения, о физических и химических свойствах изучаемого вещества. Для активизации познавательной деятельности учащихся на занятии применяются коллективные, групповые и индивидуальные формы работы, а также интерактивная доска с электронными учебными модулями, содержащими аудио- и видеоматериалы.
Методическая разработка адресуется преподавателям химии.
ПЛАН УЧЕБНОГО ЗАНЯТИЯ
Тема: Аммиак
Обучающая цель: рассмотреть строение молекулы аммиака, опираясь на знания о строении атома и механизмах образования связи; сформировать знания о физических, химических свойствах аммиака, о способах получения и областях применения аммиака.
Воспитательная цель: продолжить воспитание культуры речи, трудолюбия, взаимоуважения
Развивающая цель: развивать мышление, память, речь, умение анализировать, сопоставлять, делать выводы; совершенствовать навыки решения тестовых заданий.
Методическая цель: активизация познавательной деятельности учащихся на учебных занятиях химии через использование интерактивной доски
Междисциплинарные связи: биология, математика, физика, основы химической технологии
Внутридисциплинарные связи: тема "Основные типы химической связи", разделы "Химия неметаллов", "Химия металлов"
Тип учебного занятия: формирование новых знаний
Формы работы учащихся: фронтальная, индивидуальная, парная
Оснащение учебного занятия: периодическая система химических элементов Д.И.Менделеева, таблица растворимости, опорные схемы, тесты, презентация, интерактивная доска, видеоматериалы
ХОД ЗАНЯТИЯ
ОРГАНИЗАЦИОННЫЙ МОМЕНТ (1-3 мин)
- проверка присутствующих, вопросы о готовности группы к учебному занятию, постановка целей.
Здравствуйте! Откройте свои рабочие тетради и запишите дату занятия. Сегодня вы будете пользоваться привычными для вас опорным конспектом, учебником, тестовыми заданиями и все это вы видите на своих столах. Мы продолжаем изучать различные соединения и их свойства.
Сегодня мы говорим об известном с давних времен веществе, имеющем необыкновенные свойства. Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно.
Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Запишите тему урока.
II. АКТУАЛИЗАЦИЯ И ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ
Но прежде, чем говорить о новом веществе, надо вспомнить, что на прошлых занятиях мы говорили о химических элементах VIIА, VIА групп и соединениях этих элементов.
2 учащихся работают у доски с планом характеристики элементов (приложение 1).
Все остальные учащиеся выполняют тестовые задания по 4 вариантам (приложение 2).
III. ИЗЛОЖЕНИЕ НОВОГО МАТЕРИАЛА
План:
История открытия аммиака и способы его получения
Строение и состав молекулы аммиака
Физические свойства аммиака
Химические свойства аммиака
Применение аммиака
Итак, начнем. Вещество, о котором пойдет речь сегодня, имеет древнюю историю. В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт».
Формула аммиака – NH3, и это водородное соединение азота.
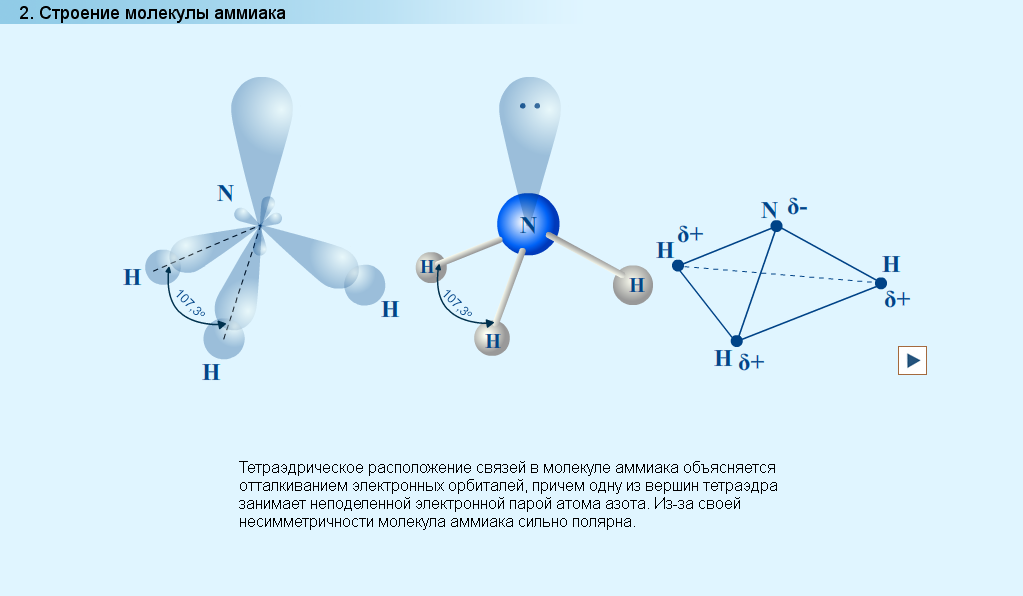
- С помощью опорного конспекта и периодической системы охарактеризуйте строение атома азота и определите его валентность (1s22s22p3, валентность азота равна 3, это типичный неметалл)
- Учитывая природу атомов азота и водорода, скажите, какие типы связей можно наблюдать в молекуле аммиака? (Связи N-H ковалентные полярные, электронная плотность смещена от водорода к азоту, поэтому на атоме азота возникает частичный отрицательный заряд)
- Сколько ковалентных связей может образовать атом азота? (3 по обменному механизму и четвертую связь атом азота может образовать по донорно-акцепторному механизму)
- Рассмотрите модель молекулы аммиака. Какую геометрическую фигуру напоминает молекула аммиака? (Пирамиду, в вершинах которой находятся 3 атома водорода и неподеленная пара электронов азота)
Получение аммиака
Давайте поговорим о лабораторном способе получения аммиака. Справедливости ради, надо сказать, что лабораторный способ получения аммиака со времен алхимиков практически не изменился.

Промышленный способ получения аммиака должен быть экономически выгодным. С какими же проблемами столкнулись ученые, изучая эту проблему?
Охарактеризуйте физические свойства аммиака.

Переходим к характеристике химических свойств аммиака.
Мы уже заметили, что аммиак хорошо растворяется в воде, что он имеет очень резкий запах, наконец, вспомните, ведь его ещё в средние века называли «щелочной воздух».
Вывод: растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной пары электронов, которая «перетягивает» протон водорода Н+ из молекул воды Н2О и соляной кислоты HCl. В результате взаимодействия аммиака с кислотами образуются соли аммония.
Аммиак окисляется кислородом воздуха, а состав продуктов реакции зависит от участия в реакции катализатора.
Найдите в опорном конспекте уравнения химических реакций, иллюстрирующие данное свойство аммиака. Какие продукты образуются при горении аммиака без катализатора и в присутствии катализатора. В каком случае аммиак теряет больше электронов и почему?
Применение:
В течение этого часа мы постоянно говорили об аммиаке. Аммиак человек широко использует в быту и в технике.
Например, дома:
К месту ожога крапивой или укуса насекомого можно приложить примочку из нашатырного спирта, потому что он нейтрализует кислоты;
Растения скажут вам «спасибо», если вы их подкормите раствором солей аммония;
Ваши мамы пекут пироги, используя пекарский порошок или разрыхлитель, который содержит карбонат аммония.
Пользуясь опорным конспектом, назовите другие области применения аммиака и его солей.
IV. ЗАКРЕПЛЕНИЕ
Самостоятельная тестовая работа по теме «Аммиак» (приложение 4)
V. ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ
Комментирование и выставление отметок
VI. ВЫДАЧА ДОМАШНЕГО ЗАДАНИЯ
[1] § 11.3, цепочка превращений и сообщения по теме «Аммиак – ценное химическое сырье»
Приложение 1
А) Охарактеризуйте элементы – неметаллы 7А группы по плану:
Общая электронная формула: …
Возможные степени окисления: ……. У фтора …..
Физические свойства:
Фтор - …
Хлор - …
Бром - …
Иод- …
Все галогены ядовиты.
Химические свойства:
1.С металлами (образуется соль) уравнение ….
2.С водородом (галогеноводороды) уравнение ….
3. Более активный галоген может вытеснить менее активный из раствора его соли, уравнение ….
Биологическая роль:
Б) Охарактеризуйте элементы 6А (кислород и серу) группы по плану:
Общая электронная формула: …
Возможные степени окисления: …….. У кислорода …...
Физические свойства:
Кислород - …..
Сера - ….
Химические свойства:
1.С металлами (образуется оксиды и сульфиды) 2 уравнения ….
2.С водородом (вода и сероводород) уравнение ….
3. Взаимодействие друг с другом (уравнение ….)
Применение:
Приложение 2
Тест по теме "Неметаллы 7А и 6А групп»
1 вариант
1. Среди галогенов – простых веществ - твердым является
Фтор; 2. Хлор; 3. Бром; 4. Иод.
2. О фторе нельзя сказать, что он
самый активный; 2. самый электроотрицательный;
3. самый агрессивный; 4. самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
1. Фтора; 2. Хлора; 3. Брома; 4. Иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые:
1. Фтор; 2. Хлор; 3. Бром; 4. Иод.
5. Степень окисления хлора в соединении Са(СlО)2
-1; 2. +1; 3. +3; 4. +5
6. Сила галогеноводородных кислот возрастает в ряду
НСl, НВr, НI; 2. НI, НВr, НСl;
3. НВr, НI, НСl; 4. НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
белого цвета; 2. желтоватого цвета; 3. желтого цвета; 4. оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
16,8 г; 2. 33,6 г; 3. 48,8 г; 4. 97,7 г
9. Фтор взаимодействует с водой по уравнению __________________________________
10. Хлор взаимодействует с горячим раствором гидроксида натрия по уравнению___________________________________________________________________
2 вариант
1. Среди галогенов – простых веществ - жидким является
Фтор; 2. Хлор; 3. Бром; 4. Иод.
2. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде
ns2np2; 2. ns2np3; 3. ns2np4; 4.ns2np5.
3. Наиболее ярко выражены окислительные свойства у
Фтора; 2. Хлора; 3. Брома; 4. Иода.
4. С какими из перечисленных веществ хлор не взаимодействует?
водой; 2. раствором хлорида натрия; 3. раствором бромида натрия;
раствором щелочи.
5. Наиболее сильной из кислот является
НСlО; 2. НСlО2; 3. НСlО3; 4. НСlО4
6. Раствор фтора в воде получить нельзя, так как
фтор не растворяется в воде; 2.фтор разлагает воду; фтор частично растворяется в воде;
3. фтор вытесняет из воды водород; 4. фтор взрывается в воде
7. При сливании растворов иодида натрия и нитрата серебра образуется осадок
белого цвета; 2. желтоватого цвета; 3. желтого цвета; 4. оранжевого цвета
8. В раствор, полученный при пропускании 11,2 л газообразного хлороводорода в воду, поместили 13 г цинка. Объем выделившегося газа равен (при н. у.)
22,4 л; 2. 11,2 л; 3. 5,6 л; 4. 4,48 л.
9. Хлор в лаборатории получают при взаимодействии соляной кислоты с перманганатом калия по уравнению____________________________________________
10. Хлор взаимодействует с холодным раствором гидроксида натрия по уравнению___________________________________________________________________
3 вариант
1. Элемент, расположенный в таблице Периодической системы химических элементов Д.И.Менделеева во 2 – м периоде VIА – группы, называется:
1) селен 2) сера 3) кислород 4) теллур
2. Число электронных слоев и число валентных электронов в атоме серы соответственно равны: 1) 4 и 6 2) 3 и 6 3) 2 и 6 4) 4 и 5
3. Высший оксид серы соответствует общей формуле: 1) ЭО3; 2) Э2О3; 3) Э2О5; 4) ЭО2
4. К веществам с ковалентной неполярной связью относится:
1) сероводород 2) сульфид калия 3) вода 4) озон
5. Степень окисления +4 сера имеет в соединении: 1) SO2; 2) SO3; 3) H2SO4; 4) H2S.
6. Кислотные свойства оксидов уменьшаются в ряду:
1) FeO – SeO2 – SO2 ; 2) SO2 – SeO2 – TeO2; 3) SeO2 – SO2 – TeO2; 4) Fe2O3 – SeO3 – SO3
7. С сероводородом взаимодействуют все вещества, указанные в ряду:
1) H2O, Cu , Cu(OH)2; 2) CO2, KOH, HCl; 3) SO3, S, Zn(OH)2; 4) O2, NaOH, CuCl2
8. С образованием газа идет реакция, схема которой:
1) Li2 SO4 + Ba(OH)2 → ; 2) H2SO4 + Ca(OH)2 → ; 3) K2SO3 + H2SO4 →; 4) H2S + NaOH →
9. Коэффициент перед окислителем в уравнении реакции между концентрированной серной кислотой и медью равен: 1) 1; 2) 2; 3) 3; 4) 4
10. Верны следующие суждения о кислороде?
А. Химический элемент кислород образует два простых вещества – кислород О2 и озон О3.
Б. Как окислитель озон сильнее кислорода.
1) верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны
4 вариант
1. Элемент, расположенный в Периодической системе химических элементов Д.И.Менделеева в 4-м периоде VIА – группы, называется:
1) селен 2) кислород 3) теллур 4) сера
2. Заряд ядра и число валентных электронов в атоме кислорода соответственно равны:
1) +8 и 6 2) +8 и 2 3) +16 и 2 4) +16 и 6
3. Такую же валентность, как и кислород, сера проявляет в каждом из двух соединений: 1) SO2 , Na2S; 2) Al2S3 , SO3 3) H2S , CaS 4) MgS, SO2
4. Химическая связь между атомами элементов с порядковыми номерами 6 и 16
1) ионная; 2) водородная; 3) ковалентная неполярная; 4) ковалентная полярная
5. Степень окисления +6 сера имеет в соединении: 1) H2SO4; 2) H2SO3; 3) H2S; 4) CS2
6. Оксид серы (IV) является: 1) основным; 2) кислотным; 3) амфотерным;
4) несолеобразующим
7. С оксидом серы (VI) взаимодействуют все вещества, указанные в ряду:
1) H2O, O2, NaCl; 2) Ca(OH)2 , CO2 , K2O; 3) Cu(OH)2, NaCl, CaO ; 4) NaOH , H2O , BaO
8.С образованием осадка идет реакция между рстворами:
1) Na2SO4 и KCl 2) H2SO4 и CuCl2
3) H2SO4 и BaCl2 4) CuSO4 и HCl
9. Коэффициент перед восстановителем в уравнении реакции между сероводородом и кислородом равен: 1) 4; 2) 3; 3) 2; 4) 1.
10. Верны ли следующие суждения о свойствах серы:
А.В химических реакциях сера проявляет как свойства окислителя, так и свойства восстановителя.
Б.С кислородом сера образует только кислотные оксиды.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны.
Приложение 3
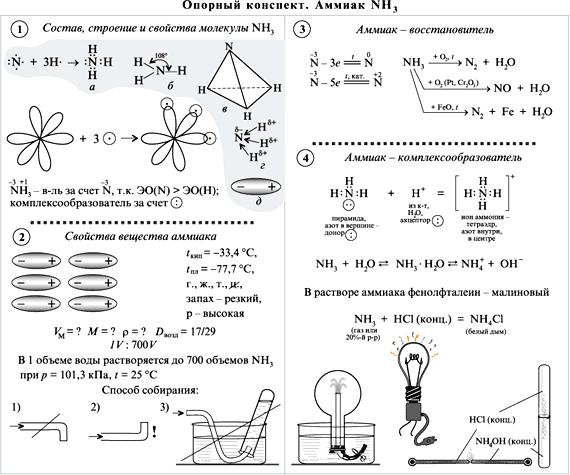
Приложение 4
Самостоятельная тестовая работа по теме «Аммиак»
I вариант
1. (2 балла) Азот входит в главную подгруппу:
a) IV группы; б) V группы в) VI группы; г) VII группы.
2. (2 балла) Раствор аммиака в воде окрашивает лакмус в:
a) Красный цвет; б) Синий цвет; в) Фиолетовый цвет; г) Не окрашивает совсем.
3. (2 балла) Аммиак горит в кислороде без катализатора с образованием:
a) Азота; б) Оксида азота (II); в) Оксида азота (III) г) Азотной кислоты.
4. (2 балла) Степень окисления азота в аммиаке может быть равна: а) +1; б) 0; в) +4; г) -3;
5. (2 балла) Нашатырный спирт – это:
а) Р-р аммиака в воде; б) Р-р аммиака в спирте; в) Хлорид аммония; г) Медицинский спирт.
6. (2 балла) При взаимодействии аммиака с кислотами образуются:
а) соли азотной кислоты б) соли аммония в) соли азотистой кислоты г) аммиачная вода
7. (2 балла) Назовите формулу – NH4Cl:
а) сульфат аммония б) хлорид аммония в) нитрат аммония г) нитрит аммония
8. (2 балла) Все соли аммония вступают в реакции:
а) разложения и горения б) разложения и обмена с щелочами
в) горения и обмена с щелочами г) разложения и замещения металлами
9. (15 баллов) Запишите уравнения реакций, взаимодействия:
А) аммиака и соляной кислоты
Б) аммиака и кислорода (без катализатора)
В) хлорида аммония и гидроксида натрия
Г) разложения нитрата аммония
Д) карбоната аммония и соляной кислоты
10. (4 балла) Назовите области применения солей аммония.
II вариант
1. (2 балла) Азот при обычных условиях - …
a) Тяжелый металл; б) Бесцветная маслянистая жидкость;
в) Одноатомный инертный газ; г) Газ без цвета и запаха, состоящий из двухатомных молекул.
2. (2 балла) Реакция между хлоридом аммония и гидроксидом кальция идет потому что:
a) Выпадает осадок; б) Выделяется газ – аммиак; в)Образуется соль; г)Реакция не идет.
3. (2 балла) Аммиак горит в кислороде в присутствии катализатора с образованием:
a) Азота; б) Оксида азота (II); в) Оксида азота (III); г) Азотной кислоты
4. (2 балла) Степень окисления азота в молекуле аммиака: а) 0; б) +3; в) -3; г) +5;
5. (2 балла) Нашатырь – это:
а) Раствор аммиака в воде; б) Раствор аммиака в спирте; в) Хлорид аммония; г) Поваренная соль.
6. (2 балла) хлорид аммония взаимодействует с:
а) хлоридом натрия б) гидроксидом бария в) нитратом калия г) соляной кислотой
7. (2 балла) Назовите формулу – NH4NO3:
а) сульфат аммония б) хлорид аммония в) нитрат аммония г) нитрит аммония
8. (2 балла) Газ, образующийся при взаимодействии щелочей с солями аммония, имеющий резкий запах: а) сероводород б) аммиак в) хлороводород г) фосфин
9. (15 баллов) Запишите уравнения реакций, взаимодействия:
А) аммиака и азотной кислоты
Б) аммиака и кислорода (в присутствии катализатора)
В) нитрата аммония и гидроксида калия
Г) разложения хлорида аммония
Д) карбоната аммония и азотной кислоты
10. (4 балла) Назовите области применения аммиака































