Тема: Аммиак. Соли аммония.
Цель: изучить строение и свойства аммиака и соли аммония.
Планируемые результаты:
Личностные:
Формирование ответственного отношения к познаванию химии; готовности и способности обучающихся к саморазвитию и самообразованию на основе изученных факторов, законов и теорий химии; осознанного выбора и построения индивидуальной образовательной траектории;
Формирование целостной естественно-научной картины мира, неотъемлемой частью которой является химическая картина мира;
Овладение современным языком, соответствующими уровню развития науки и общественной практики, в той числе и химическими;
Предметные:
умения характеризовать состав, физические и химические свойства солей аммония, применение;
объяснять основные понятия: «соль аммония», «селитра», «качественная реакция на ион аммония»;
составлять формулы солей аммония;
записывать уравнения реакций химических свойств солей аммония;
распознавать соли аммония, сопоставлять их с солями щелочных металлов;
указывать области применения изучаемых веществ.
Метапредметные:
Умение на практике пользоваться основными логическими приёмами, методами наблюдения, моделирования, объяснения, решения проблем, прогнозирования.
Умения соотносить свои действия с планируемыми результатами; осуществлять самоконтроль познавательной деятельности в процессе достижения результата, творческое отношение к учебному труду.
Умение выбирать наиболее эффективные способы решения поставленных задач.
Умение общаться между собой с использованием монологической и диалогической речи.
Тип урока: традиционный
Ход урока:
I.Организационный этап.
Приветствие. Отмечаем отсутствующих на уроке.
| Вариант №1 От N до Bi увеличивается: А) металлические свойства Б) неметаллические свойства В) электроотрицательность Г) валентность 2. Какая общая формула у следующих соединений NH3,PH3,AsH3 А)HRO2 Б)HRO3 В)RH3 Г)R2O5 3. Выберете высшею степень окисления характерную для элементов VAгруппы А)+2 Б)+4 В)+5 Г)+3 4.Выберете уравнение реакции, где азот проявляет свойства окислителя А) 2NO+O2=2NO2 Б)3H2+N2=2NH3 В)N2+O2=2NO Г)2NO2+H2O+O2=4HNO3 5. В состав каких веществ входит азот А) Воде  Б) Жиров Б) Жиров
В) Углеводов Г) Белков | Вариант№2 От Bi до N увеличивается: А) металлические свойства Б) неметаллические свойства В) электроотрицательность Г) валентность Какая общая формула у следующих соединений N2O3,P2O3,As2O3 А) RH3 Б) HRO2 В) R2O5 Г) R2O3 3. Выберете низшую степень окисления характерную для элементов VAгруппы А)-1 Б)-3 В)-4 Г)-2 4.Выберете уравнение реакции, где азот проявляет свойства восстановителя А) 3Mg+N2=Mg3N2 Б)3H2+N2=2NH3 В)N2+O2=2NO Г)3Li+N2=Li3N 5. В состав каких веществ входит азот А) Воде  Б) Жиров Б) Жиров
В) Углеводов Г) Белков
|
На прошлом уроке мы с вами изучили тему «Общая характеристика элементов VA группы. Азот». Чтобы повторить прошлую тему, решим тест. Время 3 мин.
Ответы к тесту: В1 1-А,2-В,3-В,4-Б 5-Г. В2 1-Б,2-Г,3-Б,4-В,5-Г
Обменяемся с тестом друг с другом, если нет ошибок 5, одна ошибка-4, две ошибки-3, если три и более ошибок 2.
II.Изучение нового материала.
Определим тему урока. Для того, чтобы определить тему сегодняшнего урока решим ребус. Для каждого ряда будет свое слова, соединив 3 слова мы получим тему урока.
Ребус для 1 ряда.

Ребус для 2 ряда

Ребус для 3 ряда

Какие слова у вас получились? (Аммиак, соли, аммония)
Так какая у нас тема урока?
Слайд №1.
Аммиак. Соли аммония
Отлично. А какова тогда у нас цель нашего урока?
Слайд №2.
Изучить физические и химические свойства аммиака.
Рассмотреть разнообразие солей аммония
Химическая формула аммиака NН3.Так как азот более электроотрицательный элемент, чем водород, то химическая связь в молекуле аммиака ковалентная полярная.
Слайд №3.
Физические свойства.
Аммиак - бесцветный газ с характерным резким запахом, почти в два раза легче воздуха.
Аммиак – активное вещество. Реакции, в которых участвует аммиак, сопровождаются либо изменением степени окисления азота, либо образованием особого вида ковалентной связи.
При растворении аммиака в воде, образуется аммиачная вода, а 10% раствор аммиака в воде известен под названием нашатырный спирт.
При растворении в воде каждая молекула аммиака соединяется с одной молекулой воды, образуя гидрат аммиака-вещество, состав которого отражают формулой NH3*H2O.
В результате образуются ионы аммония NH4+ и гидроксид-ионы OH-.
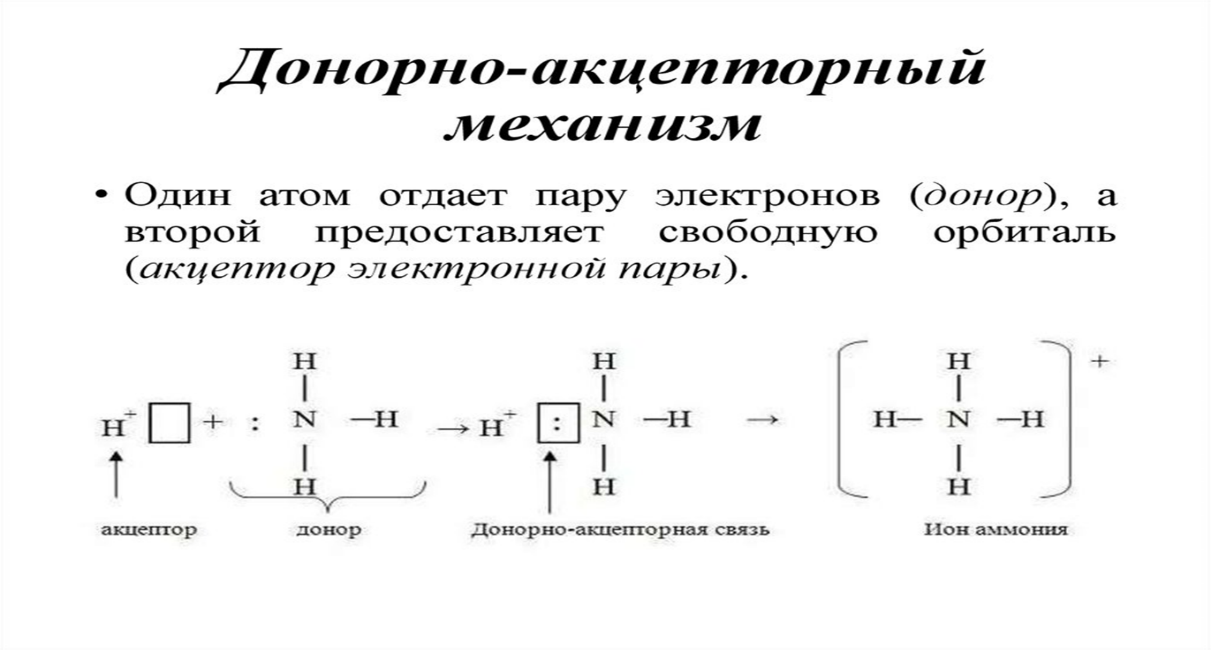
Механизм образования иона аммония аналогичен процессу образования иона гидроксония H3O+. Атом азота в молекуле аммиака имеет неподелённую электронную пару, а ион водорода свободную s-орбиталь. При взаимодействии аммиака с ионом водорода, атом азота является донором своей неподелённой электронной пар, а ион водорода ее акцептором. Так образуется четвертая ковалентная связь по донорно-акцепторному механизму. Этот процесс можно изобразить так
Слайд №4.
Слайд №5.
Химические свойства аммиака.
1.Связаные с изменением степени окисления азота.
а) Аммиак - непрочное соединение и при нагревании разлагается:
2NH3 = N2 + 3H2
б) аммиак горит в кислороде:
4NH3 + 3O2 → 2N2 + 6H20
в) в присутствие катализатора аммиак окисляется кислородом воздуха с образованием оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
Слайд №6.
2.Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму
а) аммиак реагирует с водой
б) аммиак реагирует с кислотами:
NH3 + HCl = NH4Cl
С многоосновными кислотами аммиак реагирует двояко.
NH₃ + H₂SO₄= NH₄HSO₄
2NH₃+ H₂SO₄ === (NH₄)2SO₄
Слайд №7.
Применение аммиака. (работа с учебником)
Используют для производства азотной кислота и азотных удобрений, а так же для получения аммиачной воды (применяют в медицине, с.х)
Аммиачную воду называют гидроксид аммония, а в быту нашатырным спиртом.
А теперь перейдем к изучению солей аммония.
Слайд №8.
Соли аммония - это сложные вещества, в состав которых входят ионы аммония NH4+,соединённые с кислотными остатками.
Примеры солей аммония ,
Многоосновные кислоты могут образовывать, так же кислые соли аммония
Слайд №9.
Получение солей аммония.
Соли аммония получают:
1. При взаимодействии аммиак с кислотами.
2. При нейтрализации аммиачной воды кислотами.
Слайд №10.
Физические свойства солей аммония.
Все соли аммония твердые, кристаллические вещества и, подобно солям щелочных металлов растворимы в воде.
Химические свойства солей аммония.
Соли аммония обладают общими свойствами всех солей и некоторыми специфическими свойствами.
Слайд №11.
1.Свойства общее с другими солями
а) сильные электролиты, в водном растворе диссоциируют на ионы:
NH4NO3 → NH4+ + NO3-
б) реагируют с кислотами:
(NH4)2CO3 + HCl → H2O + CO2↑ + NH4Cl
в) реагируют с другими солями:
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
г) Соли аммония подвергаются гидролизу.
Слайд №12.
2.Спецефические свойства.
а) при высокой температуре разлагаются:
NH4Cl → NH3 + HCl
б) реагируют со щелочами
NH4Cl + NaOH → NaCl + NH3 + H2O
Эту реакцию используют для распознавания солей аммония. Над пробиркой, в которой проходит реакция, держат смоченную водой красную лакмусовую бумагу и она синеет.
III. Закрепление материала
Слайд №13.
Запишите формулы следующих веществ: сульфат аммония, фосфат аммония, гидрофосфат аммония, дигидрофосфат аммония.
Слайд №14
Запишите уравнения реакций следующих превращений:
Азот → аммиак → монооксид азота → диоксид азота → азотная кислота → нитрат аммония
IV. Рефлексия.
Рефлексия эмоционального состояния, может использоваться на различных этапах урока. Учащиеся выбирают смайлики, которые соответствуют их настроению.
V. Домашнее задание.
Слайд №15.
§17. Упражнение 7. Творческое задание: сообщение на тему «Производство аммиака: от Габера до современности»
Приложение 1
| Вариант №1 От N до Bi увеличивается: А) металлические свойства Б) неметаллические свойства В) электроотрицательность Г) валентность 2. Какая общая формула у следующих соединений NH3,PH3,AsH3 А)HRO2 Б)HRO3 В)RH3 Г)R2O5 3. Выберете высшею степень окисления характерную для элементов VAгруппы А)+2 Б)+4 В)+5 Г)+3 4.Выберете уравнение реакции, где азот проявляет свойства окислителя А) 2NO+O2=2NO2 Б)3H2+N2=2NH3 В)N2+O2=2NO Г)2NO2+H2O+O2=4HNO3 5. В состав каких веществ входит азот А) Воде  Б) Жиров Б) Жиров
В) Углеводов Г) Белков | Вариант№2 От Bi до N увеличивается: А) металлические свойства Б) неметаллические свойства В) электроотрицательность Г) валентность Какая общая формула у следующих соединений N2O3,P2O3,As2O3 А) RH3 Б) HRO2 В) R2O5 Г) R2O3 3. Выберете низшую степень окисления характерную для элементов VAгруппы А)-1 Б)-3 В)-4 Г)-2 4.Выберете уравнение реакции, где азот проявляет свойства восстановителя А) 3Mg+N2=Mg3N2 Б)3H2+N2=2NH3 В)N2+O2=2NO Г)3Li+N2=Li3N 5. В состав каких веществ входит азот А) Воде Б) Жиров  В) Углеводов В) Углеводов
Г) Белков
|
Приложение 2



Приложение 3




10






 Б) Жиров
Б) Жиров














