Тема: «Аммиак. Соли аммония».
Цель: познакомиться с новым соединением аммиак, изучить строение его молекулы, свойства и получение аммиака, а также свойства солей аммония.
Задачи: 1. Образовательная: рассмотреть строение молекулы аммиака, повторив на ее примере ковалентную полярную связь. Познакомить учащихся с физическими свойствами аммиака (на их примере с водородной связью), собиранием, распознаванием и химическими свойствами аммиака (и на их примере с донорно-акцепторным механизмом образования ковалентной связи).
2. Развивающая: продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы. Умение высказывать свои мысли, логически рассуждать, соблюдать технику безопасности при встрече с аммиаком в быту.
3. Воспитательная: формировать умения работать с учебной и дополнительной литературой.
Тип урока: урок формирования и закрепления новых знаний
Основные понятия: аммиак, катион аммония, донорно – акцепторный механизм, соли аммония.
Методы: словесные: беседа, рассказ; наглядно – практические: демонстрация опытов, записи на доске, таблицы.
Ход урока:
Организационный момент.
Актуализация знаний.
Соединение, которое мы сегодня будем изучать, имеет древнюю историю.
Посредине ливийской пустыни стоял храм, посвященный богу
Амону Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали «аммониаком», а потом сократили название до «аммиак».
Изучение нового материала.
Как вы уже поняли, мы сегодня познакомимся с аммиаком.
Строение аммиака:
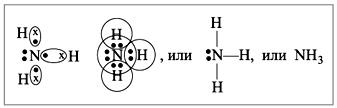
Электроны смещены в сторону азота (более электроотрицательный).
У аммиака ковалентная полярная связь, три одинарные сигма связи N – H.
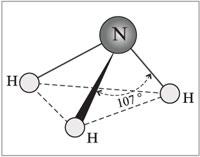
Молекула аммиака имеет форму треугольной пирамиды с атомом азота у вершины.
Молекулы аммиака в жидком состоянии взаимодействуют между собой, образуя водородную связь – это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов. Эта химическая связь в 20 раз слабее ковалентной.
Физические свойства: Аммиак – бесцветный газ с резким запахом, в 2 раза легче воздуха. Ядовит. При обычном давлении и температуре – 33,4̊С он сжижается. Хорошо растворим в воде.
10% раствор аммиака в воде – нашатырный спирт.
25% раствор аммиака в воде – аммиачная вода.
Химические свойства: 1. Взаимодействие с водой
NH3 + H2O ↔ NH3 × H2O ↔ NH4+ + OH-
Если добавить к раствору индикатор фенолфталеин, то он окрасится в малиновый цвет, т.к. щелочная среда в растворе.
2. Взаимодействие с кислородом
А) аммиак горит
4NH3 + 3O2 → 2N2 + 6H2O
Б) аммиак окисляется в присутствии катализатора
4 NH3 + 5O2 → 4NO + 6H2O
3. Взаимодействие с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2О
4. Взаимодействие с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
5. Аммиак разлагается при температуре
2NH3↔ N2 + 3H2
6. Взаимодействие с кислотами
NH3 + HCl → NH4Cl
Опыт «Дым без огня»: в стакан наливаем водный раствор аммиака – нашатырный спирт + концентрированную соляную кислоту, образуется дым.
Исторический факт: Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Теперь нам понятно, откуда взялся магический дым.
7. Образование катиона аммония по донорно – акцепторному механизму

Получение аммиака: 1. В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
2. В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
Соли аммония
Катион аммония играет роль катиона металла и образует с кислотными остатками соли. Соли аммония – это твердые вещества, хорошо растворимые в воде. Их свойства похожи на свойства солей калия, т.к. радиусы атома катиона калия и катиона аммония почти равны.
Получение: NH4OH + HCl → NH4Cl
Химические свойства: 1. Качественные реакции
NH4Cl + AgNO3 → NH4NO3 + AgCl↓
NH4SO4 + BaCl2 → NH4Cl + BaSO4↓
(NH4)2CO3 + HCl → NH4Cl + CO2 + H2O
NH4Cl +NaOH → NH3↑ + NaCl + H2O
2. Разложение при температуре
NH4Cl → NH3↑+ HCl↑
Применение: 1) в холодильных установках;
2) в медицине и быту;
3) для производства азотной кислоты, солей аммония;
4) как удобрение
Растворы аммиака широко используются в медицине. Разведенный раствор аммиака, издавна называемый нашатырным спиртом, дают нюхать при обморочных состояниях и алкогольном опьянении; при этом происходит рефлекторное возбуждение сердечной деятельности и центра дыхания. При тяжелом алкогольном отравлении практикуют прием внутрь слабых растворов аммиака (3 капли на полстакана).
Более слабые растворы аммиака дают отхаркивающий эффект (нашатырно-анисовые капли).
Местнораздражающее действие аммиака используют для приготовления препаратов, применяемых как отвлекающие средства (при артритах, невралгиях и т.п.).
Хлористый аммоний – белый кристаллический порошок. Слегка гигроскопичен. Имеет солоноватый вкус, легко растворим в воде. Применяется в качестве диуретического и отхаркивающего средства.
Закрепление знаний.
5. Домашняя работа. Параграф 36. Упр. 3,6.



















