Тема: Азот, распространение в природе, физические и химические свойства. Круговорот азота в природе
Цель: приобретение знаний о свойствах азота, его физических и химических свойствах, значение азота в круговороте веществ в природе.
Задачи:
изучить физические и химические свойства азота, роль в круговороте веществ и формировании облика планеты;
развивать навыки составления окислительно-восстановительных реакций, делать логические выводы при сопоставлении фактов;
формировать гражданскую позицию на примере решения проблемы загрязнения окружающей среды.
Междисциплинарные связи:
обеспечивающие: математика, биология;
обеспечиваемые: основы безопасности жизнедеятельности.
Литература:
Основная: Химия: 9-й класс: базовый уровень: учебник / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков. – Москва: Просвещение, 2023
Дополнительная: Большая энциклопедия Кирилла и Мефодия 2003. Компакт-диск. М.: ООО «Кирилл и Мефодий», 2002.
План урока
Организационный этап (проверка присутствующих на уроке, ознакомление с темой уроке, постановка целей урока).
Актуализация опорных знаний
Проверка домашнего задания.
Мотивация учебной деятельности
Осуществление учебных действий по освоению нового материала
Физкультминутка.
Первичное закрепление. Рефлексия.
Подведение итогов урока. Выставление отметок.
Домашнее задание.
Ход занятия:
I. Организационный этап
проверка присутствующих на уроке,
ознакомление с темой уроке,
учащиеся формулируют цель урока
II. Актуализация опорных знаний
Проверка домашнего задания, воспроизведение и коррекция опорных знаний учащихся.
осуществить превращение: S → SO2 → SO3 →Na2SO4
используя периодическую систему Д. И. Менделеева дать общую характеристику элементов VА группы,
расписать строение атома азота,
определить степени окисления атома азота а соединениях: NH3 NO2, HNO3
Учащиеся отвечают на вопросы, учитель записывает правильные ответы учащихся на доске в столбик. Первые буквы от каждого слова подскажут тему нашего урока.
1. Частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его химических свойств (атом)
2. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин …. (зарядов ядер их атомов)
3. Одна из аллотропных модификаций кислорода (озон)
4. Чему равна валентность азота в аммиаке (три)
Посмотрите на первые буквы ваших ответов. АЗОТ. Правильно.
III. Проверка домашнего задания
Проверка творческих работ обучающихся.
IV. Мотивация учебной деятельности
Александр Рулёв, доктор химических наук Иркутского института химии им. А. Е. Фаворского СО РАН, посвятил несколько работ азоту. Например, в журнале «Наука и жизнь» №1 январь 2025, в статье «Парадоксальный тривиальный азот» Рублев писал: «Азот — один из самых парадоксальных химических элементов таблицы Д. И. Менделеева. С одной стороны, он входит в состав молекул многих биологически активных соединений — витаминов, белков, нуклеиновых кислот и аминокислот. С другой стороны, азот, как простое вещество, не поддерживает горение, а помещённое в его атмосферу животное быстро погибает. Атмосферный азот N
2 — молекула, состоящая из двух атомов азота, — чрезвычайно инертен. В то же время некоторые азотсодержащие соединения — например, органические нитропроизводные или неорганические нитраты — компоненты сильных взрывчатых веществ. Можно сказать, что для человека азот — источник и жизни, и смерти».
Приведу ещё один пример, цитату об азоте из литературного произведения Л. Н. Толстой, «Четвёртая русская книга для чтения», 1886:
«Другая часть воздуха — азот. В нём дышать нельзя, и вещи не могут гореть».
V. Осуществление учебных действий по освоению нового материала
В VA-группе находятся p-элементы:
N, P, As — неметаллы;
Sb — полуметалл;
Bi, Nh — металлы.
На внешнем электронном слое атомов всех этих элементов содержится два s- и три p-электрона. В атомах элементов (кроме азота) на внешнем слое имеются вакантные обитали.
Задание 1. Записать строение электронных оболочек азота. 1s
22s
22p
3 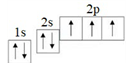
В VA-группе наблюдаются общие закономерности изменения свойств: с увеличением порядкового номера:
увеличивается радиус атома;
снижается электроотрицательность;
неметаллические свойства ослабевают, металлические усиливаются.
Наибольшее значение электроотрицательности и самые сильные неметаллические свойства среди элементов VA-группы имеет азот.
Атомы азота, фосфора, мышьяка могут принять по три электрона или отдавать до пяти валентных электронов. Низшая степень окисления равна −3, а высшая — +5. Задание 2. Определите степень окисления в соединениях: AlN
−3, NaNO
3, K
3PO
4 , N
2O
В основном состоянии атомы элементов имеют по три неспаренных электрона и могут образовать три ковалентные связи, т. е. проявляют валентность III. Азот в некоторых соединениях образует дополнительно одну связь по донорно-акцепторному механизму; для него максимальная валентность равна IV.
Задание 3. Составить схему «Азот в природе».
Азот в виде простого вещества находится в воздухе (78 % по объёму). В земной коре азот встречается в виде нитратов. Химический элемент азот содержится во всех живых организмах, так как является обязательной составной частью белков и нуклеиновых кислот.
Задание 4. Записать физические свойства азота, используя дополнительный материал. При обычных условиях азот представляет собой газ без цвета, запаха и вкуса, плохо растворимый в воде. У азота низкие температуры кипения и плавления (−196°C и −210°C). В химических реакциях азот неактивен из-за прочной тройной связи в его молекулах. В молекуле азота прочная тройная связь N≡N.
Задание 4. Превратите схемы в уравнения реакций:
| Ca+N2→ Li+N2→ N2+3H2→ N2+O2→ N2+O2→
| Ответ: 3Ca+N2=Ca3N2 (нитрид кальция); 6Li+N2=2Li3N (нитрид лития). N2+3H2⇄2NH3+Q. N2+O2⇄2NO. N2+O2⇄2NO |
VI. Физкультминутка
Выполним физкультминутку https://rutube.ru/video/b1a9c599eebf044b889ee5123f0f8297/
Задание 5. Рассмотрите слайд, на котором представлен круговорот азота в природе. Составьте по данному слайду рассказ о круговороте азота в природе, напишите уравнения реакций.
Задание 6. Изучите материал в учебник на стр. 88, §16 и составьте схему «Применение азота».
VII. Первичное закрепление. Рефлексия
Вопросы: 1. В чем причина малой химической активности простого вещества азота? 2. Дайте общую характеристику VA-группы на основании их положения в Периодической системе Д.И. Менделеева. Задача. Рассчитайте массовую долю азота в N
2O.
VIII. Подведение итогов урока. Выставление отметок
Метод «Микрофон»
1. Сегодня на уроке я узнал …..
2. На уроке я понял …….
При выставлении отметки учитывается работа на уроке.
IX. Домашнее задание
Изучить §16, подготовить сообщение об азотных удобрениях.
Список используемой литературы
1. Химия: 9-й класс: базовый уровень: учебник / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков. – Москва: Просвещение, 2023
2. Большая энциклопедия Кирилла и Мефодия 2003. Компакт-диск. М.: ООО «Кирилл и Мефодий», 2002.
3. Электронный журнал «Наука и жизнь» №1 январь 2025. Режим доступа https://www.nkj.ru/archive/articles/35711/?ysclid=m5sbas9doz17400722
4. Библиотека ЦОК https://lesson.edu.ru/catalog
4


















